子宫内膜异位症不孕患者全胚冷冻和鲜囊胚移植妊娠结局比较*
2022-03-23岳彩欣张亚男许鑫鑫
岳彩欣,于 倩,张亚男,许鑫鑫,颜 磊
(1.山东大学附属生殖医院,济南 250012;2.山东省生殖健康临床医学研究中心,济南 250012;3.国家辅助生殖与优生工程技术研究中心,济南 250012)
子宫内膜异位症(endometriosis,EMs)是以子宫内膜腺体或基质生长在子宫腔外为特征的慢性妇科疾病[1-2]。据报道,育龄期女性的EMs患病率为10%~15%[3]。EMs与不孕症密切相关,EMs不孕症患病率可达到30%~50%,而在普通女性中患病率仅为3%~12%[3-4]。辅助生殖技术(assisted reproductive technology,ART)是治疗EMs相关不孕的有效方法[5],其成功率不仅与胚胎质量有关,还依赖于胚胎-子宫内膜相互作用及子宫内膜容受性[6-7]。越来越多的文献证据表明,控制性超促排卵(controlled ovarian hyperstimulation,COH)由于其超过生理量的激素水平,可能损害子宫内膜容受性[8-9]。因此,全胚冷冻已成为一些生殖中心的常规程序,且已有文献证明“全胚冷冻”在预防卵巢过度刺激综合征(ovarian hyperstimulation syndrome,OHSS)和恢复子宫内膜容受性方面安全有益[10]。“全胚冷冻”方案的优势在于可提供更有利于胚胎着床的生理环境,以获得较好的妊娠结局,降低妊娠相关母婴并发症的发生[11]。一项多中心、随机对照试验(randomised controlled trial,RCT)证实,与鲜胚移植相比,冻胚移植在多囊卵巢综合征(polycystic ovary syndrome,PCOS)不孕患者中可显著提高活产率和降低OHSS发生风险[12]。另一项研究表明,在薄型子宫内膜患者中,全胚冷冻组的活产率和临床妊娠率明显高于鲜胚移植组[13]。但EMs相关不孕患者鲜胚移植和冻胚移植比较的研究较少,且多是分析EMs不孕患者鲜胚、冻胚移植的不同。一项回顾性研究证明,延期胚胎移植的累积临床妊娠率和累积继续妊娠率显著高于鲜胚移植组[14]。另一项配对队列研究则表明,全胚冷冻组与鲜胚移植组在分娩方式、新生儿性别和胎龄方面无显著差异,但前者的着床率、临床妊娠率和活产率显著高于后者[15]。目前全胚冷冻或鲜囊胚移植在EMs患者中的临床效果尚不明确。本研究旨在评估全胚冷冻能否改善EMs不孕患者的妊娠结局,以降低孕产妇和新生儿并发症的发生。
1 资料与方法
1.1 研究人群 采用回顾性队列研究,收集2014年1月1日至2018年12月31日行IVF/ICSI的EMs不孕患者的相关数据。EMs的诊断以腹腔镜、经阴道超声(transvaginal ultrasound TVS)为主[16]。纳入标准:腹腔镜或TVS证实EMs且均行囊胚移植。排除标准:子宫肌瘤,子宫畸形(单角子宫,双角子宫和纵隔子宫)。不排除男性因素不育和使用供精者。患者依据方案分为两组:鲜胚移植组与全胚冷冻移植组,采用倾向性评分匹配(propensity score matching,PSM)进行1∶1匹配,匹配容差为0.02,且不进行替换。根据基线特征和可能影响妊娠结局的胚胎移植变量计算倾向性评分,使用logistic回归模型计算倾向评分。主要变量为年龄、体质量指数(body mass index,BMI)、不孕类型(原发或继发)、基础窦卵泡数(antral follicle count,AFC)、基础卵泡刺激素(follicle stimulating hormone,FSH)、基础黄体生成素(luteinizing hormone,LH)、基础雌激素(estradiol,E2)及扳机日子宫内膜厚度。该过程使用SPSS PSM插件完成。
1.2 研究过程 患者依据本生殖中心的常规诊疗程序进行促排卵、卵泡监测、取卵、培养、内膜准备、胚胎移植等过程[12]。依据患者的年龄、BMI、卵巢储备等其他因素选择恰当的促排卵方案,主要有长方案、超长方案、拮抗剂方案、短方案、自然周期等方案,并依据超声监测卵泡发育的大小调整药物用量直至注射人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)进行扳机,注射HCG 36h进行取卵。依据男方精液质量选择合适的受精方法(IVF或ICSI)。进行鲜胚移植的患者取卵后开始黄体支持,包括口服和阴道放置两种药物,在囊胚移植后2周,查血HCG,若HCG为阳性,阴道用药至超声确定有胎芽及胎心,口服药物至10周。进行全胚冷冻患者,全部胚胎培养至囊胚进行冷冻,取卵至少4周后,根据临床经验选择内膜准备方案,主要有自然周期、人工替代周期、促排卵周期等进行冻囊胚移植。胚胎培养、评分、分级、冷冻、复苏及不同内膜准备方案的用药和黄体支持依据本生殖中心报道的标准执行[17]。
1.3 研究结果 主要妊娠结局为活产率,定义为妊娠28周及以上活产婴儿的分娩率[12]。次要妊娠结局包括:累积妊娠率、生化妊娠率、临床妊娠率、早产率、生化妊娠流产率、早期流产率、中期流产率及剖宫产率,累积妊娠率定义为移植完一个取卵周期的所有胚胎后,其中成功妊娠人数占所有取卵周期患者总数的百分比[14]。生化妊娠率定义为移植后14天HCG水平大于10mIU/mL的妇女数量占所有移植人数的百分比。临床妊娠率定义为超声检查中检测到孕囊的妇女占所有移植人数的百分比。生化妊娠流产率定义为在血、尿检查中发现HCG数值升高,但在B超检查时没有在宫内或宫外发现有孕囊生成,随后HCG值出现下降的妇女占所有移植人数的百分比。早期流产率定义为妊娠12周内流产人数占临床妊娠妇女的百分比。中期妊娠流产率定义为妊娠12~28周期间的流产人数占临床妊娠妇女的百分比。剖宫产率定义为剖宫助娩孕妇占分娩孕妇的百分比。孕妇并发症主要包括:GDM、妊娠期高血压、胎膜早破、前置胎盘。新生儿并发症主要包括:畸形、死亡及住院。相关定义和计算方法依据我们之前的研究[18]。
2 结 果
2.1 研究人群 根据纳入排除标准,研究期间共2831例EMs不孕患者在本中心进行了胚胎移植,其中进行全胚冷冻与鲜囊胚移植者916例,PSM 1∶1匹配,共有462例患者纳入研究。纳入研究的患者均在该时间内进行了第一次取卵周期,两组各有231例。
2.2 基线特征与促排卵结局 两组的抗苗勒管激素(anti-mullerian hormone,AMH)、获卵数及扳机日雌激素水平比较,差异有统计学意义(P<0.05)。全胚冷冻组囊胚移植前有23例患者使用促性腺激素释放激素激动剂(gonadotropin-releasing hormone agonist GnRH-a),其中16例使用1支3.75mg GnRH-a,5例使用2支,2例使用3支。鲜囊胚移植组中24例使用1支,2例使用2支。两组在使用GnRH-a例数上差异无统计学意义。见表1、2。
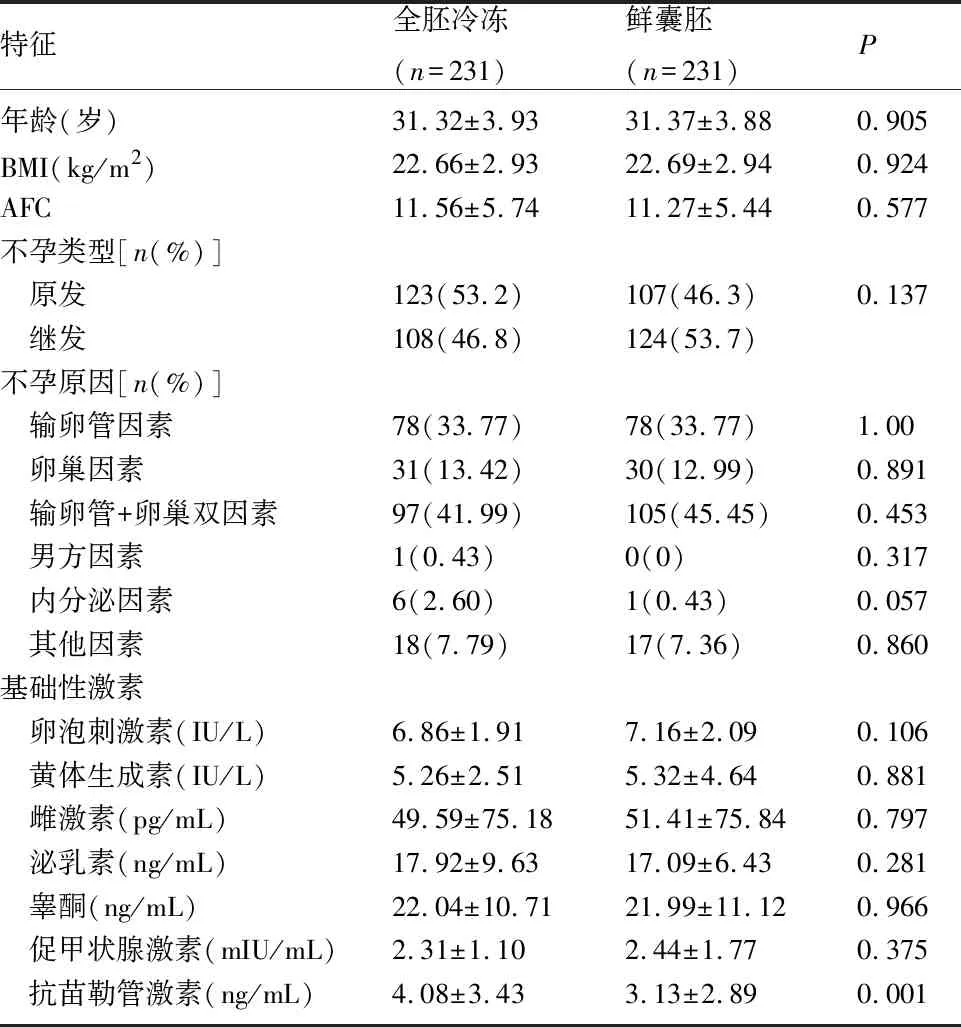
表1 患者的基线特征
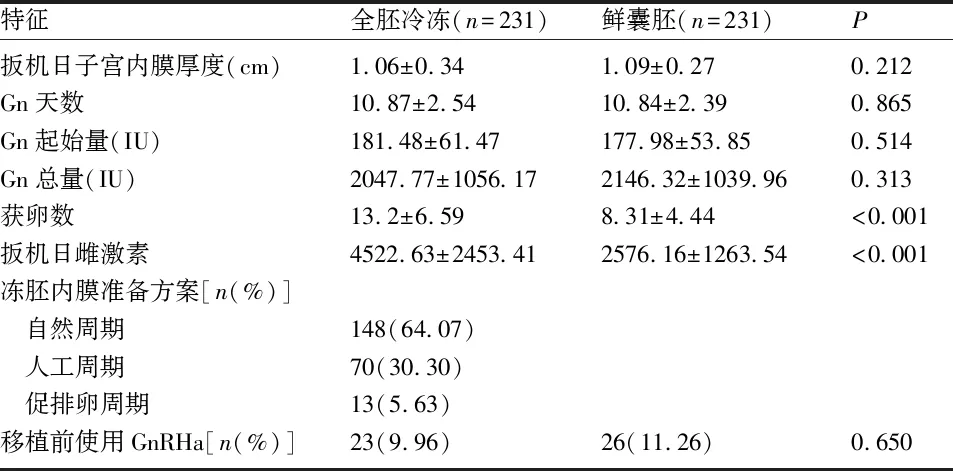
表2 促排卵结局
2.3 妊娠结局 全胚冷冻移植组共有108例活产(46.75%,100例单胎,8例双胎)高于鲜囊胚移植组的87例(37.7%,84例单胎,3例双胎),差异有统计学意义(OR=1.45,95%CI为1.00~2.11,P=0.048)。两组的新生儿出生体重、生化妊娠率、早期流产率、中期流产率等妊娠结局无明显差异,但与鲜囊胚移植相比,全胚冷冻组具有较高的临床妊娠率(57.15% vs 43.72%,OR=1.72,95%CI为1.19~2.48,P=0.004)、较低的生化妊娠流产率(10.20% vs 24.63%,OR=0.35,95%CI为0.18~0.68,P=0.002)及较高的累积妊娠率(77.06% vs 61.04%,OR=2.14,95%CI为1.43~3.21,P<0.001)。见表3。
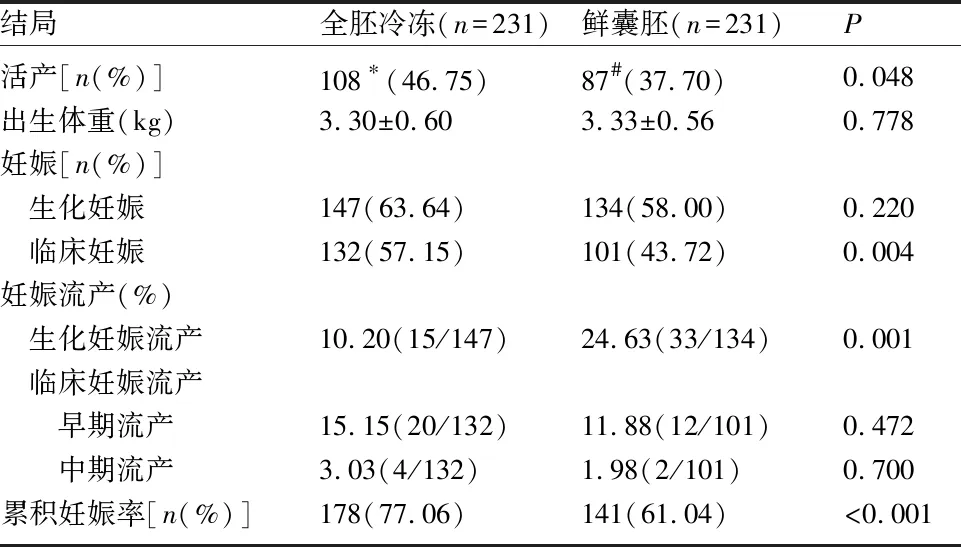
表3 妊娠结局
两组达到临床妊娠的患者中,全胚冷冻组有2例(1.52%)发生GDM,显著低于鲜囊胚移植组的8例(7.2%),差异有统计学意义(P=0.022)(表4)。两组的妊娠期高血压、前置胎盘、早产、剖宫产等妊娠并发症及合并症发生率比较,差异无统计学意义(P>0.05)。冻融囊胚组、鲜囊胚组分别有3例、2例新生儿死亡,两组的新生儿畸形、死亡、住院、性别、低出生体重儿等新生儿情况方面无明显差异。对年龄、BMI、AFC、AMH、扳机日雌激素水平、获卵数进行校正后发现,与移植鲜囊胚相比,全胚冷冻组可获得较高的累积妊娠率(77.06% vs 61.04%,aOR=1.72,95%CI为1.08~2.75,P=0.024)及较低的生化妊娠流产率(10.20% vs 24.63%,aOR=0.35,95%CI为0.16~0.76,P=0.008)和GDM发生率(1.52% vs 7.20%,aOR=0.13,95%CI为0.02~0.86,P=0.034),两组在其他妊娠结局及母婴并发症方面,差异无统计学意义。见表5。
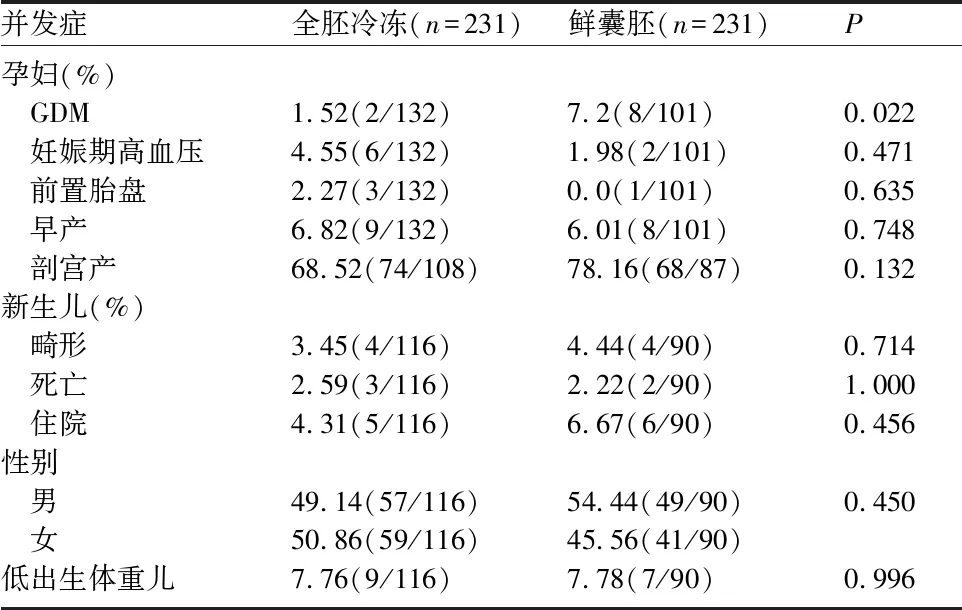
表4 母婴并发症
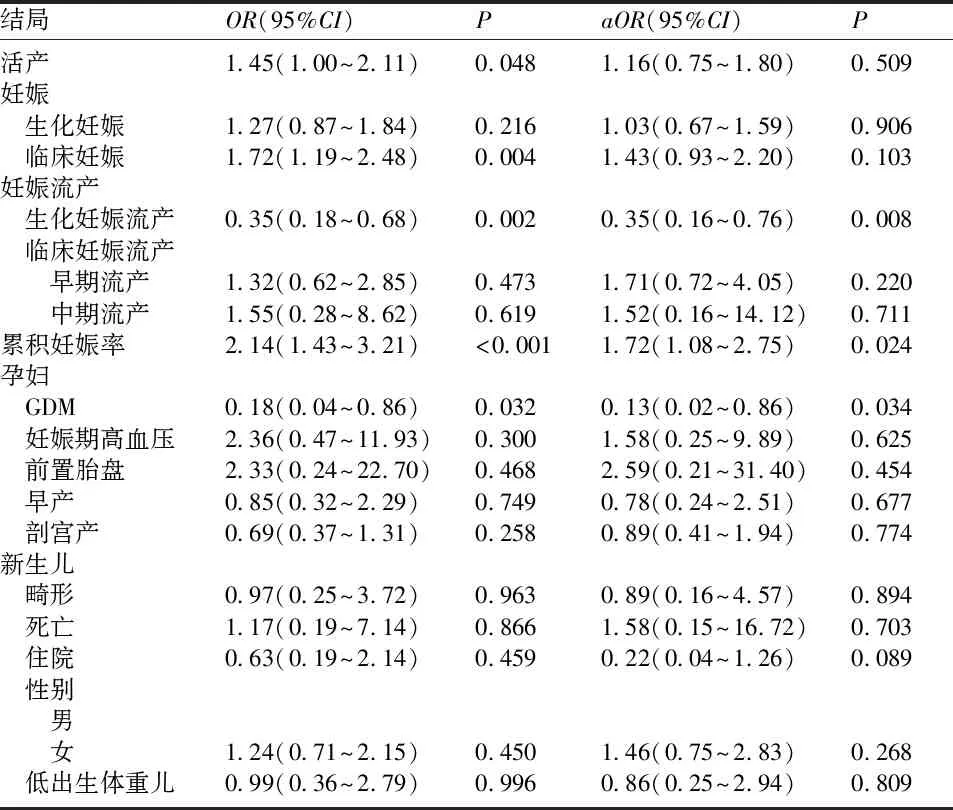
表5 校正变量后
3 讨 论
腹腔镜检查和对可疑病变进行病理检查是诊断EMs的可靠方法,但手术具有侵袭性且有风险。TVS和核磁共振成像(magnetic resonance imaging,MRI)可作为EMs的替代诊断方法[19]。一项meta分析显示,TVS和MRI在诊断深度浸润EMs时无差异,证实TVS是诊断EMs的一线和成本效益高的技术[16]。
陈子江等[12]研究表明,在PCOS不孕症女性中,全胚冷冻可明显提高活产率,降低OHSS发生率。临床试验表明,在无PCOS和有排卵的不孕症患者中,两组的活产率和继续妊娠率无明显差异[20-21]。一项配对队列研究中,全胚冷冻组与鲜胚移植组的分娩方式、新生儿性别和胎龄无显著差异,但前者的着床率、临床妊娠率和活产率显著高于后者[15]。另一项包括135例EMs的回顾性研究表明,延期胚胎移植的累积临床妊娠率和累积继续妊娠率显著高于鲜胚移植组(43.0% vs 29.6%,34.8% vs 17.8%)[14]。本研究结果显示,与鲜囊胚移植组比较,EMs患者取卵后全胚冷冻累积妊娠率显著提高;全胚冷冻移植比鲜囊胚移植有更高的活产率与临床妊娠率,但两者在校正混杂因素后无统计学差异,两组的临床妊娠流产率无显著差异。有研究认为,鲜胚、冻胚移植对新生儿出生体重无影响[22-23],这与本研究结果一致。但Tan等[24]研究表明,“全胚冷冻”方案并不能改善EMs不孕女性的妊娠结局。
有研究认为,EMs患者移植前GnRH-a可改善助孕患者的妊娠结局,但目前仍有争议。研究发现,行替代周期冻胚移植的子宫腺肌病患者,移植前GnRH-a预处理并不能改善临床妊娠率和活产率[25]。Cao等[26]的meta分析表明,EMs患者行IVF胚胎移植时,GnRH-a超长方案可改善RCT研究中患者的临床妊娠率,但非RCT中不同的降调节方案无明显差异。
本课题组前期研究显示,排卵正常的女性中,与鲜单囊胚移植相比,接受冷冻单囊胚移植的预后较好且单胎活产率更高[17]。本研究中EMs不孕症患者分别在研究时间内进行了第一个取卵周期的“全胚冷冻”囊胚移植和鲜囊胚移植。另一项研究则表明,在月经周期规律的女性中,继续妊娠率和活产率差异无统计学意义[27]。一项荟萃分析表明,在IVF/ICSI中,无论是鲜胚移植还是全胚冷冻,囊胚移植与卵裂期胚胎移植相比都能降低异位妊娠率[28]。
Liang等[29]研究表明,重度EMs患者的IVF/ICSI婴儿更可能患有先天性畸形,特别是心血管系统和肌肉骨骼系统。本研究发现,两组的先天性畸形发生率无差异,可能与样本量较少有关。既往研究表明,EMs的严重程度可能对ART妊娠后的早产率和前置胎盘率有不良影响[30]。Geber等[31]研究认为,IVF结局与EMs严重程度无关。Gasparri等和Harada等指出,即使不考虑EMs严重程度,其仍增加胎膜早破和前置胎盘的风险[32-33]。本研究发现,全胚冷冻移植组的GDM发生风险明显低于鲜囊胚移植组,而早产率、前置胎盘率无显著差异,而EMs严重程度可能是混杂因素,需进一步研究。鲜囊胚组的GDM发生率高可能与胰岛素抵抗及孕激素水平高有关。Tascilar等[34]研究显示,促性腺激素释放激素类似物GnRH-a治疗特发性中央性早熟(idiopathic central precocious puberty,ICPP),BMI轻度增加,胰岛素抵抗(insulin resistance,IR)明显升高;鲜囊胚移植前进行COH,GnRH-a可能导致IR,冻囊胚移植时距COH有一定时间,IR可能会有一定程度恢复。Pieard等[35]研究显示,GDM与循环中孕激素水平升高有关。孕激素可加速雌性小鼠的糖尿病进程,而黄体酮受体拮抗剂可降低雌性小鼠的血糖水平。本研究中10例GDM孕妇孕前血糖均正常且无发生GMD的高危因素,因不常规检查胰岛素抵抗,故无法排除胰岛素抵抗是否存在,这是本研究的不足之处。全胚冷冻移植与鲜囊胚移植组均用黄体支持,但前者自然周期占比较大,可能两种移植方案黄体支持用量的差异导致了两组GDM的不同,也可能是由于回顾性研究的选择性偏倚,需更大样本量进行验证。
综上所述,EMs不孕患者中,全胚冷冻囊胚移植可获得较高的累积妊娠率及较低的GDM风险。建议EMs不孕症女性优先选择全胚冷冻移植方案,若进行了鲜囊胚移植,则应尽早监测、控制血糖,以减少GDM发生。但本研究有一定的局限性:样本量相对较小;系回顾性队列研究,在数据收集中存在选择偏倚;系单中心回顾性分析,需进一步多中心随机临床试验来证实研究结果。
