胎儿颈项透明层增厚的产前遗传学诊断及妊娠结局*
2022-03-23唐海燕李艳颜张家怡甘万霞贾亦真林胜谋
曾 婷,唐海燕,李艳颜,张家怡,甘万霞,贾亦真,林胜谋
(香港大学深圳医院,深圳 518053)
颈项透明层(nuchal translucency,NT)是孕早期胎儿颈后部出现的一层无回声带,为皮下组织内积聚的液体。NT增厚程度与胎儿染色体异常呈正相关,随着NT的增厚,胎儿异常与不良妊娠结局的风险也增加[1]。当胎儿NT值大于或等于3.0mm(第95百分位数)时[2-3],建议行侵入性产前诊断,获取胎儿组织(绒毛、羊水、脐血)进行遗传学检测(如染色体核型分析、染色体微阵列分析等)。本文回顾性分析并总结了90例NT增厚的单胎胎儿的核型分析结果与染色体微阵列分析(chromosome microarray analysis,CMA)结果以及妊娠结局,以期为NT增厚胎儿的早期临床咨询与如何选择相关的产前遗传学检测方案提供参考。
1 资料与方法
1.1 资料来源 2017年10月至2019年9月在香港大学深圳医院产前诊断中心因妊娠早期超声筛查为NT增厚(NT≥3.0mm)胎儿共163例,实际纳入单胎胎儿共90例。其中85例行侵入性产前诊断,5例由于合并严重畸形而直接终止妊娠后取样检测。孕妇在进行相关检测前均进行了遗传咨询并签署知情同意书。
1.2 研究方法
1.2.1 超声检查 由获得英国胎儿医学基金会(Fetal Medicine Foundation,FMF)妊娠早期超声检查资质认证的医师按照FMF的NT值测量质控标准进行测量,测量NT的同时或行侵入性产前诊断前(如孕17周左右)进行系统胎儿结构超声筛查。
1.2.2 产前诊断 对NT≥3.0mm孕妇,经遗传咨询并知情同意后,根据B超孕周选择行绒毛活检、羊膜腔穿刺术或脐静脉穿刺术取样进行染色体核型分析和CMA。由于胎儿严重畸形而直接选择终止妊娠的孕妇,则在引产后取胎儿脐带直接进行CMA。
1.3 检测方法
1.3.1 染色体核型分析 对胎儿的标本进行常规细胞培养、制片、G显带,进行显微镜下计数20个核型,分析5个核型,按人类细胞遗传学国际命名体制(ISCN2016)标准进行染色体核型描述。
1.3.2 染色体微阵列分析 胎儿DNA提取并进行母源性污染检测排除后,进行CMA检测。采用美国Affymetrix公司的CytoScan 750K芯片或美国Agilent公司的Agilent Sure Print G3 Unrestricted CGH ISCA v2.0 8X60K芯片按各自相应的检测流程进行检测。检测出的CNV根据内部数据库与公共数据库:基因剂量效应数据库(ClinGen)(https://www.clinicalgenome.org/)、基因组变异数据库(DGV)(http://projects.Tcag.ca/variation)、DECIPHER数据库(http://www.sanger.ac.uk/PostGenomics/decipher)、细胞基因组阵列国际标准数据库(ISCA)(https://www.iscaconsortium.org/)、人类孟德尔遗传在线数据库(OMIM)(http://www.omim.org)和美国加利福利亚州圣克鲁兹分校基因组数据库(UCSC)(http://www.genome.UCSC.edu/)进行比对分析,并根据美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics,ACMG)对染色体拷贝数变异(copy number variants,CNV)结果解读指南[4-5],将CNV分为良性CNV、可能良性CNV、致病性CNV、可能致病性CNV和临床意义不明确(variants of uncertain significance,VOUS)的CNV。
1.4 随访 对所有胎儿的父母进行病例随访或电话随访,了解其妊娠结局及新生儿出生情况。新生儿健康活产:新生儿出生时无明显结构畸型。
1.5 统计学方法 采用SPSS 26.0软件。计数资料采用频数和率表示,采用χ2检验进行组间比较。P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况 孕妇中位年龄31岁(23~44岁),胎儿中位NT值为3.7mm(3.0~8.1mm)。90例胎儿中,单纯NT增厚组胎儿有70例(77.8%,70/90),NT增厚合并其它超声异常组胎儿有20例(22.2%,20/90)。超声异常包括:鼻骨缺失、心脏畸形、脐膨出等。
2.2 染色体核型分析结果 85例行产前穿刺术的胎儿中,1例绒毛染色体核型分析细胞培养失败,无核型结果。染色体核型异常11例,异常检出率12.9%,其中9例为染色体非整倍体异常,包括7例21三体、2例18三体;另2例为染色体片段异常,包括47,XX,dup(15)(q11.2q12),+psu idic(22)(q11.2)及46,XY,del(13)(q12.3q14.3);其余73例结果正常。见表1。
2.3 CMA检测结果 85例行产前穿刺术的胎儿中,CMA结果异常18例,异常检出率21.2%;其中10例为染色体非整倍体异常,包括7例21三体、2例18三体、1例13三体(核型培养失败病例);4例含有致病性CNV(表2),3例含有VOUS CNV和1例部分单亲同二体(表3);其余67例结果正常。
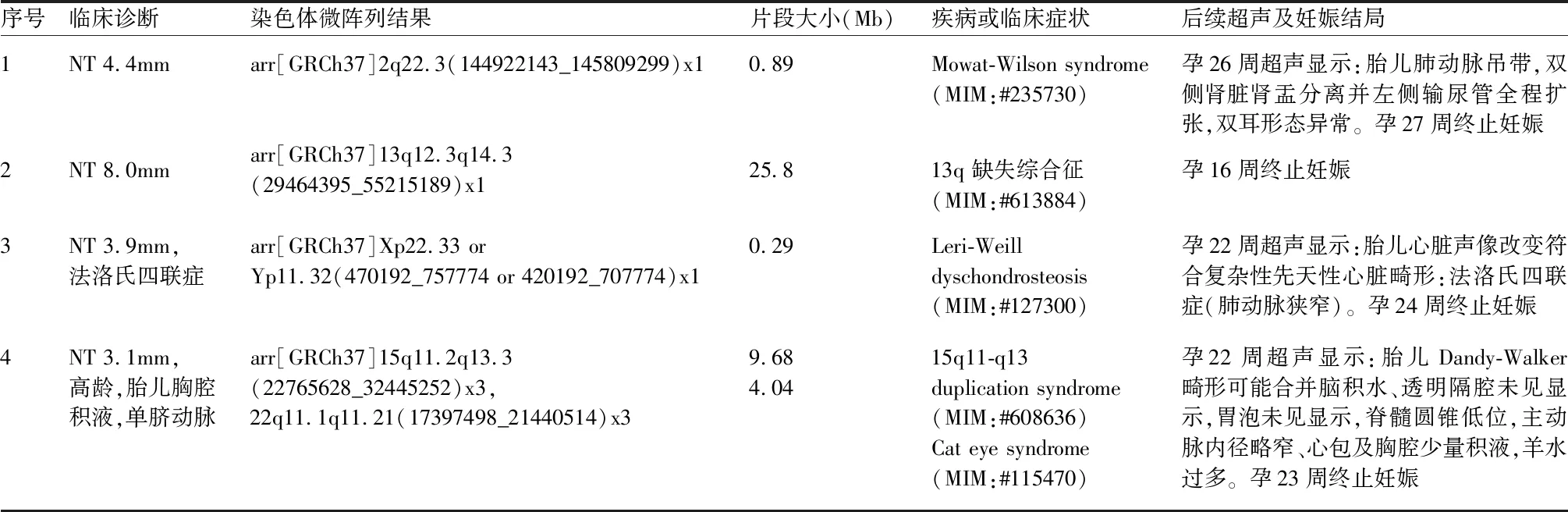
表2 4例含有致病性CNV胎儿CMA结果、后续超声及妊娠结局

表3 3例含有VOUS CNV和1例部分单亲同二体胎儿CMA结果、后续超声及妊娠结局
5例合并严重畸形,经产前咨询后终止妊娠取样直接行CMA检测;4例为染色体非整倍体异常,包括1例21三体、2例18三体、1例13三体;另1例NT 7.5mm,胎儿全身水肿伴有颈部水囊瘤,但CMA检测结果正常。
2.4 胎儿情况
2.4.1 单纯NT增厚胎儿 70例单纯NT增厚胎儿中,检出染色体正常胎儿60例,染色体异常胎儿10例,其中5例为染色体非整倍体异常,2例为致病性CNV异常,2例含有VOUS CNV和1例部分单亲同二体胎儿。
70例单纯NT增厚胎儿中,11例选择终止妊娠,最终分娩59例。其中58例新生儿出生时均无异常;1例NT 5.0mm新生儿存在出生缺陷,表现为低耳位、生殖器畸形、髋关节异常、先天性喉软骨发育不良、先天性甲状腺功能低下和先心病,进一步检测后确诊为典型的OHDO综合征。
以NT中位值3.7mm为截断值,将单纯NT增厚分为两组:NT厚度3.0~3.7mm共49例(70%,49/70),NT厚度>3.7mm共21例(30%,21/70)。两组的妊娠结局比较,差异有统计学意义(χ2=9.272,P<0.05)。见表4。

表4 单纯NT增厚病例中不同NT厚度组的妊娠结局
2.4.2 NT增厚合并其他异常胎儿 20例NT增厚合并其它超声异常胎儿中,检出染色体正常胎儿8例,染色体异常胎儿12例,其中9例为非整倍体异常,2例为致病性CNV异常,1例为VOUS CNV。
20例NT增厚合并其它超声异常胎儿中,14例选择终止妊娠,最终分娩6例。其中4例新生儿出生时无异常,其孕期超声诊断包括水囊瘤、NF增厚、三尖瓣反流以及双肾稍强回声和后颅窝池稍宽;2例新生儿存在出生缺陷,1例出现先天膈疝,另1例出现肺动脉主干稍窄、左右肺动脉稍窄和三尖瓣轻微反流。
2.4.3 两组间比较 单纯NT增厚与NT增厚合并其它超声异常胎儿的染色体异常率比较,差异有统计学意义(χ2=17.601,P<0.05)。经侵入性产前诊断排除染色体异常,单纯NT增厚组与NT增厚合并其它超声异常胎儿的健康新生儿活产率比较,差异有统计学意义(χ2=25.200,P<0.05)。见表5。
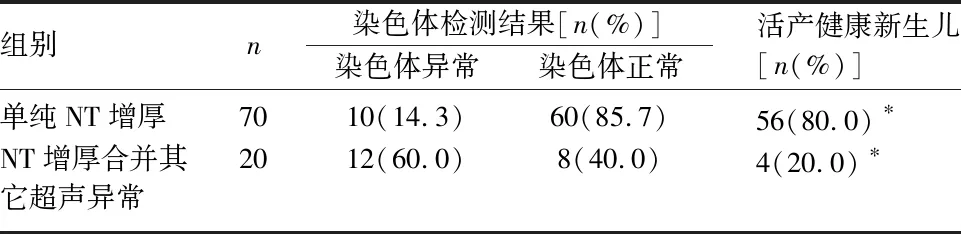
表5 NT增厚胎儿的染色体异常率及健康新生儿活产率
2.5 全基因外显子组测序分析 NT增厚但CMA正常的胎儿在后续生长发育中,仍有预后不良的可能[3]。通过随访得知,2例病例在产前诊断后进行了全外显子组测序(Whole-exome sequencing,WES)。1例胎儿NT为5.0mm,产前诊断核型分析和CMA均未见异常;出生后,由于面部、四肢以及心脏均出现异常,进行了核心家系全基因外显子组测序分析(Trio-WES)。WES结果提示KAT6B基因存在杂合突变c.4205-4206delCT(p.Ser1402CysfsTer 5)。其父母此位点为野生型,该位点为新发突变,该变异为移码突变,预测可能导致该基因蛋白编码提前终止,而导致蛋白失去功能,该致病基因与OHDO综合征相关,呈常染色体显性遗传。
另1例胎儿NT为6.0mm,产前诊断核型分析和CMA均未见异常;由于孕妇在中孕期的结构超声中发现胎儿心脏畸形(矫正型大动脉转位),经遗传咨询后行Trio-WES。WES检测到PTPN11基因c.1381G>A(p.Ala461Thr)杂合变异,其父母该位点为野生型,为新发突变。该变异为错义突变,致病基因与Noonan综合征(Noonan Syndrome,NS)相关,呈常染色体显性遗传。
3 讨 论
3.1 NT增厚胎儿CMA结果分析 85例NT增厚胎儿同时进行染色体核型分析与CMA检测,在染色体非整倍体与染色体大片段异常检测中,两种检测结果相符。此外,CMA的异常检出率比核型分析提高了8.3%,多检测出2例致病性CNV、3例VOUS CNV和1例部分单亲同二体。病例1胎儿(表2)CMA结果显示,胎儿在2号染色体q22.3区段有887Kb缺失,其中包含ZEB2基因。OMIM数据库和一些文献显示,ZEB2基因的单倍剂量不足可导致Mowat-Wilson syndrome,是一种罕见的常染色体显性遗传病,临床特征包括智力障碍、癫痫、生长和运动发育迟缓、先天性心脏病、生殖器畸形、胼胝体缺乏等[6]。例3胎儿(表2)CMA结果显示,X染色体p22.33或Y染色体p11.32存在288Kb缺失,其中包含SHOX基因。OMIM数据库和一些文献显示SHOX基因的单倍剂量不足引起的疾病表型谱可从严重的Leri-Weill软骨生成障碍(Leri-Weill dyschondrosteosis,LWD)到轻度的特发性身材矮小(Idiopathic short stature,ISS),呈显性遗传,主要临床表现有短颈、上肢中部短缩、马德隆氏(Madelung)畸形[7]。3例意义不明CNV都进行了家系验证(表3),病例1与病例2的CNV都属母系遗传;病例4的CNV为新发突变。对于产前意义不明确CNV,应充分结合后续动态的超声观察与家族史综合分析。意义不明确CNV对临床医生的处理存在挑战,因此应做好检测前后的咨询工作。
CMA与染色体核型分析相比,可额外检出染色体结构的微缺失或微重复变异,变异区段所涉及的基因、发生的位置以及片段大小。杨丹等[8]对815例NT增厚胎儿进行评估,发现核型正常胎儿的致病性CNV检出率为2.3%。本研究也有2.2%(2/90)的致病性CNV检出率,基本与文献研究结果一致。核型分析需经历培养过程,细胞可能对培养不敏感而不生长或选择性过度生长,导致最终结果出现偏差。CMA检测一般用原始标本提取DNA,检测结果更能反映真实结果。在2018年国际产前诊断协会(International Society for Prenatal Diagnosis,ISPD)、美国母胎医学学会(Society for Maternal-Fetal Medicine,SMFM)和围产质量基金会(Prenatal Quality Foundation,PQF)发表的有关全基因组测序在胎儿遗传学诊断中的应用联合声明中,已将CMA列为产前标准遗传学诊断方法[9]。
3.2 探索全外显子测序在NT增厚胎儿中的临床应用 NT增厚除了与染色体非整倍体、染色体拷贝数变异相关以外,还有一部分的致病因素与单基因疾病有关。本研究有2例病例在后续基因测序中检测出KAT6B基因异常所致的OHDO综合征和PTPN11基因突变所致的Noonan综合征。与Lonardo等[10]报道类似,KAT6B基因这一致病位点的患者具有典型的OHDO综合征Say-barber-biesecker变异型(Ohdo syndrome,SBBYS variant,SBBYSS)(MIM:603736)的表型特征,表型均以显著的全身发育迟缓、智力障碍、肌张力减退、男性生殖器异常(隐睾)、髌骨发育不良或不全、先天性心脏缺陷、牙齿异常、髋关节和膝关节屈曲挛缩、下肢关节僵硬和面部僵硬等异常。在对此患儿1岁内随访中,发现精神运动发育迟缓、先天性心脏缺陷、先天性甲状腺功能减退和肌张力低。
Noonan综合征(Noonan Syndrome,NS)(MIM:163950)胎儿期的主要临床指征包括NT增厚、颈部水囊瘤、胎儿水肿、胸膜积液、羊水过多、先天性心脏病、肾脏发育异常等。Lee等[11]曾报道带有PTPN11基因这一致病位点的患者具有典型的Noonan综合征表型特征,与此病例印证。
Xue等[12]研究表明,NT增厚(NT≥3.0mm)胎儿在染色体核型分析和CMA检测均为阴性时,额外有13%的病例通过WES的检测得到遗传诊断。Mellis等[13]回顾性分析表明,对于单纯性NT增厚的胎儿,WES诊断率较低(1.8%);对于NT增厚合并其它结构异常的胎儿,WES诊断率显著升高(22.2%);在后续超声发现异常的胎儿中,WES诊断率也明显升高(32.4%)。2020年ACMG发布了《胎儿外显子组检测技术在产前诊断中的应用指南》,这一指南在应用场景、检测策略、检测周期、报告范围以及遗传咨询这五大方面给予了详细建议[14],使得WES作为超声结构异常的胎儿在核型分析和CMA均为阴性后的临床应用成为可能。
3.3 NT增厚胎儿的妊娠结局 单纯NT增厚组中,以NT中位值3.7mm为截断值分组,NT厚度>3.7mm的胎儿比NT厚度为3.0~3.7mm的不良妊娠结局高40%。这将为临床咨询以及临床决策提供本地数据参考。
本研究中,单纯NT增厚胎儿的健康新生儿活产率为80%。Tekesin回顾分析10年的NT增厚胎儿相关数据[15],经产前诊断排除染色体异常的健康新生儿活产率为83.7%,本研究与之相近。本研究显示,单纯NT增厚胎儿的健康新生儿活产率明显高于NT增厚合并其它超声异常胎儿(80% vs 20%,P<0.05);单纯NT增厚胎儿的染色体异常率低于NT增厚合并其它超声异常胎儿(14.3% vs 60%,P<0.05),提示是否合并其他超声异常与健康新生儿活产率、染色体异常率均存在相关性。Iuculano等对NT增厚胎儿的预后随访发现,在排除染色体异常、超声结构异常以及出生后儿科评估异常之后,出现神经发育迟缓的概率与正常人群概率相当[16]。因此,早孕期发现NT增厚时,应尽早行超声排除胎儿结构异常,并行侵入性产前诊断(核型分析+CMA)排除胎儿染色体异常。若两者均为阴性,大部分胎儿的预后良好。而对于一些在孕早期有超声影像学表现的胎儿结构异常,提早诊断可为后续的侵入性产前诊断争取时间,并为后续的WES序提供参考。
综上所述,NT增厚与染色体异常以及结构异常相关。单纯NT增厚胎儿排除遗传物质异常后,大部分预后良好(80%)。NT增厚合并其它超声异常胎儿的染色体异常率明显升高,而健康新生儿活产率明显下降。对于合并结构异常的胎儿,可建议继续行WES检测以明确遗传学病因。
