NEC-1 在大鼠脑出血后继发性脑损伤中的作用研究
2022-03-23金许洪吕庆平张子彬庞晓俊
尹 剑 金许洪 吕庆平 张子彬 庞晓俊
自发性脑出血(intracerebral hemorrhage,ICH)是我国最常见的破坏性脑血管疾病,具有很高的死亡率和致残率。ICH 引起的脑水肿、神经炎症、铁超载、血脑屏障破坏、细胞凋亡、自噬等病理生理机制复杂,治疗措施有限,疗效不佳[1-2]。近年研究发现,坏死性凋亡受体抑制剂1(necrostain 1,NEC-1)与脑水肿关系密切,在脑挫伤研究中能减轻神经损伤程度[3]。但NEC-1 与ICH 后脑组织交互受体蛋白1/3(receptorinteracting protein 1/3,RIP1/RIP3)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1β(interleukin-1β,IL-1β)因子表达之间的关系尚未明确。本实验制作大鼠脑出血模型,探讨NEC-1 在ICH 后继发性脑损伤中的作用及具体机制。
1 资料与方法
1.1实验动物 选择SPF 级SD 大鼠54 只,体质量250~300g,来源于浙江中医药大学动物实验室。所有大鼠饲养在屏障环境内,温度20~26℃,湿度(50%~70%),光照(每12h 明暗交替),换风(15~20 次/h)。动物生产许可证号:SCXK(沪)2013-2016,动物饲养许可证号:SYXK(浙)2013-0184,本实验经浙江中医药大学动物管理与伦理委员会审核通过。
1.2主要试剂及仪器 磷酸盐缓冲液(pH7.2~7.4,美国Hyclone,SH30256.01,AD22391274),BCA 试剂盒(Solarbio,pc0020,20180328),DAPI(中国碧云天,ZH3201、H762531),ECL 显影液(Solarbio,PE0010,20181220),RIPA 裂解液(Beyotime,P0013D,10352),PVDF 膜(瑞典GE,106000023,A16954279),Trizol(Sangon Biotech,B548124-0500,E108KA7471),Anti-Rat TNF-α(美国PeproTech,500P72,AD3653623),二抗(美国Abcam,ab150076,GR2356152),NEC-1(美国Abcam,411880,ab141053),Anti-Rat RIP1(美国Cell Signaling,E7G60,53286),Anti-Rat RIP3[(美国Abcam,EPR9516(N)-25,ab240336)],Anti-Rat IL-1β(美国Abcam,RM1009,ab283818)。电泳仪(天能,EPS300),电泳槽(天能,VE180C),转膜仪(天能,VE186),立体定向仪(美国Stoelting,51600)。
1.3分组及造模 应用随机数字表法将大鼠分为三组:假手术组(sham operation group,sham 组),ICH+生理盐水组(ICH+normal saline group,ICH+NS 组),脑出血+NEC-1 组(ICH+NEC-1 group,ICH+NEC-1组),每组18 只。在无菌条件下,大鼠以3.6%水合氯醛(4g/kg)腹腔麻醉。头部去毛,俯卧固定大鼠于动物头颅立体定位仪,调节立体定位仪,将门齿固定,使前后囟在一条线上,头皮丁字切开,在人字缝前方2mm、中线旁开2.5mm 处,骨钻钻开颅骨约1mm 小孔,不伤及硬脑膜及脑组织。用40℃温水加热消毒尾静脉,待充血充分后消毒,使用微量注射器抽取不抗凝动脉血50μL 固定在定位以上,将微量注射器通过孔洞进针至6mm 尾状核部,停留时间约5min 后缓慢退出注射器,完善止血后用骨蜡封闭骨窗。缝合皮肤后回笼饲养。Sham 组仅切开头皮,开骨窗,不造成脑出血。模型制作成功的评分判断:待大鼠清醒后按照Bederson 评分法[4]分为3 级,Ⅰ级:将大鼠尾巴提起,瘫痪侧前肢回收后屈曲于腹下,正常侧前肢向地面伸展。Ⅱ级:除Ⅰ级体征外,向瘫痪侧推大鼠时阻力较对侧明显降低。Ⅲ级:除以上体征外,大鼠有向瘫痪侧侧旋的行为。ICH+NS 组以及ICH+NEC-1 组选择苏醒后出现上述症状和体征的大鼠,而且造模后各时间段均出现相似的神经功能缺损症状和体征的大鼠为脑出血模型成功者,进行后续实验,否则弃之不用。Sham 组大鼠不出现神经功能缺损,活动正常。如有造模不成功或死亡,则随机补充。
1.4侧脑室给药干预方法 大鼠于制作模型成功为起点,Sham 组不给药;ICH+NS 组经侧脑室干预注射NS 1μL,ICH+NEC-1 组经侧脑室干预注射NEC-1溶剂(80μmol/mL)1μL。
1.5大脑组织含水量(brain water content,BWC)测定 分别随机取Sham 组、ICH+NS 组、ICH+NEC-1组大鼠各6 只,在干预给药后24h 进行大鼠深麻醉后断颈处死,并迅速取出脑组织,分别用电子分析天平称量各只大鼠脑组织湿重,再置入105℃烤箱72h后取出,分别测量大脑组织干重。按照Elliot 公式[5]计算脑组织含水量=(湿重-干重)/湿重×100%。
1.6细胞凋亡的形态学检测方法(TUNEL)测定 给药后24h,分别随机取Sham 组、ICH+NS 组、ICH+NEC-1 组大鼠各6 只,应用TUNEL 法检测脑组织神经细胞凋亡情况。具体方法:各取切片,水浴锅加热抗原修复,投膜,加入抗体,PBS 清洗,DAPI 核染色,封片。采用灰度值(OD)测量,显微镜下观察并计算神经细胞凋亡指数。
1.7蛋白质免疫印迹法(Western blot)测定 给药后24h,分别随机取Sham 组、ICH+NS 组、ICH+NEC-1 组大鼠各6 只,大鼠提取脑组织,采用Western blot法检测脑组织中RIP1/RIP3、TNF-α、IL-1β 蛋白水平的表达情况。具体方法:各取适量脑组织加裂解液,匀浆后离心,取上清液,提取蛋白,用BAC 法测定蛋白浓度:放入100℃水浴锅内煮5min,配置10%SDA-PAG 凝胶,每孔加入适量蛋白和Loading Buffer 混合液,电泳分离,然后将目标蛋白和GAPDH胶转膜至PVDF 膜上,封闭1h,加入RIP1/RIP3、TNF-α、IL-1β 抗体稀释液,4℃过夜,再加入二抗,温室孵育1h,洗膜,用ECL 发光液显影。通过应用软件测OD,以目的蛋白和GAPDH 比值作为相对表达量进行结果分析。
1.8统计学方法 应用统计软件SPSS 20.0 进行数据分析,实验数据采用正态分布检验,符合正态分布的计量资料以均数±标准差()表示,采用完全随机设计单因素方差分析(one-way ANVOVA),以P<0.05 为差异有统计学意义。
2 结果
2.1NEC-1 对ICH 大鼠脑水肿的影响 与Sham 组比较,ICH+NS 组和ICH+NEC-1 组大鼠脑组织含水量显著升高(P<0.05)。与ICH+NS 组比较,ICH+NEC-1 组大鼠脑组织含水量减轻(P<0.05)。见表1。
2.2NEC-1 对ICH 大鼠脑组织神经细胞凋亡指数的影响 与Sham 组比较,ICH+NS 组和ICH+NEC-1组凋亡指数均明显升高(P<0.05)。与ICH+NS 组比较,ICH+NEC-1 组神经细胞凋亡指数显著减少(P<0.05)。见表1。
表1 NEC-1 对ICH 大鼠脑组织水肿及神经细胞凋亡指数的影响()

表1 NEC-1 对ICH 大鼠脑组织水肿及神经细胞凋亡指数的影响()
注:Sham 组为假手术组;ICH+NS 组为模型组,经侧脑室干预注射NS;ICH+NEC-1 组为模型干预组,经侧脑室干预注射NEC-1 溶剂;ICH 为自发性脑出血;NS 为生理盐水;NEC-1 为坏死性凋亡因子-1;与Sham 组比较,aP<0.05;与ICH+NS 组比较,bP<0.05
2.3NEC-1 对ICH 大鼠脑组织RIP1/RIP3、TNF-α、IL-1β 蛋白表达的影响 与Sham 组比较,ICH+NS组和ICH+NEC-1 组RIP1/RIP3、TNF-α、IL-1β 蛋白表达均明显升高(P<0.05)。与ICH+NS 组比较,ICH+NEC-1 组RIP1/RIP3、TNF-α、IL-1β 蛋白表达显著减少(P<0.05)。见图1、表2。
表2 NEC-1 对ICH 大鼠脑组织RIP1/RIP3、TNF-α、IL-1β蛋白表达的影响()
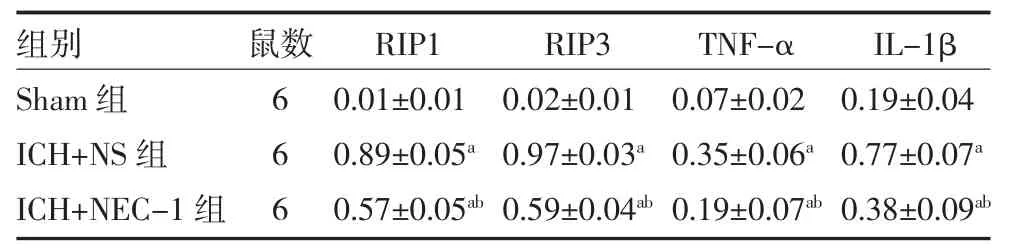
表2 NEC-1 对ICH 大鼠脑组织RIP1/RIP3、TNF-α、IL-1β蛋白表达的影响()
注:Sham 组为假手术组;ICH+NS 组为模型组,经侧脑室干预注射NS;ICH+NEC-1 组为模型干预组,经侧脑室干预注射NEC-1 溶剂;ICH 为自发性脑出血;NS 为生理盐水;NEC-1 为坏死性凋亡因子-1;与Sham 组比较,aP<0.05;与ICH+NS 组比较,bP<0.05;RIP1 为交互受体蛋白1;RIP3 为交互受体蛋白3;TNF-α 为肿瘤坏死因子-α;IL-1β为白介素-1β
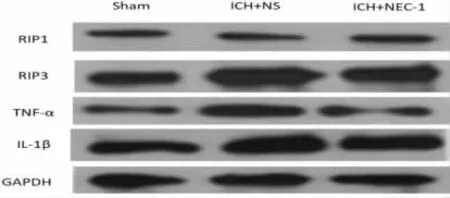
图1 NEC-1 对ICH 大鼠脑组织RIP1/RIP3、TNF-α、IL-1β蛋白表达的影响
3 讨论
ICH 是常见的神经外科危急重症,ICH 后继发性脑损伤可诱发脑疝,危及患者生命。因此,如何有效控制继发性脑损伤是改善ICH 患者预后的关键。目前,除了开颅清血肿、去骨瓣减压手术等治疗外,临床上主要采用药物治疗,但疗效不佳[6-7]。
交互受体蛋白家族(receptor-interacting proteinfamily,RIPs)是一类具有特异的丝氨酸/苏氨酸激酶活性的蛋白,在免疫、炎症反应、细胞死亡等信号传导中发挥着重要作用。在RIPs 中,RIP1 和RIP3 在细胞坏死性凋亡通路中起到非常重要的作用。其中,RIP1 决定细胞生存或死亡,RIP3 是诱导细胞凋亡与坏死相互转换的关键分子。RIP3 与RIP1 通过共有的同型互动域结构相互作用,使RIP1 磷酸化,形成Necrosis 诱导复合物[8-9]。通过RIP1/RIP3 复合体启动下游的坏死性凋亡和炎性反应,复合体启动因子TNF-α 及促神经炎症因子IL-1β 的表达也明显升高[10]。NEC-1 是RIP1 介导的NEC 特异抑制物,可抑制RIP3 表达,具有保护中枢神经细胞的作用,能减轻心脑血管缺血缺氧和缺血-再灌注的损伤程度[11-12]。前期研究发现,通过NEC-1 抑制RIP3 与RIP1 启动的坏死性凋亡能明显改善神经功能症状[3]。本实验通过建立大鼠脑出血模型,经侧脑室给药NEC-1 干预后,脑组织中RIP1/RIP3、TNF-α 及IL-1β 表达明显下调,明显改善损伤皮质区神经元和星形胶质细胞状态,减轻脑水肿,减少神经细胞凋亡,进一步发挥重要的神经保护作用。
综上所述,NEC-1 通过抑制以RIP1/RIP3 为关键元件的下游因子,抑制TNF-α 及IL-1β 的表达,进一步减少神经细胞凋亡,具有显著的保护作用,为脑出血后继发性脑损伤的治疗提供了新的思路。
