miR-19a 在鼻咽癌细胞上皮间质转化中的作用
2022-03-23孙海力林文巧李绍霄陈恩就
孙海力 林文巧 李绍霄 陈恩就
上皮间质转化(epithelial-mesenchymal transition,EMT)是恶性肿瘤转移发生的重要因素,随着EMT 进展,肿瘤细胞迁移和侵袭能力进一步增强,最终实现癌细胞转移[1]。microRNAs(miRNAs)作为一类短链非编码RNA,通过与靶向信使RNA 的3'非翻译区(3'-UTR)的专一性结合,影响靶基因表达[2]。研究表明,miRNAs 参与调控各种对细胞正常发育至关重要的生物过程[3],某些miRNAs 已被证明可以抑制或促进EMT[4]。例如miR-130a-3p 可通过靶向调控H19 抑制体外胶质瘤细胞EMT[5];而miR-101-3p 可通过调控宫颈癌细胞迁移和侵袭,抑制EMT 过程和细胞远处转移[6]。然而,miR-19a 在鼻咽癌EMT 发生过程中的作用仍有待进一步证实。本研究探讨miR-19a 在鼻咽癌细胞EMT 过程中的作用,为揭示鼻咽癌细胞转移的分子生物学机制提供参考证据。
1 实验材料
1.1细胞 鼻咽癌细胞株CNE2、SUNE-1、HNE1、58F 及人正常鼻咽上皮细胞株NP69 购自中科院细胞库。
1.2试剂和仪器 1640 培养基购于上海微科生物技术有限公司(批号P875-N10);胎牛血清购于上海素尔生物科技有限公司(批号XC45632);LipofectamineTM2000 购自美国Invitrogen 公司(批号L3287);miR-19a 及内参U6 的引物和探针由广州伯信生物公司设计;Trizol 购自美国Invitrogen 公司(批号12183555);Takara One Step PrimeScript microRNA cDNA Synthesis Kit 和SYBR Premix Ex TaqTMⅡ购自日本Takara 公司(批号D350A、DRR041A);ECMatrix 胶和Transwell 小室购自美国Corning 公司(批号356234、3422);BCA 蛋白测定试剂盒和超敏ECL 化学发光试剂盒购自南京凯基公司(批号EW-48-63、EW-6613);荧光素酶报告基因检测试剂盒购自美国abcam 公司(批号ab228530);抗E-cadherin、N-cadherin 和KRAS 抗体购自美国abcam 公司(批号 ab40772、ab76011、ab191595);FAK、SRC 和 β -actin 抗体购自美国Santa Cruz 公司(批号sc-271126、sc-166860、sc-8432);倒置显微镜购自日本奥林巴斯公司(型号:IX71);实时荧光定量PCR 仪购自美国伯乐公司(型号:9600);凝胶成像仪购自北京广开源商贸有限公司(型号:IAS-500)。
2 实验方法
2.1细胞培养 运用1640 培养液对细胞进行培育,同时在1640 培养液中添加10%胎牛血清,细胞放置细胞培养箱环境中,使用含EDTA 胰蛋白酶消化,按照1∶3 的比例进行传代。
2.2细胞转染及分组 鼻咽癌细胞加入96 孔板中,每孔中分配2×104个细胞,完全遵循LipofectamineTM2000 试剂盒说明书进行下一步操作。实验分为四组:mimics NC 组:每孔SUNE-1 细胞加入100nmol 的mimics NC 及5μL 转染试剂;miR-19a mimics 组:每孔SUNE-1 细胞加入100nmol 的miR-19a mimics及5μL 转染试剂;inhibitor NC 组:每孔HNE1 细胞加入100nmol 的inhibitor NC 及5μL 转染试剂;miR-19a inhibitor 组:每孔HNE1 细胞加入100nmol的miR-19a inhibitor 及5μL 转染试剂,转染后48h收集细胞进行实行荧光定量PCR(quantitative realtime PCR,RT-qPCR)检测,确定转染效率后再进行细胞体外实验。
2.3RT-qPCR 检测miR-19a 表达 用Trizol 试剂提取总RNA 并按照说明操作,RNA 浓度由超微量分光光度计检测,逆转录和荧光定量PCR 过程完全遵循试剂盒说明书进行,设置U6 作为内参,通过2-△△Ct法分析miR-19a 在鼻咽癌细胞中的含量,实验重复3 次,取平均值。
2.4细胞体外侵袭实验 每个Transwell 上室铺有一层ECMatrix 胶模拟体内环境,收集鼻咽癌SUNE-1 和HNE1 细胞悬液,经冰PBS 缓冲液洗涤3 次,并将细胞悬液的密度调节至2×105/mL,将20μL 细胞悬液加至Transwell 上室,再将500μL 的DMEM 完全培养基加入Transwell 下室,Transwell 小室置于37℃中孵育过夜后加入1~2 滴结晶紫试剂,反应15min后在光学显微镜下观察转移至Transwell 小室背侧的细胞,在200 倍放大视野下随机计数5 个视野下的蓝染细胞,实验重复3 次,取平均值。
2.5荧光素酶报告基因检测 将重组荧光素酶报告载体mut-psiCHECK-KRAS-3'-UTR 或wt-psi-CHECK-KRAS-3'-UTR 共转染至SUNE-1 细胞中,再分别将miR-19a mimics 或mimics NC 转染至SUNE-1 细胞中,转染48h 后收获细胞,样品荧光素酶活性检测过程完全遵循荧光素酶报告基因检测试剂盒说明书进行,每组样本设5 个复孔。
2.6蛋白质印迹法 鼻咽癌细胞在细胞裂解液的作用下提取蛋白,总蛋白经匀浆、离心和变性等操作后,使用凝胶电泳分离后转移至硝酸纤维素膜上,通过脱脂奶粉进行封闭操作,整体实验环境为4℃,维持12h,硝酸纤维素膜通过Ⅰ抗、Ⅱ抗反应后,添加一定的化学发光液,完成显色、曝光等处理。
2.7细胞免疫荧光检测 收集胰蛋白酶消化后的SUNE-1 细胞以制备单细胞悬浮液,将消化好的细胞悬液密度调至3×104/mL,将0.5mL 细胞液滴加到24孔板中的多聚赖氨酸处理的细胞爬片上,药物初步处理后放在37℃环境中12h,细胞经PBS 清洗和甲醛固定后加入KRAS 一抗在4℃温度下孵育12h,经PBS 冲洗残余一抗后加入荧光二抗在室温下孵育1h,再次经PBS 冲洗3 次后加入Hoechst33342 染色液在室温下孵育5min,在荧光显微镜下观察并拍摄照片。
2.8统计学方法 应用SPSS 16.0 软件进行统计分析并绘制统计图。在本实验中获得的所有测量数据均符合正态分布,以均数±标准差()表示,采用SNKq 检验分析两个样品之间的差异,设立P<0.05 为差异有统计学意义。
3 实验结果
3.1miR-19a 在鼻咽癌细胞系和正常鼻咽上皮细胞中的表达 NP69 细胞miR-19a 表达水平分别是CNE2、SUNE-1、HNE1 和58F 细胞的5.88、3.57、11.11 和6.67 倍,差异有统计学意义(P 均<0.01)。miR-19a 在高转移细胞株HNE1 和低转移细胞株SUNE-1 中的表达分别为最低和最高,两者比较差异有统计学意义(P<0.01),选择这两种细胞株作为后续实验所用材料。
3.2转染miR-19a mimics 和miR-19a inhibitor 对鼻咽癌细胞体外侵袭的影响 将miR-19a mimics转染至鼻咽癌SUNE-1 细胞,同时将miR-19a inhibitor 转染至鼻咽癌HNE1 细胞,RT-qPCR 结果表明,miR-19a mimics 组SUNE-1 细胞中的miR-19a表达水平明显高于mimics NC 组(P<0.01),而miR-19a inhibitor 组HNE1 细胞中的miR-19a 表达水平较inhibitor NC 组明显减少(P<0.01),见表1。
表1 各组miR-19a 表达水平比较(差异倍数,)

表1 各组miR-19a 表达水平比较(差异倍数,)
注:mimics NC 组为每孔SUNE-1 细胞加入100nmol 的mimics NC 及5μL 转染试剂;miR-19a mimics 组为每孔SUNE-1 细胞加入100nmol的miR-19a mimics 及5μL 转染试剂;inhibitor NC 组为每孔HNE1细胞加入100nmol 的inhibitor NC 及5μL 转染试剂;miR-19a inhibitor组为每孔HNE1 细胞加入100nmol 的miR-19a inhibitor 及5μL 转染试剂;与mimics NC 组相比,aP<0.01;与inhibitor NC 组相比,bP<0.01
肿瘤细胞体外侵袭实验结果显示,转染miR-19a mimics 后可明显减少侵袭出Matrigel 基质胶的SUNE-1 细胞数量(见图1),mimic NC 组和miR-19a mimics 组侵袭细胞数分别为(25.6±4.4)和(10.5±2.1),两组比较,差异有统计学意义(P<0.01)。转染miR-19a inhibitor 后可显著促进HNE1 细胞侵袭行为,inhibitor NC 组和miR-19a inhibitor 组侵袭细胞数分别为(16.9±2.5)和(34.2±4.9),两组比较,差异有统计学意义(P<0.01)。
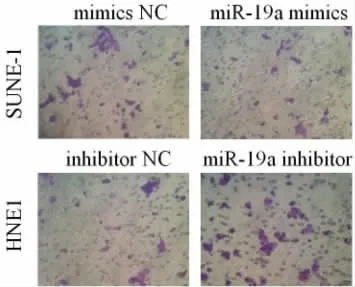
图1 Transwell 小室实验测定体外鼻咽癌细胞侵袭
3.3验证miR-19a 的直接靶基因KRAS 为进一步研究miR-19a 在鼻咽癌细胞EMT 中的可能作用机制,通过检索miRBase 数据库获得has-miR-19a 序列,并通过生物信息学工具TargetScan 对miR-19a可能存在的靶基因进行分析。如图2A 所示,发现KRAS 与has-miR-19a 存在潜在的结合位点,为此,我们进一步应用荧光素酶报告检测系统验证体外SUNE-1 细胞miR-19a 对KRAS 的调控作用。
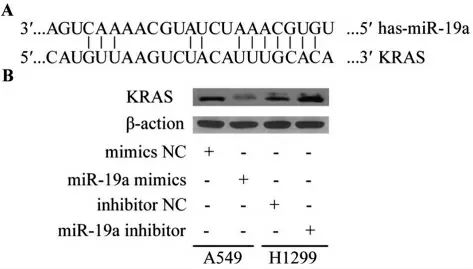
图2 生物信息学工具预测KRAS 与has-miR-19a 潜在的结合位点(A),Western blot 检测KRAS 蛋白的表达(B)
荧光素酶报告检测结果如表2 所示,与共转染wt-psiCHECK-KRAS-3'-UTR 和inhibitor NC 后细胞荧光素酶活性相比较,在SUNE-1 细胞中共转染wt-psiCHECK-KRAS-3'-UTR 和miR-19a inhibitor后的荧光素酶活性明显升高,差异有统计学意义(P<0.01);而共转染mut-psiCHECK-KRAS-3'-UTR 和miR-19a inhibitor 后细胞荧光素酶活性值与共转染mut-psiCHECK-KRAS-3'-UTR 和inhibitor NC 后的细胞荧光素酶活性相比较,差异无统计学意义(P>0.05)。用miR-19a mimics 和miR-19a inhibitor 分别转染SUNE-1 和HNE1 细胞后,应用Western blot 分析鼻咽癌SUNE-1 和HNE1 细胞中KRAS 蛋白的表达,结果表明(见图2B),miR-19a mimics 组KRAS表达较mimics NC 组明显减少(P<0.01),而miR-19a inhibitor 组中的KRAS 表达水平显著高于inhibitor NC 组(P<0.01)。以上结果提示,miR-19a 可与KRAS 的3'-UTR 结合,KRAS 是miR-19a 的直接靶向基因。
表2 各组荧光素酶活性比较(差异倍数,)

表2 各组荧光素酶活性比较(差异倍数,)
注:与wt-psiCHECK-KRAS-3'-UTR+inhibitor NC 组比较,aP<0.01
3.4过表达KRAS 可挽救miR-19a 对鼻咽癌细胞EMT 过程的抑制作用 为证实miR-19a 对鼻咽癌细胞EMT 过程的抑制作用是否通过直接作用于其靶基因KRAS 而实现,将SUNE-1 细胞分为mimics NC 组、miR-19a mimics 组 和miR-19a mimics+KRAS mimics 组,细胞体外侵袭实验结果如图3A 所示,mimics NC 组、miR-19a mimics 组 和miR-19a mimics+KRAS mimics 组侵袭细胞数分别为(28.3±3.4)、(11.6±1.5)和(23.7±2.8),mimics NC 组和miR-19a mimics 组相比较,差异有统计学意义(P<0.01)。miR-19a mimics 组和miR-19a mimics+KRAS mimics 组相比较,差异有统计学意义(P<0.01)。
Western blot 结果如图3B 所示,与mimics NC组比较,miR-19a mimics 组鼻咽癌细胞N-cadherin、p-FAK 和p-SRC 均表达下调,而E-cadherin 表达上调。另外,SUNE-1 细胞经转染KRAS mimics 后,miR-19a mimics 对E-cadherin、N-cadherin、p-FAK和p-SRC 蛋白表达的调控作用明显被削弱。表明miR-19a 对鼻咽癌细胞EMT 过程的抑制作用可能通过直接作用于其靶基因KRAS 来实现。
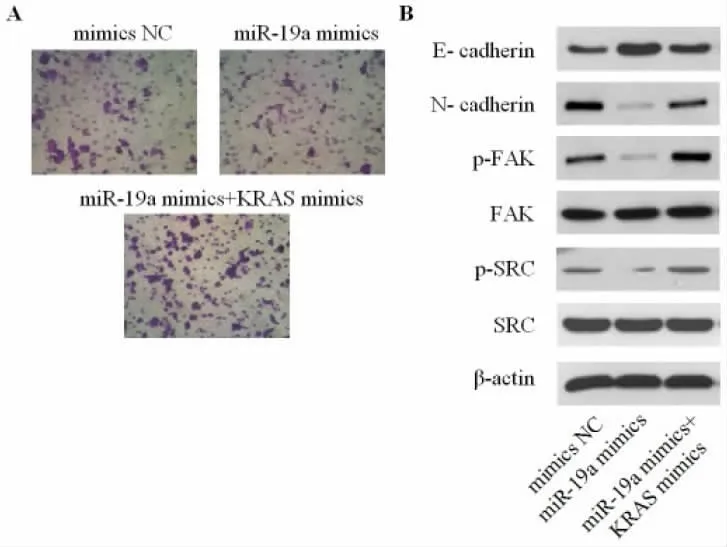
图3 Transwell 小室实验检测细胞侵袭(A),Western blot 测定E-cadherin、N-cadherin、KRAS、p-FAK 和p-SRC 的表达(B)
4 讨论
EMT 作为一种自然发生的上皮细胞表现出间质细胞特征的过程,是胚胎分化成熟的基础。癌细胞在自身分子改变或肿瘤微环境的刺激下发生EMT,得以侵入基底膜并从原发肿瘤脱落,进而发生远处转移[1]。miRNAs 与EMT 过程联系紧密,miR-125b 通过靶向调控生长因子2 和生长因子4 的表达,同时负性调控EMT 过程,从而削弱肝癌细胞的转移性和耐药性[7];上调miR-125b 的表达可逆转恶性肿瘤细胞EMT,抑制肿瘤干细胞的生成[8-9];SOX17/miR-371-5p/SOX2 轴可以抑制结直肠癌细胞EMT、干细胞特性和转移倾向[10]。但miR-19a 与鼻咽癌转移是否相关尚未见报道,本研究发现,miR-19a 通过直接靶向调控KRAS 的表达,从而有效抑制体外鼻咽癌细胞EMT 行为。
研究发现,miR-19a 在包括鼻咽癌在内的多种恶性肿瘤细胞中的表达下调,并且可作为重要的独立预后标志物[11-12]。因此,我们假设miR-19a 能够抑制鼻咽癌细胞的EMT 和转移。RT-qPCR 分析发现,正常鼻咽上皮细胞系中miR-19a 的表达远高于多种鼻咽癌细胞系;此外,miR-19a 在高转移细胞株SUNE-1 中表达相对较低,在低转移细胞株HNE1 中表达相对较高。以上结果表明,miR-19a 可能作为一种EMT 抑制剂。同时,沉默miR-19a 的表达增强了鼻咽癌细胞的侵袭性,而上调miR-19a 的表达可逆转EMT 的发生。
KRAS 是EMT 相关事件的关键调节因子,下调KRAS 的表达能促进包括卵巢癌和鼻咽癌在内的多种实体瘤EMT 的发生[13-15]。然而,迄今为止,miR-19a与KRAS 之间的相互作用尚未研究,在我们的研究中,miR-19a 表达上调可以下调KRAS 在鼻咽癌细胞中的表达;此外,双荧光素酶报告基因检测进一步表明miR-19a 直接靶向KRAS 的3'-UTR 从而调控KRAS 的表达;最后我们通过挽救实验证实,过表达KRAS 可逆转miR-19a 对鼻咽癌细胞EMT 过程的抑制作用。上述结果说明,miR-19a 通过抑制其靶基因KRAS 翻译水平的表达,在抑制鼻咽癌细胞EMT过程中发挥了重要作用。
FAK 是一种胞质非酪氨酸激酶受体,具有蛋白间交联受体的功能[16]。研究表明,FAK 在多种侵袭性和转移性肿瘤中表达上调[17];鼻咽癌组织中FAK 活性与鼻咽癌细胞浸润表型有关,FAK 表达上调与转移性鼻咽癌中侵袭性表型关系密切[18]。FAK 的下游信号因子如SRC 和PI3K 等可诱导细胞转移,由于FAK/SRC 通路激酶对细胞极性、黏附性、运动性和EMT 的潜在影响,被认为是实体肿瘤有效的治疗靶点[19-20]。本研究显示,上调miR-19a 可抑制SUNE-1细胞中磷酸化FAK/SRC 水平和EMT 过程,从而表明FAK/SRC 通路的磷酸化水平可能在miR-19a 发挥抗癌作用中起到一定作用。
综上所述,本研究结合之前的研究报道表明,miR-19a 可能通过靶向KRAS 以及负性调控FAK/SRC 通路从而抑制鼻咽癌细胞EMT 过程,这种过表达miR-19a 的方式可为未来转移性鼻咽癌治疗提供一种特殊策略。
