甘露醇对创伤性脑水肿及AQP4表达影响的研究进展
2022-03-23林治华
艾 莉,鲁 宏,林治华
(1.重庆市第七人民医院, 重庆 400054; 2.重庆理工大学 药学与生物工程学院, 重庆 400054)
我国每年有超过200万的脑创伤患者[1]。创伤性脑水肿是脑创伤后的严重并发症,它常常是导致患者致残甚至死亡的主要原因[2-3]。及时、有效干预脑水肿的发生与进程,对脑创伤患者的预后具有重大意义[4]。水通道蛋白-4(aquaporin 4,AQP4)是1种调节水代谢的膜蛋白,在脑水肿的发生机制中至关重要。目前为止,除了外科手术外,内科常用甘露醇高渗脱水剂治疗,具有一定疗效,但也产生一些不良反应。现就甘露醇对创伤性脑水肿及AQP4表达影响进行综述。
1 脑水肿
脑水肿是多种诱因导致脑内液体产生过多、异常聚积在细胞内或细胞外间隙的病理过程[5],属于继发性病理过程。它的发生与多种因素有关,例如:血脑屏障破坏、细胞代谢功能障碍等,颅内占位性病变、脑外伤、炎症及其他多种全身系统性疾病均可引起脑水肿。AQP4、基质金属蛋白酶、紧密连接蛋白等参与脑水肿的形成。在脑创伤中,血管源性脑水肿和细胞毒性脑水肿尤为重要,两者共存并此消彼涨。当血脑屏障(BBB)遭到破坏时,毛细血管内的血浆蛋白及水分大量渗出至血管外周及细胞间质内,形成血管源性脑水肿。细胞毒性脑水肿多为细胞内外环境发生改变,继而发生细胞代谢异常、细胞膜功能障碍等一系列病理生理变化,最终导致细胞内外的Na+、K+及Ca2+交换发生障碍。创伤性脑水肿是脑组织在外力的作用下导致细胞内或细胞外间隙内水份增多。文献[6]报道,重型颅脑损伤所致的脑水肿,创伤早期以血管源性脑水肿为主,后期则以细胞毒性脑水肿为主。
2 AQP4
2.1 AQP4的结构与分子亚型
AQP4由Agre于1994年于大鼠肺脏中克隆分离出,是1种具有高度选择性的水双向转运的跨膜通道,维持着大脑水平衡,并稳定其内环境[7]。AQP4基因位于人类染色体18q11.2与q12.1之间的衔接处,包含4个外显子和3个内含子,其中127、55、27及92位氨基酸序列分别由4个外显子编码。AQP4的蛋白单体均由8个跨膜α右手螺旋和2个不完全跨膜的螺旋构成,分子量约30 kDa。如图1所示,AQP4单体包含5个环,亲水性A、C、E环位于细胞外,但其氨基端和羧基端均位于细胞内,C端有5个氨基酸且对AQP4能固定在细胞膜上非常关键,起连接作用。疏水性B、D环则在细胞内,均具有天冬酰氨-脯氨酸-丙氨酸基序(NPA)如图2所示,此为AQPs家族的特征序列,在水转运功能上起到了决定性作用,研究发现B、E环结构的改变会引起水通道的通透性发生改变。2个NPA 结构相对折叠形成一直径约0.38 nm的孔道,仅能通过1个水分子,此结构即为水通道蛋白“沙漏模型”三级结构。在功能层面上,每个亚单位均可成为一个单独的水通道[7]。
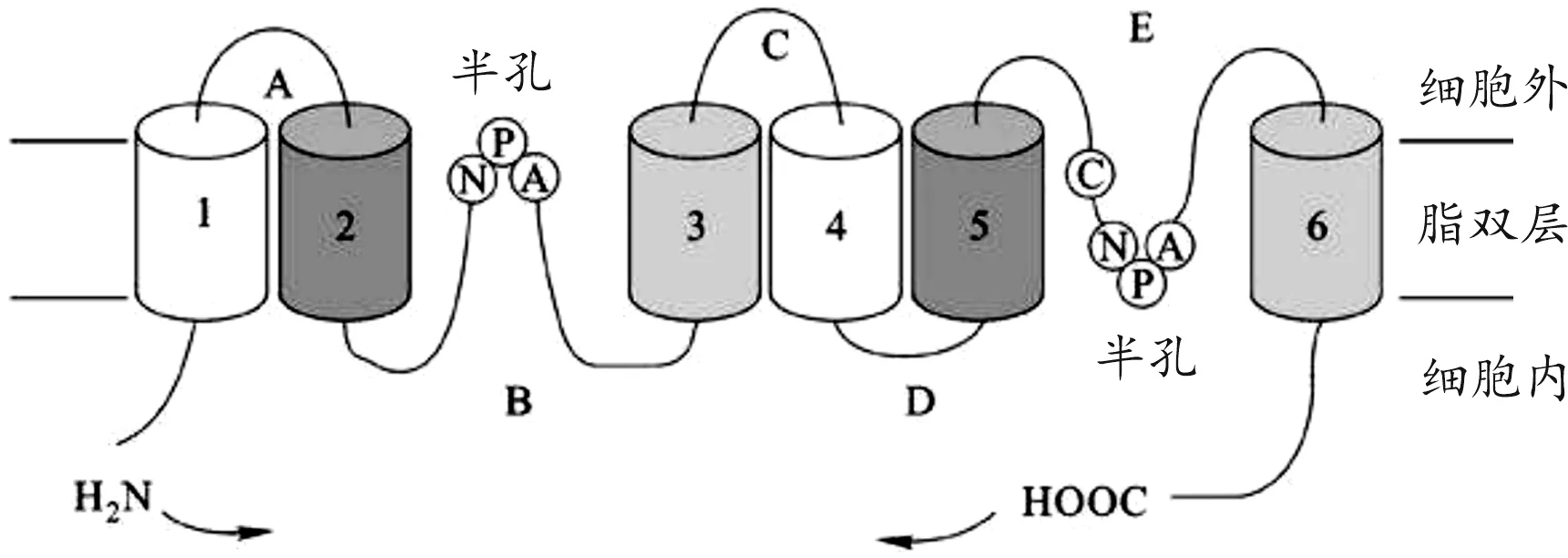
图1 AQP4单体结构图
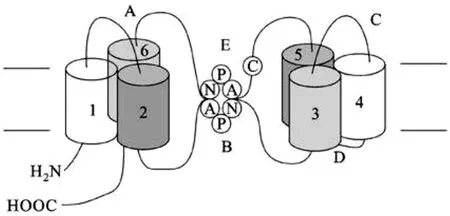
图2 NPA结构图
AQP4的功能亚型有M1、M23和MZ 3种。M1含有323个氨基酸残基,它的水通透性最高;M23含有301个氨基酸残基,是脑组织中最常见的一种亚型,其含量亦最丰富,且可形成正交列阵结构(orthogonal arrays of particles,OAPs),它们是质膜中类似晶体的超分子组件,OAP可能由共同表达的M1-M23 AQP4杂四聚体组成[9]。OAP为AQP4的特有结构,不仅能使水分子通透性增强,促进AQP4在星形胶质细胞的极化,还可辅助AQP4定位于细胞膜上[10]。Alikina等[11]研究结果显示,M1 mRNA编码AQP4-M1,M23 mRNA及M23 X mRNA共同编码AQP4-M23。正常情况下,AQP4-M1与AQP4-M23的比例相对稳定,但在某些因素的作用下此比例将发生改变,从而使质膜的通透性随之改变[12]。Mubariz F等[13]研究表明,虽然M1和M23的通透性相似,但两者的表达水平不同,前者要低于后者。因此,M23亚型的单位水渗透率低于M1亚型。
2.2 AQP4的分布与功能
AQP4在颅脑内主要位于支持细胞中,介导自由水跨膜转运,参与脑脊液形成与重吸收。正常情况下,AQP4在血脑屏障的血管基底膜、星形胶质细胞足突(P)上的表达水平与其在细胞膜(M)上的表达水平的标准比(P/M)为12∶3,呈极性分布态势[15]。脑创伤时,AQP4的极性分布反转,在损伤区星形胶质细胞上的表达水平显著升高,脑水肿的类型及轻重程度随之发生变化,证明这种极性分布与其在脑内水平衡中发挥重要作用有关[14-16]。AQP4还可存在于海马体、胼胝体、下丘脑等组织中,尤其是在下丘脑视上核和室旁核,AQP4高度表达,渗透压变化1%便可引起抗利尿激素释放,推测AQP4可能作为渗透压感受器或受体,参与全身的水平衡[17]。AQP4被证实是一种黏附分子,对细胞的迁移和神经兴奋、突触可塑性等生理功能起作用[18]。除此之外,研究证实AQP4还参与代谢物的排除、钙离子信号传导、免疫调节、谷氨酸盐稳态和铁传递等,如表1所示。

表1 AQP4在脑内的主要分布与功能
3 甘露醇
甘露醇属于糖醇类的单糖大分子物质,提制于褐藻细胞。甘露醇不能被人体代谢,且肾小管对其重吸收极少,因此大量以原形的形式通过肾脏排出体外。甘露醇通过升高血管内的渗透压,促使水分从组织内进入血管,起到脱水降压的作用。甘露醇还可经增加血容量、提升脑组织供氧的途径,降低颅内压。除此之外,推测甘露醇可能对脑脊液的分泌和再吸收有影响。甘露醇有良好的利尿、降颅压、减轻脑水肿作用,兼之拥有起效快,价格便宜等优点,在临床中广泛用于降颅压,防止脑疝形成[19-20],临床较常用20%的甘露醇。甘露醇的副作用也较多,水和电解质紊乱是最常见的不良反应之一,这是因为短时间内快速静滴大量甘露醇,致使体内甘露醇的量迅速增加,血容量随之迅捷扩充,诱发心力衰竭、低钠血症等多种严重并发症。一般情况下,甘露醇进入体内后,可不经BBB而快速进入细胞外液,但当血液中甘露醇含量较高或酸中毒或BBB受损时,甘露醇则可透过BBB导致颅内压升高的“反跳”现象。甘露醇还可导致肾功能损害,这是其较严重的不良反应。有17.3%~34.3%的患者(年龄<60岁)使用甘露醇后出现肾损害,老年人及有并发症的人群出现肾损害的比例更高[21-23]。
4 AQP4、创伤性脑水肿及甘露醇之间的关系
4.1 AQP4与创伤性脑水肿
创伤性脑水肿的类型可随脑创伤后时间的推移而出现多种水肿类型的混合,常常为血管源性脑水肿与细胞毒性脑水肿并存[6]。AQP4与脑水肿形成和消退密切相关,AQP4的调节失衡是创伤后脑水肿形成与发展的主要因素。AQP4在创伤性脑水肿的不同时期、不同类型中有着不同的作用[24],具有双重性。多数研究表明,当AQP4表达上调时,能缓解血管源性脑水肿,加剧细胞毒性脑水肿,反之亦然。但少数研究[25]发现,AQP4的表达在细胞毒性脑水肿时下降,而在血管源性脑水肿时上升,认为这是机体对抗脑水肿的一种自身保护机制,也推测可能是细胞毒性脑水肿与血管源性脑水肿同时存在时,两者之间的中和作用所致。目前AQP4调节脑水肿的确切机制依然不明确。国外研究显示[26],AQP4表达的早期升高与离子性脑水肿和星形胶质细胞肿胀的形成和发展密切相关,AQP4可以与其他跨膜结构共同表达一个内向整流K+通道-KIR4.1,通过K+形成的渗透梯度驱动水分子经AQP4的跨膜运动,进而影响水稳态。磺酰脲类受体1(sulfonyurea receptor 1,SUR1)是一种ATP结合盒式转运体,调节成孔亚基。成孔亚基瞬时受体电位通道4(transient receptor potential melastatin 4,TRPM4)是由细胞内Ca2+激活的非选择性一价阳离子通道。SUR1与TRPM4具有协同作用,能增加Ca2+的敏感性,两者形成的复合物SUR1-TRPM4与脑水肿形成有关。脑创伤时,AQP4与SUR1-TRPM4聚集在一起形成异多聚水/离子通道复合体,当细胞内Ca2+的升高,SUR1-TRPM4通道被激活,Na+内流,局部渗透压升高,驱动水分子经AQP4流入膜内,从而介导跨膜水通量和星形胶质细胞肿胀[27]。在上述机制中,AQP4可能通过释放ATP后嘌呤能受体的激活参与细胞内Ca2+信号传递。以上研究均表明,创伤性脑水肿形成过程中,细胞内外离子浓度差是水跨膜流动的驱动器,而AQP4则以不同的角色参与其中。
4.2 甘露醇与创伤性脑水肿及AQP4
甘露醇为高渗透压脱水剂,是临床用于颅脑创伤后降颅压的标准药物[28],其作用机制是快速升高血浆渗透压,使血管内处于高渗状态,后者驱使水分子自脑组织转向血管内,导致脑组织水分减少[29]。研究证实,甘露醇导致颅内压反跳是因为它在脑脊液和血清中的排出速度不同,前者慢于后者,使得脑脊液的渗透压升高。脑创伤主要病理改变为血管源性脑水肿,并在创伤早期就出现,后期以血管性脑水肿为主的混合性水肿[30]。脑创伤早期BBB被破坏,甘露醇通过BBB在脑创伤区不断积聚,局部形成高渗状态,促使血管源性脑水肿加重[31]。同时,在甘露醇所致的高渗条件下,甘露醇通过激活p38 MAPK途径,诱导AQP4 mRNA的表达,进而促使AQP4表达上调,如图3所示,促使细胞毒性脑水肿加重[32-34]。然而,具体详细的作用机制仍不清楚,仅发现负责高渗调节的关键顺式作用元件位于AQP4外显子0的5’端旁侧的-345与-428之间[32]。Sunmc等[34]发现,在小鼠重型颅脑损伤模型中,创伤8 h后脑组织严重水肿,AQP4表达明显上升,且其表达水平与脑水肿轻重呈正相关;而创伤后立即使用甘露醇治疗,发现脑水肿得到减轻,AQP4表达亦下调。李冬梅等[35]研究亦证实,创伤6 h首次使用甘露醇能抑制AQP4的表达及减轻脑细胞水肿,AQP4表达减少可能与颅内压降低及脑灌注增加有关。但少数研究发现,甘露醇不仅能提前脑水肿高峰时间,还会延长脑水肿持续时间,并且不同浓度甘露醇均可引起创伤区脑水肿的加重及AQP4表达上调[36]。2种观点不一致,推测与脑创伤时间及脑水肿类型有关,但两者均提示甘露醇对AQP4的表达有影响。通过上述资料可得出,在脑创伤早期以血管源性脑水肿为主时,快速、短期、适量应用甘露醇可下调AQP4的表达,减轻脑水肿;长期独立使用或大剂量使用甘露醇治疗脑水肿则可能因为甘露醇的大量积聚上调AQP4的表达,加重脑水肿,并产生一系列毒副作用,尤其是可能引起肾功能衰竭,其发生率与使用剂量及给药速度呈正相关[37-40]。因此,甘露醇在治疗创伤性脑水肿时是一把“双刃剑”,进一步研究甘露醇对AQP4的调节作用机制,有利于在创伤后不同时间,根据脑水肿不同类型,选择甘露醇的使用时间及剂量;同时,阻断甘露醇对p38 MAPK途径的激活或抑制p38 MAPK对下游信号的调节,从而影响AQP4的表达,或可成为提高甘露醇疗效并减轻其毒副作用的一个关键点。
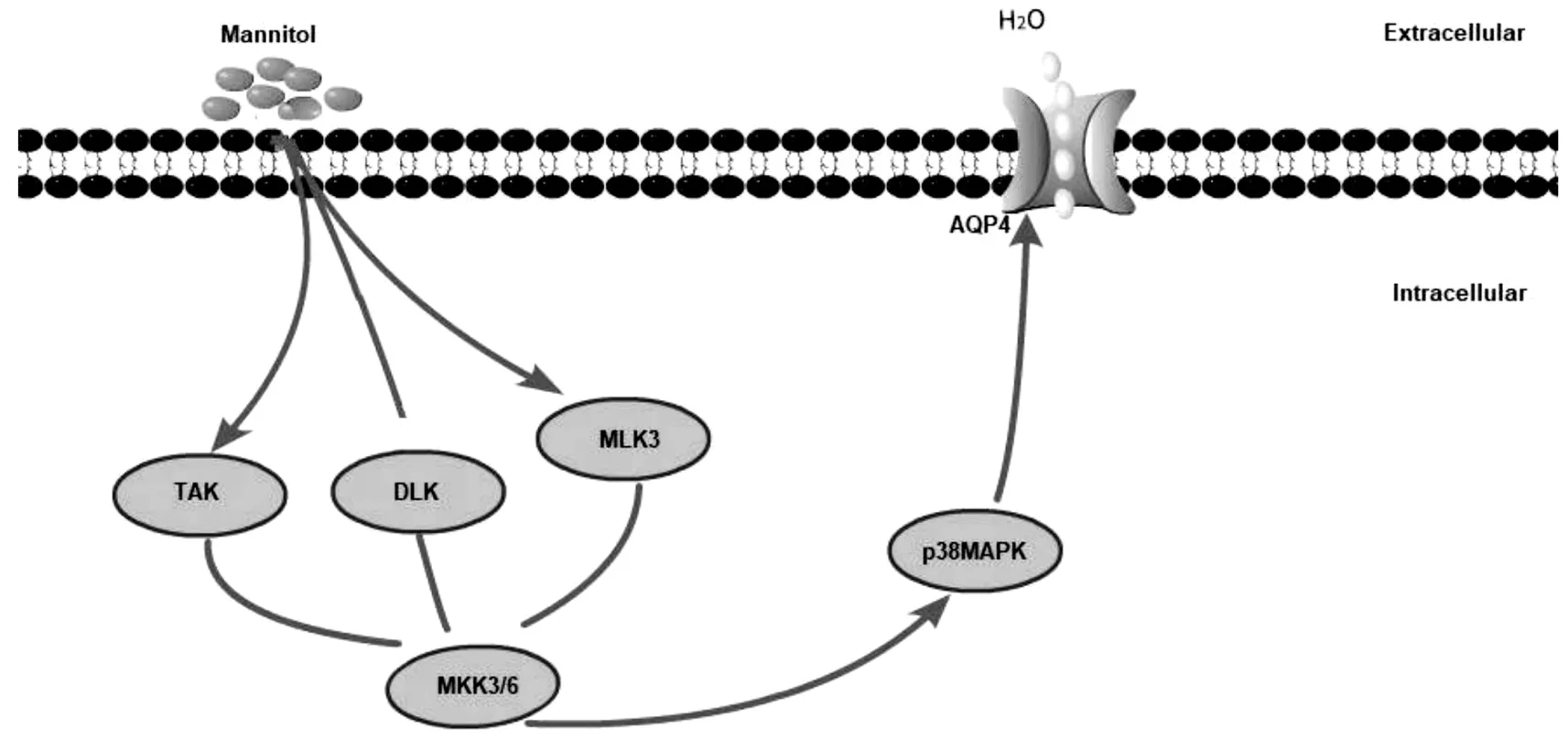
图3 甘露醇诱导AQP4表达的信号通路图
5 结论
AQP4与创伤性脑水肿紧密相关。甘露醇可通过p38 MAPK途径诱导AQP4表达的变化,但p38 MAPK信号通路中有哪些下游因子参与了对AQP4的调控、AQP4的具体作用位点位于何处等都不明确;除了p38 MAPK通路外,甘露醇是否还可通过其他路径影响AQP4的表达,这些都需进一步深入研究。临床治疗创伤性脑水肿时,正确选择甘露醇的应用时间和剂量,最大限度规避其不良反应,扩大其治疗作用[41-42],是临床医生一直探讨的焦点。探讨甘露醇对AQP4表达影响的分子机制,有利于甘露醇治疗创伤性脑水肿的效果达到最优化,也有望为分子靶向治疗脑水肿提供依据。
