氧化苦参碱联合紫杉醇对人胃癌细胞HGC-27和裸鼠移植瘤模型的抑制作用
2022-03-22黄义新刘炜
黄义新 刘炜
胃癌(gastric cancer)是消化道最常见的恶性肿瘤之一,其发病率和死亡率极高。因胃癌预后差,发病率不断上升,已成为世界性的重大健康问题[1]。尽管外科手术是治疗胃癌的关键方式,但化疗和放化疗对于改善可切除恶性肿瘤的预后是必不可少的[2]。目前,化疗已成为治疗中晚期胃癌的主要手段之一。作为一种标准的抗癌药物,紫杉醇(paclitaxel,PTX)在许多肿瘤的治疗中发挥着重要的作用。研究表明,单一抗癌药物紫杉醇治疗中晚期胃癌的有效率为11%~23%,而联合用药的有效率为50%~60%[3]。目前,中药联合化疗药的治疗模式已广泛应用于恶性肿瘤的治疗,且取得可观的疗效[4]。氧化苦参碱(Oxymatrine,Oxy)是从豆科植物苦参中分离出来的一种生物碱,主要成分是氧化苦参碱,也含有少量的氧化槐果碱,具有清热解毒、利尿、抑制病毒和抗肿瘤等多种功效。近年来,氧化苦参碱已用于肿瘤化疗引起的白细胞减少症的治疗,已成为肿瘤化疗研究的新热点[5,6]。然而,Oxy与PTX联合应用对人胃癌的协同抗肿瘤作用尚不清楚。因此,本研究探讨Oxy联合PTX对人胃癌HGC-27细胞和裸鼠移植瘤的抑制作用,以提供实验基础。
1 材料与方法
1.1 药品与主要试剂 氧化苦参碱注射液购自四川科伦药业股份有限公司;紫杉醇注射液购自海南卓泰制药有限公司;0.9%氯化钠溶液购自武汉普诺赛生命科技;RPMI-1640培养基和胎牛血清(FBS)购自美国Gibco公司;MTT检测试剂和二甲基亚砜(DMSO)购自美国Sigma公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自大连宝生物工程有限公司;除抗体外Western blot检测所需相关试剂均购自上海碧云天生物技术研究所;PCNA和Cleaved Caspase-3单克隆抗体和辣根过氧化物酶标记的二抗购自美国CST公司。
1.2 细胞株与实验动物 (1)人胃癌HGC-27细胞株购自中国科学院细胞库,HGC-27细胞复苏后置于RPMI-1640培养液中,并加入体积分数为10%的FBS,放置在37℃、5% CO2、饱和湿度的细胞培养箱中进行培养,待细胞生长至单层贴壁后,使用0.25%的胰蛋白酶消化细胞并传代培养,取对数增殖期的HGC-27细胞进行试验。(2)28只健康清洁级BALB/c裸鼠,4周龄,雌性,体重(20.0±2.0)g,购自北京维通利华实验动物技术有限公司;实验裸鼠常规分笼饲养,自由饮水摄食,饲养环境温度调整为20~25℃,相对湿度在40%~70%,本实验获得动物伦理委员会的批准。
1.3 HGC-27细胞分组处理 用胰蛋白酶消化对数期的HGC-27细胞,调整细胞密度并接种到96孔板中,每孔接种2×104个细胞,放置在37℃培养箱培养12 h,待细胞贴壁后分为4组:对照组(不处理)、氧化苦参碱组(氧化苦参碱2 mg/ml)、紫杉醇组(紫杉醇10 μmol/ml)和氧化苦参碱联合紫杉醇组(氧化苦参碱2 mg/ml+紫杉醇10 μmol/ml),4组细胞加入相应药物处理24 h或48 h,收集细胞进行相关指标检测。本研究加药浓度参考预实验结果。
1.4 MTT法检测细胞存活率 4组HGC-27细胞药物处理24、48 h后,吸去旧培养液,每孔细胞中加入100 μl MTT试剂(终浓度为5 mg/ml),放回37℃培养箱培养4 h,取出细胞,除去细胞上清液,再向每孔细胞中添加150 μl DMSO,振荡溶解沉淀,以只添加培养液不加细胞的孔为空白调零孔,使用酶标仪测定570 nm处各孔细胞的光密度(OD)值,计算4组HGC-27细胞存活率,细胞存活率(%)=(药物组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.5 流式细胞术检测细胞凋亡率 HGC-27细胞分组处理48 h后,除去上清液,收集4组HGC-27细胞,用PBS缓冲液重悬细胞,制成浓度1×106个/ml的细胞悬液,向细胞悬液中添加Annexin V-FITC 5 μl,避光孵育5 min,后加入PI染液5 μl,混匀后,室温下避光孵育15 min,1 h内用流式细胞仪检测4组HGC-27细胞凋亡情况,用ModFit LT软件分析细胞凋亡率。
1.6 Western blot实验检测PCNA和Cleaved Caspase-3蛋白表达 HGC-27细胞分组处理48 h后,加入适量裂解液,在冰上裂解30 min,将裂解液转移至离心管中,离心,上清即所需蛋白,采用BCA法对蛋白进行定量测定,蛋白样品与缓冲液混合后于沸水中加热致蛋白变性,取40 μg蛋白上样,行SDS-PAGE凝胶电泳,蛋白分离后采用湿转法转移至PVDF膜上,随后将膜放置在含10%脱脂奶粉的封闭液中孵育2 h,取出膜并洗涤3次,加入相应稀释的单抗,PCNA和Cleaved Caspase-3单抗均为1∶800稀释,放置在4℃条件下杂交,次日取出膜并洗涤3次,加入1∶2 000稀释的二抗,室温孵育1.5 h,取出膜并洗涤3次,采用ECL化学发光液进行显影,在凝胶成像系统中采集图像,以GAPDH为内参,分析各条带灰度值。计算HGC-27细胞中PCNA和Cleaved Caspase-3蛋白相对表达水平。
1.7 动物模型与分组 人胃癌HGC-27细胞与基底膜基质按照体积比1∶1的比例进行混匀,调整细胞浓度为5×107个/ml,放置在冰盒中备用,BALB/c裸鼠采用3%~4%异氟醚进行麻醉,每只裸鼠右前腋皮下接种约1×107个细胞,接种7 d后,当移植瘤平均体积约144 mm3时(参考文献[7]的方法判断构建模型是否成功),将28只荷瘤裸鼠随机分为4组(每组7只):对照组(Mock组:0.9%氯化钠溶液)、氧化苦参碱组(Oxy组:氧化苦参碱75 mg/kg)、紫杉醇组(PTX组:紫杉醇10 mg/kg)和氧化苦参碱联合紫杉醇组(Oxy+PTX组:氧化苦参碱75 mg/kg+紫杉醇10 mg/kg),4组每天通过腹腔注射给药,持续给药28 d,观察并记录裸鼠状态。
1.8 动物模型与分组相对移植瘤体积、体质量和抑瘤率 每周测量2次裸鼠肿瘤体积(游标卡尺测定裸鼠移植瘤的长径和短径),在28 d时采用颈椎脱臼法处死裸鼠,完整分离移植瘤,称重,测量肿瘤体积,计算抑瘤率。肿瘤体积=(长径×短径2)/2;抑瘤率=(1-给药组平均移植瘤体积/对照组平均移植瘤体积)/×100%=(1-给药组平均移植瘤体重/对照组平均移植瘤体重)/×100%。

2 结果
2.1 HGC-27细胞存活率变化 MTT检测结果显示,药物处理24 h时,与对照组相比,氧化苦参碱联合紫杉醇组HGC-27细胞的存活率明显降低(P<0.05);与氧化苦参碱组和紫杉醇组相比,氧化苦参碱联合紫杉醇组HGC-27细胞的存活率明显降低(P<0.05);与对照组相比,氧化苦参碱组和紫杉醇组细胞存活率有不同程度的降低,但差异无统计学意义(P>0.05)。药物处理48 h时,与对照组相比,氧化苦参碱组和氧化苦参碱联合紫杉醇组HGC-27细胞的存活率明显降低(P<0.05),与氧化苦参碱组和紫杉醇组相比,氧化苦参碱联合紫杉醇组HGC-27细胞的存活率明显降低(P<0.05)。见表1。
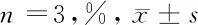
表1 4组HGC-27细胞存活率比较
2.2 HGC-27细胞凋亡率变化 流式细胞术结果显示,与对照组相比,氧化苦参碱组、紫杉醇组和氧化苦参碱联合紫杉醇组HGC-27细胞的凋亡率明显升高(P<0.05);与氧化苦参碱组和紫杉醇组相比,氧化苦参碱联合紫杉醇组HGC-27细胞的凋亡率明显升高(P<0.05)。见图1,表2。

图1 流式细胞术检测HGC-27细胞凋亡情况
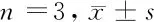
表2 4组HGC-27细胞凋亡率比较
2.3 HGC-27细胞中PCNA和Cleaved Caspase-3表达的变化 Western blot结果显示,与对照组相比,氧化苦参碱组和氧化苦参碱联合紫杉醇组HGC-27细胞中PCNA的表达水平明显降低(P<0.05),Cleaved Caspase-3的表达水平明显升高(P<0.05);与氧化苦参碱组和紫杉醇组相比,氧化苦参碱联合紫杉醇组HGC-27细胞中PCNA的表达水平明显降低(P<0.05),Cleaved Caspase-3的表达水平明显升高(P<0.05)。见图2,表3。
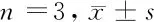
表3 4组HGC-27细胞中PCNA和Cleaved Caspase-3水平比较

图2 Western blot检测4组HGC-27细胞中PCNA和Cleaved Caspase-3的表达
2.4 裸鼠移植瘤体积和抑瘤率比较 与Mock组相比,Oxy组、PTX组和Oxy+PTX组移植瘤体积均明显降低(P<0.05);与Oxy组和PTX组相比,Oxy+PTX组肿瘤体积明显降低(P<0.05),抑瘤率明显增加(P<0.05)。见表4。
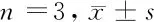
表4 裸鼠移植瘤体积和抑瘤率比较
2.5 裸鼠移植瘤重量和抑瘤率比较 与Mock组相比,Oxy组、PTX组和Oxy+PTX组移植瘤肿瘤均明显降低(P<0.05);与Oxy组和PTX组相比,Oxy+PTX组肿瘤重量明显降低(P<0.05),抑瘤率明显增加(P<0.05)。见表5。
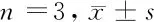
表5 裸鼠移植瘤重量和抑瘤率比较
3 讨论
胃癌是我国常见的恶性肿瘤之一,发病率高,早期诊断率低。胃癌的预后与治疗时间密切相关,早期内镜下可行根治性切除,5年生存率>90%[8]。但我国绝大多数患者诊断为晚期或有远处转移,对这些患者来说,全身治疗(以化疗为主)仍是晚期胃癌患者的最佳选择,但胃癌化疗的发展已进入瓶颈阶段,生存期的提高较为有限[9]。PTX是治疗胃癌的重要药物,能有效延长晚期胃癌患者的生存时间,提高患者的生活质量。然而,近年来的大量临床和实验研究发现,某些类型的恶性肿瘤,包括乳腺癌、肺癌、卵巢癌和胃癌,会对PTX产生主要或次要的抵抗作用[10-13]。此外,高剂量的PTX不仅能够杀伤肿瘤细胞,同时对正常细胞也存在杀伤作用,对机体产生较大的毒副作用。因此,探讨一种提高PTX抗癌作用的新方法具有重要意义。
以往大量研究显示,药物辅助治疗在癌症治疗中取得较大进展,已成为多数研究者关注的热点[14,15]。Li等[16]研究显示,黄芩素联合吉西他滨能够有效抑制胰腺癌细胞的增殖并促进细胞凋亡,且在胰腺癌CFPAC-1细胞移植小鼠模型中,黄芩素和吉西他滨联合治疗可显著降低肿瘤重量和体积,抑制肿瘤生长。苗金钰等[17]研究发现,姜黄素和雷公藤红素联合使用可有效抑制胃癌的发展。王康等[18]实验显示,二氢杨梅素和依托泊苷联合使用可明显增强抑制绒毛膜癌JAR细胞生长的作用,并且联合用药能够减少化疗药依托泊苷的用量。众所周知,肿瘤的发生是由于细胞增殖和凋亡之间的不平衡。PCNA是一种在细胞周期的G1期和S期后期合成的核蛋白,用于监测细胞生长状态的变化[19]。PCNA表达的调控是细胞增殖早期变化的一个重要指标,为Oxy和PTX抑制细胞增殖提供了可能的机制。本研究结果表明,Oxy和PTX通过抑制PCNA在胃癌细胞中的表达来抑制细胞增殖。以前的研究表明,凋亡受Caspase家族调控,活化的Caspase-3能够诱导染色体分裂和细胞凋亡[20]。在本研究中,观察到Oxy和PTX均能够促进Cleaved Caspase-3的表达,而两种药物联合使用后效果更显著。提示Oxy和PTX联合诱导胃癌细胞凋亡可能与上调Cleaved Caspase-3表达有关。目前的研究结果表明,Oxy和PTX联合应用比单独使用两种药物更有效地抑制胃癌细胞的生长。此外,本研究通过裸鼠移植瘤体内实验验证了该结论,Oxy和PTX单独或联合使用均能够降低移植瘤的重量和体积,且联合用药效果更优。
综上所述,Oxy和PTX联合给药在抑制增殖抑制和诱导凋亡方面比单一药物更有效。初步证明Oxy与PTX具有协同抗癌作用。因此,为达到同样的抑制作用,Oxy可以减少PTX的剂量,增强胃癌细胞对PTX的敏感性,减弱大剂量化疗药物对机体多系统的毒副作用。本实验结果可为临床应用单味中药Oxy和化疗药物PTX治疗胃癌提供理论和实验依据。
