不同马传染性贫血病毒株编码的S2 蛋白拮抗SERINC5 分子机理的研究
2022-03-22李荣荣李苏楠IqbalAhmad郑永辉
李荣荣,李苏楠,Iqbal Ahmad,郑永辉
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室-美国密歇根州立大学天然免疫联合实验室,黑龙江 哈尔滨 150069)
天然免疫是机体对抗外来微生物感染的第一道防线,宿主细胞抵御病毒侵入而产生的抗病毒分子又称宿主限制性因子[1]。丝氨酸整合因子5(Serine incorporator 5,Ser5)是近来发现的宿主限制因子,将其通过未知机制插入人免疫缺陷病毒(Human immunodeficiency virus type 1,HIV-1)粒子中并抑制病毒将其侵入下一个靶细胞,而HIV-1 编码的Nef 蛋白能拮抗Ser5 的抗病毒活性[2]。研究发现HIV-1 Nef蛋白能将Ser5 内化至细胞浆中并通过溶酶体途径降解Ser5,进而阻止Ser5 进入新生病毒粒子中[3]。除了HIV-1 Nef 蛋白之外,鼠白血病病毒(Murine leukemia virus,MLV)的附属蛋白glycoGag以及马传染性贫血病毒(Equine infectious anemia virus,EIAV)的附属蛋白S2 也能通过相似的机制拮抗Ser5 对HIV-1 感染的限制作用[4]。然而,不同HIV-1病毒株编码的Nef蛋白拮抗Ser5的能力和具体机制不尽相同。
马传染性贫血(Equine infectious anemia,EIA)是新中国成立以来严重危害养马业的重要传染病之一,EIA 的病原EIAV 是一种复杂的逆转录病毒,能够编码多种附属蛋白调控病毒的复制[5]。S2 是EIAV特有的附属蛋白,S2 的缺失会显著降低病毒在体内的复制水平和致病力[6]。美国Wyoming 强毒株是一种对马属动物高度致死的EIAV,EIAVpv 是Wyoming 株体外培养的适应株,对马属动物具有感染性,但无致病性[7]。pSPEIAV19(No. GU385359.1)(命名为EIAV)是在EIAVpv 株感染的马肾源细胞中获得的非致病感染性克隆株,有研究发现高致病性EIAV Wyoming株或者致病性EIAVpv 变异株的3'端替换pSPEIAV19对应的位置,可恢复该感染性克隆株的致病性[8]。这些研究结果提示影响病毒毒力的区域可能位于病毒基因组的3'端(包括env 和LTR)[9]。通过对非致病感染性克隆株EIAV 研究发现其长期体外传代后丧失了毒力,从而制备了中国EIAV 弱毒疫苗株(No. U01866.1)(命名为EIAVHRBS2),已证明其可有效控制EIA 的流行[10]。王雪峰等人对EIAV 弱毒疫苗亲本株EIAVLN40感染马后连续分离病毒并测序发现,EIAV 基因组在马体内的进化过程中高度变异,呈现明显的正选择压力[11]。作为本实验的研究对象,EIAV 和EIAVHRBS2在核苷酸和推导氨基酸水平上,S2的差异分别为2.5%~4.1%和6.4%~10.6%,具有3 个共有氨基酸取代位点(T41I、T51I、Q55K),说明EIAVHRBS2株S2 中的3 个共有突变残基对该病毒相关毒力蛋白的功能至关重要[12]。
本实验室前期研究发现EIAVS2编码的S2 蛋白(命名为S2 蛋白)通过受体介导的内吞机制内化细胞膜表面的Ser5,并在核内体的帮助下将Ser5 转运到溶酶体后降解,进而拮抗Ser5 的抗病毒活性[13]。然而,EIAVHRBS2编码的S2 蛋白(命名为HRB-S2 蛋白)是否也能拮抗Ser5 的抗病毒活性?二者在机制上是否有区别?目前还不清楚。基于此,本研究将重点探究HRB-S2 蛋白如何拮抗Ser5 的抗病毒活性,试图揭示不同EIAV 编码的S2 蛋白拮抗Ser5 的机制差异,以期对抗HIV-1 药物的开发提供借鉴。
1 材料与方法
1.1 主要实验材料人胚胎肾细胞293T、人宫颈癌细胞Hela 和TZM-bl 细胞(HIV-1 感染后表达荧光素酶,其活性高低与HIV-1 感染性呈正相关)均由本实验室保存;质粒pBJ5-iFLAG-Ser5、pCMV6-Ser5-FLAG、pEGFP-Ser5、pcDNA3.1-Ser5-VN-HA、pcDNA3.1-Ser5-FLAG-VC、pcDNA3.1-S2-HA、pcDNA3.1-glycoMA-HA、pcDNA3.1-Nef-HA、pcDNA3.1-S2-VN-HA、pcDNA3.1-S2-FLAG-VC、pcDNA3.1-AP-μ1-V5-VC、pcDNA3.1-AP-2α-V5-VC、pcDNA3.1-AP-2σ-V5-VC、DsRed-Rab7 和DsRed-Rab11 以及沉默质粒shAP-2σ、shRab7 和shRab11 均由本实验室前期制备并保存[14];HIV-1 野生型(HIV-1 WT)、HIV-1 Nef 缺失型(HIV-1 ΔNef)及HIV-1 Env 质粒均由Kenzo Tokunaga 惠赠;本实验室前期将密码子优化后的HRB S2 基因分别克隆至相应载体构建重组质粒pcDNA3.1-HRB-S2-HA、pcDNA3.1-HRB-S2-VN-HA 和pcDNA3.1-HRB-S2-FLAG-VC 并保存;另外本实验室前期分别对pcDNA3.1-HRB-S2-HA 和pcDNA3.1-HRB-S2-VN-HA 质粒中的HRB-S2 进行点突变,获得了G2A、E22A 和L26A 突变体质粒并保存备用;RIPA 裂解液、 ERAD 通路抑制剂DBeQ、自噬通路抑制剂Wortmannin、泛素蛋白酶体通路抑制剂MG132、溶酶体通路抑制剂Bafilomycin A1、鼠源HA 抗体和鼠源FLAG 抗体均购自Sigma 公司;NH4Cl 由本实验室配制;聚乙烯亚胺转染试剂(Polyethylenimin,PEI)购自Polyscience 公司;Lipofectamine®3000(Lip3000)转染试剂、antiHA-HRP 和Monoclonal ANTI-FLAG(R)M2-Peroxidase(HRP)antibody(antiFLAG-HRP)均购自Thermo 公司;antiActin-HRP 购自武汉三鹰公司;兔源V5 抗体、Alexa-Fluor-647 标记的羊抗鼠IgG、Alexa-Fluor-488 标记的羊抗鼠IgG 均购自Invitrogen 公司;兔源Rab7 和Rab11 抗体购自Cell Signaling Technology。
1.2 HRB-S2 对Ser5 抗病毒活性影响的检测利用PEI转染试剂分别转染HIV-1 WT(1 μg)+HIV-1 Env(0.5 μg)和HIV-1 ΔNef(1 μg)+ HIV-1 Env(0.5 μg)的质粒于293T 细胞中,用于包装HIV-1、HIV-1 ΔNef两组伪病毒,同时分别于上述两组细胞中转染pCMV6-Ser5-FLAG(0.1 μg)、pcDNA3.1-S2-HA(3 μg)、pcDNA3.1-glycoMA-HA(3 μg)、pcDNA3.1-Nef-HA(3 μg)和pcDNA3.1-HRB-S2-HA(3 μg)质粒,其中转染pcDNA3.1-glycoMA-HA 和pcDNA3.1-Nef-HA 组作为本实验的阳性对照。转染48 h 后收集含HIV-1、HIV-1 ΔNef 两组伪病毒上清,通过ELISA 方法对病毒粒子含量进行测定。同时取HIV-1、HIV-1 ΔNef两组伪病毒上清分别感染TZM-bl 细胞,感染48 h 后使用多功能酶标仪检测TZM-bl 细胞荧光素酶活性(即luc 值),计算Luc/ELISA 的比值得到HIV-1 伪病毒的相对感染性,以检测HRB-S2 对Ser5 抗病毒活性的影响。
1.3 HRB-S2 对Ser5 表达及细胞内定位影响的检测使用PEI 转染试剂将pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-S2-HA(3 μg)、pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-glycoMA-HA(3 μg)、pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-Nef-HA(3 μg)、pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-HRB-S2-HA(3 μg)质粒分别转染293T 细胞,转染24 h 后收集细胞,用预冷的RIPA 裂解液裂解细胞提取细胞蛋白,分别以antiActin-HRP(1∶20 000)、antiHA-HRP(1∶2 000)和anti-FLAG-HRP(1∶20 000)为抗体进行孵育,通过western blot 检测Ser5、S2、Nef、glycoMA 和HRB-S2 蛋白的表达,其中检测Nef、glycoMA 作为阳性对照,分析HRB-S2 蛋白对Ser5 的降解情况。为了检测HRB-S2 和Ser5 在细胞内的定位情况,利用Lip3000将pEGFP-Ser5(1 μg)和pEGFP-Ser5(1 μg)+pcDNA3.1-HRB-S2-HA(3 μg)分别转染Hela 细胞,转染24 h 后以Anti-HA(1∶1 000)为一抗,Alexa-Fluor-647 标记的山羊抗鼠IgG(1∶500)为二抗,经DAPI 染核,利用高分辨率活细胞共聚焦显微镜观察具有绿色荧光活性的Ser5 蛋白和具有红色荧光活性的HRB-S2 蛋白的定位情况。
1.4 HRB-S2 降解Ser5 蛋白关键位点的检测利用PEI 转染试剂将质粒pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-HRB-S2-HA(3 μg)、pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-HRB-S2-G2A-HA(3 μg)、pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-HRB-S2-E22AHA(3 μg)和pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-HRB-S2-L26A-HA(3 μg)分别转染293T 细胞,24 h后用预冷的RIPA 裂解液裂解细胞提取细胞蛋白,按照1.3 中western blot 方法检测Ser5 和HRB-S2 及其突变体蛋白表达情况,确定HRB-S2 降解Ser5 蛋白的关键位点。研究发现可以将Venus 蛋白(具有绿色荧光活性)分成两部分, 分别为N 端和C 端,N 端为aa2~aa173 区域(VN), C 端为aa154~aa238区域(VC),当单独存在VN 或者VC 时,荧光分子没有绿光;当VN 和VC 同时存在并足够靠近时,荧光分子活性恢复发出绿色荧光(图3A)[15]。本研究根据该原理进行双分子荧光互补实验(BimolecuLar Fluores- cence Complementation,BiFC):使用Lip3000将质粒pcDNA3.1-Ser5-FLAG-VC(1 μg)+pcDNA3.1-HRB-S2-VN-HA(3 μg)、pcDNA3.1-Ser5-FLAG-VC(1 μg)+pcDNA3.1-HRB-S2-G2A-HA(3 μg)、pcDNA3.1- Ser5- FLAG- VC(1 μg)+pcDNA3.1-HRB-S2-E22A-HA(3 μg)和pcDNA3.1-Ser5-FLAG-VC(1 μg)+pcDNA3.1-HRB-S2-L26A-HA(3 μg)分别转染Hela 细胞24 h 后,按照1.3 中方法检测Ser5 蛋白和HRB-S2及其突变体蛋白在细胞内的分布和共定位情况。
1.5 受体介导的内吞对HRB-S2 降解Ser5 影响的检测使用PEI 转染试剂将质粒pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-HRB-S2-HA(3 μg)分别与APμ1-V5-VC(1 μg)、AP-2α-V5-VC(1 μg)和AP-2σ-V5-VC(1 μg)共转染293T 细胞24 h 后,用预冷的RIPA 裂解液裂解细胞提取细胞蛋白,按照1.3 方法通过western blot 检测Ser5 和HRB-S2、AP-μ1、AP-2α、AP-2σ 蛋白的表达,评估AP-μ1、AP-2α、AP-2σ 蛋白对HRB-S2 降解Ser5 的影响。使用PEI转染试剂将质粒pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-HRB-S2-HA(3 μg)+shAP-2σ(4 μg)转染293T细胞,其中沉默质粒shAP-2σ 转染细胞后能够特异性降解AP-2σ 的mRNA 导致AP-2σ 基因表达沉默,24 h 后用预冷的RIPA 裂解液裂解细胞后提取细胞蛋白,按照1.3 中western blot 方法检测Ser5、HRB-S2和Actin 蛋白的表达,评估shAP-2σ 沉默AP-2σ 后对HRB-S2 降解Ser5 的影响。利用Lip3000 将质粒pBJ5-iFLAG-Ser5(2 μg)和pBJ5-iFLAG-Ser5(2 μg)+pcDNA3.1-HRB-S2-HA(3 μg)分别转染两组Hela 细胞,转染24 h 后两组细胞用Anti-FLAG(1∶1 000)4 ℃孵育30 mins,接着将一组样品在37 ℃孵育1 h使Ser5 发生内吞,另一组在4 ℃孵育1 h 阻止内吞,以Anti-FLAG(1∶2 000)为一抗,其余抗体种类及浓度按照1.3 中激光共聚焦试验进行,观察具有绿色荧光活性Ser5 蛋白的定位情况,以检测在受体作用下HRB-S2 对Ser5 降解的影响。
1.6 Rab7 和Rab11 对HRB-S2 降解Ser5 影响的检测使用PEI 转染试剂将质粒pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-HRB-S2-HA(3 μg)分别与DsRed-Rab7(3 μg)和DsRed-Rab11(3 μg)共转染293T 细胞,转染24 h 后用预冷的RIPA 裂解液裂解细胞提取细胞蛋白,按照1.3 中western blot 方法检测Ser5、HRB-S2、Rab7、Rab11 和Actin 蛋白的表达情况,确定Rab7 和Rab11 对HRB-S2 降解Ser5 的影响。使用PEI 转染试剂将pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-HRB-S2-HA(3 μg)分别与shRab7(4 μg)和shRAb11(4 μg)共转染293T 细胞24 h 后用预冷的RIPA 裂解液裂解细胞后提取细胞蛋白,分别以Anti-Rab7,Anti-Rab11(1∶5 000)为一抗,其余抗体种类及浓度参照1.3 中western blot 方法,检测Ser5 和Actin 蛋白的表达,评估沉默Rab7 和RAb11 表达后对HRBS2 降解Ser5 的影响。
1.7 不同EIAV编码的S2蛋白对Ser5蛋白降解影响的检测分别利用Lip3000和PEI转染试剂将Ser5-FLAGVC(1 μg)+Ser5-VN-HA(1 μg)、S2-FLAG-VC(1 μg)+S2-VN-HA(1 μg)和HRB-S2-FLAG-VC(1 μg)+HRBS2-VN-HA(1 μg)分别共转染Hela 细胞和293T 细胞,转染24 h 后对Hela 细胞按照1.3 方法处理样品,通过激光共聚焦观察绿色荧光(S2-FLAG-VC+S2-VN-HA 和HRB-S2-FLAG-VC+HRB-S2-VN-HA形成二聚体的情况)和红色荧光(S2 和HRB-S2 蛋白)共定位的情况;转染24 h 后对收集293T 细胞并固定,封闭,以Anti-FLAG(1∶1 000)为一抗,Alexa-Fluor-488 标记的羊抗鼠IgG(1∶500)为二抗,通过流式细胞术检测平均荧光强度(MFI)以确定S2和HRB-S2 蛋白形成二聚体的情况。为了进一步确定HRB-S2 降解Ser5 蛋白的降解途径,使用PEI转染试剂分别将质粒pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-HRB-S2-HA(3 μg)、pCMV6-Ser5-FLAG(0.1 μg)+pcDNA3.1-S2-HA(3 μg)共转染293T 细胞,转染6 h 换液,12 h 后分别加入DBeQ(15 μmol/L)、Wortmannin(100 nmol/L)、MG132(10 μmol/L)、NH4Cl(20 μmol/L)和Bafilomycin A1(100 nmol/L)蛋白降解通路抑制剂继续培养12 h 后用预冷的RIPA裂解液裂解细胞后提取细胞蛋白,按照1.3中western blot方法检测Ser5、HRB-S2 和Actin 蛋白表达情况,确定HRBS2降解Ser5蛋白的降解途径。
1.8 统计学分析本研究使用SPSS 软件对所有实验数据进行配对双尾t检验统计学分析。所有试验至少重复3次,结果以±s表示。*:P<0.05,表示差异显著;**:P<0.01,***:P<0.001表示差异极显著。
2 结 果
2.1 HRB-S2 对Ser5 抗病毒活性影响的检测结果利用HIV-1 WT和HIV-1 ΔNef质粒转染293T细胞包装两种伪病毒,同时过表达Ser5、glycoMA、Nef、S2、HRB-S2 蛋白,通过ELISA 检测病毒上清中两组伪病毒粒子的含量,同时将含两组伪病毒上清感染TZM-bl靶细胞获得荧光素酶的活性值(Luc值),计算Luc/ELISA的比值得到HIV-1 WT和HIV-1 ΔNef两组伪病毒的相对感染性,以评估HRB-S2 对Ser5 抗病毒活性的影响。结果显示HIV-1 WT 和HIV-1 ΔNef 在无Ser5时,HIV-1 WT感染性大于HIV-1 ΔNef;在过表达Ser5蛋白时,Ser5能够抑制HIV-1的感染性,尤其是在Nef缺失的情况下抑制HIV-1的感染性更显著;而Nef、glycoMA、S2 和HRB-S2 均能极显著拮抗Ser5 的抗病毒活性(P<0.001),其中S2 拮抗Ser5 的能力比HRB-S2更强(图1)。表明HRB-S2能够拮抗Ser5的抗病毒活性。

图1 HRB-S2对Ser5抗病毒活性的影响Fig.1 The effect of HRB-S2 on the antiviral activity of Ser5
2.2 HRB-S2 对Ser5 表达及细胞内定位影响的检测结果将pCMV6-Ser5-FLAG 和pcDNA3.1-HRBS2-HA 质粒共转染293T 细胞,通过western blot 检测Ser5 蛋白的表达,评估HRB-S2 对Ser5 降解的影响。结果显示,与对照组相比,Nef、glycoMA、S2、HRBS2 均能显著降解Ser5 蛋白表达,其中HRB-S2 和Nef降解Ser5 的能力比S2 和glycoMA 弱(图2A)。利用Lip3000 将pEGFP-Ser5 和pcDNA3.1-HRB-S2-VN-HA分别单独和共转染Hela 细胞,激光共聚焦观察可见,单独转染pEGFP-Ser5 组,Ser5 在细胞膜表面有绿色荧光,表明Ser5 分布于细胞膜;共转染pEGFPSer5+HRB-S2-HA 组,Ser5 和HRB-S2 在细胞浆内存在绿色和红色荧光的共定位情况,表明HRB-S2 能够将Ser5 从细胞膜表面转运至细胞浆(图2B)。以上结果表明HRB-S2 下调细胞膜表面Ser5 的表达。
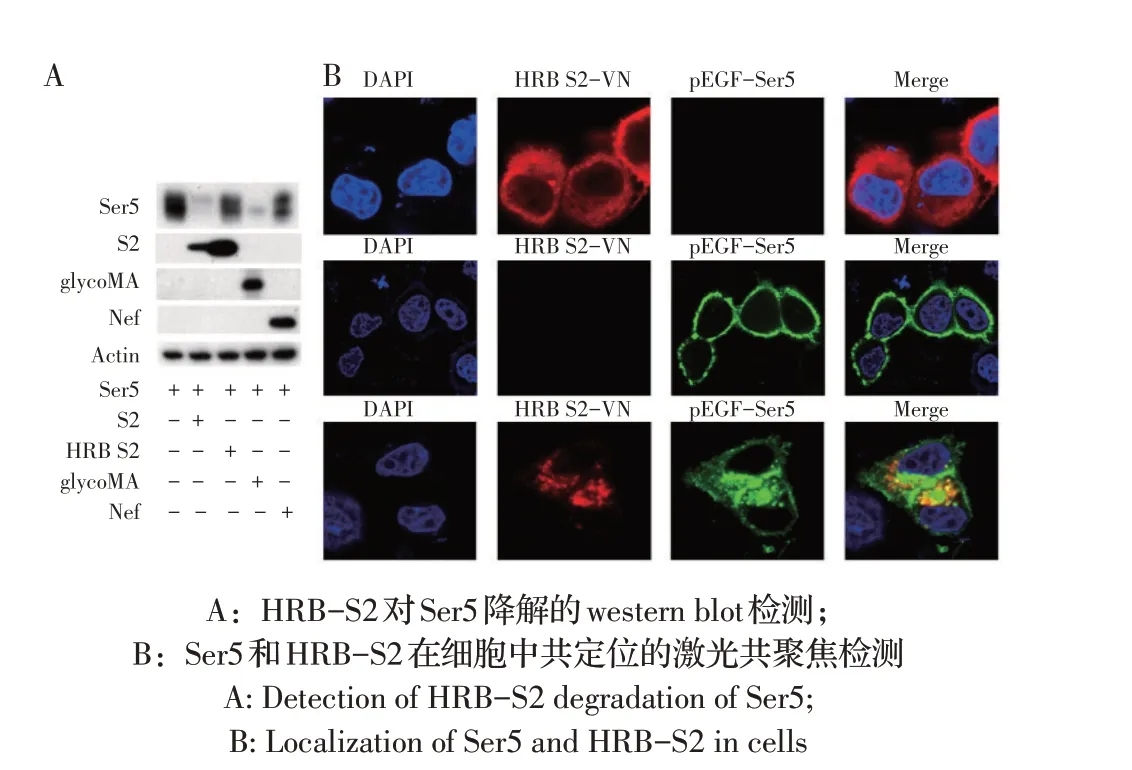
图2 HRB-S2对Ser5表达及细胞内定位的影响Fig.2 The effect of HRB-S2 on Ser5 degradation and cellular localization
2.3 HRB-S2降解Ser5蛋白关键位点的检测结果将质粒pCMV6-Ser5-FLAG 与pcDNA3.1-HRB-S2-HA 及其G2A、E22A 和L26A 突变体共转染293T 细胞, western blot 检测结果显示,HRB-S2-WT 能够显著降解Ser5 蛋白,这与2.2 结果一致;而HRB-S2 L26A 降解Ser5 蛋白的能力减弱,表明L26是降解Ser5 蛋白的关键位点(图3B);同时利用激光共聚焦检测HRB-S2及突变体蛋白与Ser5 在细胞内定位情况,结果显示HRB-S2 与Ser5 在细胞浆存在共定位,而HRB-S2 L26A 和Ser5在细胞膜有共定位(图3C),表明L26A不能下调细胞膜表面的Ser5。以上结果表明L26是HRB-S2转运降解Ser5 蛋白的关键氨基酸位点。

图3 HRB-S2降解Ser5蛋白的关键位点的检测Fig.3 Detection of the key site of HRB-S2 degradation of Ser5
2.4 受体介导的内吞对HRB-S2 降解Ser5 影响的检测结果将质粒pCMV6-Ser5-FLAG+pcDNA3.1-HRB-S2-HA 分别与pcDNA3.1-AP-μ1-V5-VC、pcDNA3.1-AP-2α-V5-VC 和pcDNA3.1-AP-2σ-V5-VC 共转染293T细胞,通过western blot检测Ser5蛋白的表达水平,以确定AP-μ1、AP-2α、AP-2σ蛋白对HRB-S2降解Ser5 的影响。结果显示,仅AP-2σ 能显著促进HRB-S2 对Ser5 的降解(图4A、4B);将质粒pCMV6-Ser5-FLAG+pcDNA3.1-HRB-S2-HA+shAP-2σ 共转染293T 细胞,通过western blot 检测Ser5 蛋白的表达水平,确定shAP-2σ沉默AP-2σ 后对HRB-S2 降解Ser5的影响,结果显示利用shRNA 沉默AP-2σ 表达后,HRB-S2 不能降解Ser5 蛋白的表达(图4C),表明AP-2σ 参与HRB-S2 对Ser5 的降解过程。在温度依赖的内吞试验中,已知在4 ℃条件下细胞代谢停止,细胞内吞活动被抑制。通过激光共聚焦观察可见,与4 ℃相比,在37 ℃时HRB-S2 显著促进Ser5的内吞(图4D)。这些结果表明HRB-S2 通过受体介导的内吞机制内化Ser5 蛋白。
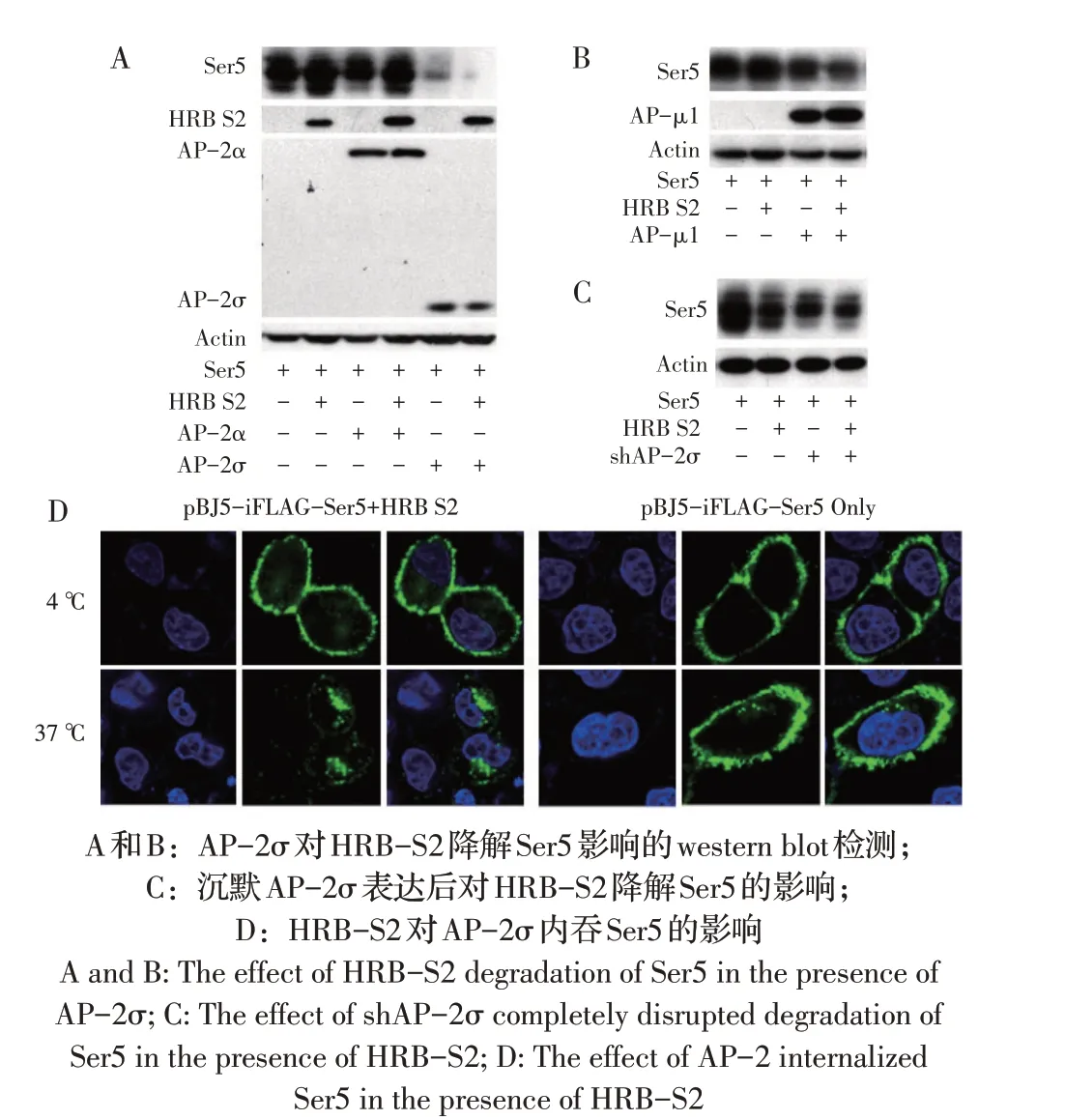
图4 受体介导的内吞对HRB-S2降解Ser5的影响Fig.4 The effect of receptor-mediated endocytosis on HRB-S2 degradation of Ser5
2.5 Rab7 和Rab11 对HRB-S2 降解Ser5 影响的检测结果过表达Ser5、HRB-S2 和Rab7、Rab11 蛋白后通过western blot 检测在HRB-S2、Rab7、Rab11 作用下Ser5 的蛋白表达,以确定Rab7 和Rab11 对HRB-S2 降解Ser5 影响,结果显示Rab7 和Rab11 存在条件下,HRB-S2 降解Ser5 的能力增强(图5A),表明Rab7 和Rab11 能促进HRB-S2 降解Ser5;另外过表达Ser5、HRB-S2 和shRab7、shRab11 质粒,通过western blot 检测Ser5 蛋白的表达,确定沉默Rab7 和RAb11 蛋白对HRB-S2 降解Ser5 影响,结果显示沉默Rab7 和Rab11 后HRB-S2 降解Ser5 能力明显减弱(图5B)。以上结果表明Rab7和Rab11参与HRB-S2 降解Ser5 的过程。
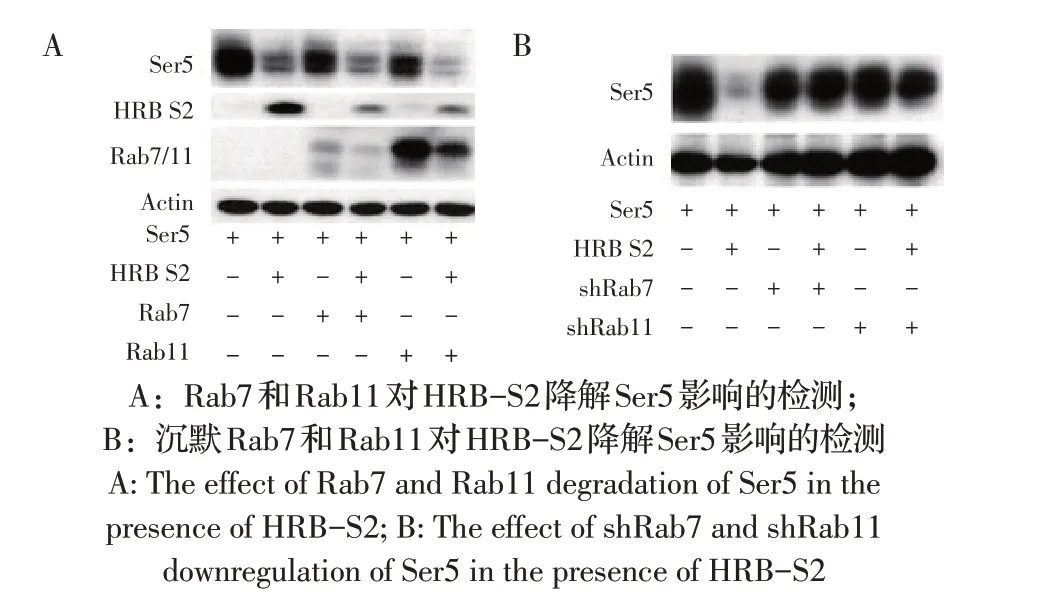
图5 Rab7和Rab11对HRB-S2降解Ser5影响的western blot检测Fig.5 The effect of Rab7 and Rab11 degradation of Ser5 in the presence of HRB-S2
2.6 不同EIAV 编码的S2 蛋白对Ser5 降解影响的检测结果利用BiFC 技术,将Ser5-FLAG-VC+Ser5-VN-HA、S2-FLAG-VC+S2-VN-HA 和HRB-S2-FLAGVC+HRB-S2-VN-HA 分别共转染Hela 细胞和293T 细胞,通过激光共聚焦观察Hela 细胞组绿色荧光,结果显示HRB-S2 和Ser5 均存在二聚体,而S2 不会形成二聚体(图6A);通过流式细胞术检测293T 细胞组,结果显示HRB-S2 的平均绿色荧光强度(MFI)明显高于S2,表明HRB-S2 存在二聚体,而S2 不存在二聚体(图6B)。在检测HRB-S2 降解Ser5 蛋白的降解途径试验中,过表达Ser5 和HRB-S2 蛋白12 h 后分别加入多种蛋白降解通路抑制剂阻止蛋白降解,通过western blot 检测Ser5 蛋白的表达以确定HRB-S2降解Ser5 蛋白的降解途径,结果显示,NH4Cl 和Bafilomycin A1 显著抑制HRB-S2 和S2 对Ser5 的降解作用(图6C);此外,MG132 显著抑制HRB-S2 对Ser5的降解作用,并增加HRB-S2 的表达,而对S2 无影响(图6C、6D),表明HRB-S2 通过蛋白酶体和溶酶体途径降解Ser5。上述结果表明HRB-S2 蛋白能够形成二聚体,并通过蛋白酶体和溶酶体途径降解Ser5 蛋白。

图6 不同EIAV编码的S2蛋白对Ser5降解的影响的检测Fig.6 The effect of different EIAV S2 on Ser5 degradation
3 讨 论
Ser5 是新近发现的在不同物种间高度保守的宿主限制因子,能抑制逆转录病毒HIV-1、鼠白血病病毒(MLV)、EIAV 的感染性,而病毒附属蛋白Nef、gycoMA 和S2 能拮抗Ser5 的抗病毒活性[15]。本研究发现,EIAVHRBS2编码的HRB-S2 蛋白也能拮抗Ser5 的抗病毒活性,并且HRB-S2 蛋白能显著降低Ser5 的表达,但是HRB-S2 蛋白降解Ser5 的能力明显比S2 弱。通过对HRB-S2 蛋白进行点突变,发现L26是其降解Ser5 的关键氨基酸位点,这与本团队前期研究结果一致[13]。通过比较不同病毒株的S2 蛋白发现,L26是比较保守,虽然来自不同病毒株的S2 蛋白序列存在差异,导致不同S2 蛋白的功能有所不同,但本研究证实该保守位点在S2 拮抗Ser5 抗病毒活性中发挥重要作用。
本实验室前期研究结果证明Nef、glycoMA 和S2通过受体介导的内吞内化Ser5,并将Ser5 靶向到溶酶体进行降解[13]。S2 具有一个功能性N 末端肉豆蔻酰化位点,S2 和Se5 之间的相互作用依赖于该豆蔻酰化位点,并可与质膜结合,由此推测S2 和Se5 的相互作用发生在细胞膜上。研究表明S2 与质膜上的Ser5 存在相互作用,并通过AP-2 介导的内吞作用下调Ser5[16]。S2 将Ser5 重新定位到Rab5 早期、Rab7 晚期和Rab11 循环核内体中[13]。本研究发现HRB-S2 蛋白也能通过AP-2σ 将Ser5 内化至Rab7 和Rab11 内体中。由此可以看出,尽管不同病毒附属蛋白拮抗Ser5 的能力存在差异,但逆转录病毒如HIV-1、EIAV 和MLV 等已经进化出类似的机制来拮抗宿主Ser5 的病毒限制作用。
BiFC 试验结果表明HRB-S2 蛋白能形成二聚体。本实验室前期研究结果表明Nef 之间存在二聚体形式,而glycoMA 和S2 蛋白却不能形成二聚体[4]。本研究通过western blot试验发现,Nef和HRB-S2蛋白降解Ser5 的能力明显比S2 蛋白和glycoMA 弱,结合相关研究推测病毒因子形成二聚体可能会影响其拮抗Ser5的能力[17]。本研究进一步通过使用不同降解通路的特异性抑制剂研究发现,HRB-S2 蛋白不仅通过溶酶体途径降解Ser5,还能通过蛋白酶体通路降解Ser5,然而与S2 相比,蛋白酶体通路的特异性抑制剂还能阻止HRB-S2 蛋白的降解。根据这些结果推测形成二聚体构象的HRB-S2 蛋白本身可以通过蛋白酶体途径降解,导致能与Ser5 结合的HRB-S2 蛋白减少,这可能是HRB-S2 蛋白拮抗Ser5 抗病毒活性能力比S2 蛋白弱的原因之一,但这一推论需要进一步验证。
本研究结果显示HRB-S2 通过AP-2 介导的内吞将Ser5 从细胞膜表面转运至细胞浆中,在Rab7 和Rab11 的参与下将Ser5 转运至溶酶体和蛋白酶体进行降解,从而拮抗Ser5 的抗病毒活性。在本实验室前期研究的基础上,本研究发现S2 和HRB-S2 蛋白均能通过降解宿主Ser5 蛋白而拮抗其抗病毒活性,然而S2 拮抗Ser5 的能力比HRB-S2 强,且HRB-S2存在二聚体化蛋白构象,S2 则没有。推测这可能是HRB-S2 拮抗Ser5 的能力比S2 弱的原因之一。本研究首次阐述了HRB-S2 蛋白拮抗Ser5 抗病毒活性能力及机制,为新型抗病毒药物的研发奠定了基础。
