水产品中酰胺类除草剂及其代谢物的气相色谱-质谱法测定
2022-03-22彭中校张华威李佳蔚宫向红张秀珍徐英江刘永春
彭中校,张华威,李佳蔚,宫向红,张秀珍*,徐英江,王 丹,刘永春
(1.上海海洋大学 食品学院,上海 201306;2.山东省海洋资源与环境研究院,山东 烟台 264006)
为了增大土地利用率,提高农作物产量,使收益最大化,除草剂已不可避免地应用于现代农业生产中。由于农药自身的特性与稳定性,在施用后不可避免残留在环境中,并通过降雨、淋溶等途径进入水体[1],影响水生生态系统,进而通过食物链对人体健康产生风险。
酰胺类除草剂在农业生产中使用广泛,常用的主要有甲草胺(Alachlor)、乙草胺(Acetochlor)、丙草胺(Pretilachlor)、丁草胺(Butachlor)以及异丙甲草胺(Metolachlor)等。2-甲基-6-乙基苯胺(MEA)是乙草胺、异丙甲草胺的中间体,2,6-二乙基苯胺(DEA)是甲草胺、丙草胺和丁草胺的中间体[2-3],这两种中间体也是酰胺类除草剂的代谢产物[4-6]。这些物质在自然环境下能长期存在并蓄积于生物体内,且均具有较强毒性,可对生物和人体健康产生危害[7]。我国现行国家标准《食品安全国家标准除草剂残留量检测方法》(GB 23200.1-2016)[8]与《水体中甲草胺等六种酰胺类除草剂的多残留测定气相色谱法》(NY/T 1728-2009)[9]中规定了酰胺类除草剂在谷物、粮油以及水体中的残留检测方法,虽然其他食品可参照执行,但是水产品样品基质复杂,含水量也与普通农产品不同,而且国内关于代谢物MEA、DEA的检测方法甚少。因此,建立并完善同时检测水产品中酰胺类除草剂及其代谢物的方法具有重要意义,对填补国内水产品中除草剂残留检测研究领域的空缺具有重要参考价值。
国内目前关于酰胺类除草剂农药残留的检测方法较多[10-13],但同时检测其代谢物或降解产物的方法鲜有报道。乔丹等[14]将旋蒸后的提取液经凝胶色谱、固相萃取净化后,收集洗脱液,建立了动物源性水产品中16种除草剂的检测方法,但样品前处理步骤繁琐,时间较长。本研究通过优化样品前处理条件,简化前处理步骤,采用简洁、高效的气相色谱-质谱法(GC-MS),建立了同时测定水产品中5种酰胺类除草剂及其2种代谢物的检测方法。该方法灵敏度高,精密度好,能满足水产品中5种酰胺类除草剂及其2种代谢物的定量分析要求。同时为了验证方法的适用性,采用该方法检测分析了山东省沿海海域四角蛤蜊(Mactraveneriformis)、大菱鲆(Scophthalmus maximus)、中国对虾(Fenneropenaeuschinensis)和半滑舌鳎(C yno gl ossussemi l aevi s)样品中酰胺类除草剂的残留状况,为深入研究酰胺类除草剂污染对水产品质量安全的直接影响提供了技术支撑。
1 实验部分
1.1 仪器与试剂
气相色谱-质谱联用仪(7890B/5977B,美国安捷伦公司);SB-25-12DT超声波清洗机(宁波新芝生物科技);N-EVAP氮吹仪(美国Organomation公司);H2050R低速离心机(长沙湘仪有限公司)。HLB固相萃取柱(60 mg/3 mL,沃特世公司)。
甲醇、乙酸乙酯、丙酮、正己烷、二氯甲烷(农残级),均购自美国默克公司;实验用水为三级水。乙草胺、甲草胺、异丙甲草胺、丁草胺、丙草胺、2,6-二乙基苯胺、2-甲基-6-乙基苯胺标准品(德国Dr.Ehrenstorfer公司)。
1.2 样品前处理
准确称取(5±0.05)g经均质的样品于50 mL离心管中,加入20 mL二氯甲烷-乙酸乙酯(3∶2,体积比,下同)混合溶剂旋涡混匀1 min,超声提取20 min后,于10℃下4 000 r/min离心20 min。吸取上清液转移至另一50 mL离心管中,使用15 mL二氯甲烷-乙酸乙酯(3∶2)对残渣进行重复提取,合并上清液,于40℃氮吹浓缩至约1 mL。加入1 mL甲醇,旋涡混合1 min,加入10 mL水混匀,经3 mL甲醇、3 mL水活化后的HLB固相萃取柱净化后以3 mL水淋洗,抽干5 min,用3 mL正己烷洗脱,收集洗脱液待测。
1.3 仪器条件
1.3.1色谱条件色谱柱:J&W DB-17石英毛细柱(30 m×0.25 mm,0.25μm);柱温程序:70℃维持1 min,以15℃/min升至200℃,维持1 min,再以2℃/min升至222℃,最后以10℃/min升至270℃,维持1 min;载气(高纯He)流速1.0 mL/min;进样口温度230℃,不分流进样,进样量1μL。
1.3.2质谱条件配置EI源;电子能量70 eV;接口温度280℃;离子源温度230℃;四极杆温度:150℃;溶剂延迟5 min,选择离子监测(SIM)模式。
2 结果与讨论
2.1 样品前处理条件优化
2.1.1提取剂的选择水产品中农药残留检测的提取剂主要有正己烷[15-17]、乙腈[18]、二氯甲烷[19]及各种有机混合溶剂如盐酸-乙醇混合溶剂[20]等,可根据样品种类和测定的目标物进行选择和优化。代谢物MEA、DEA的检测方法文献较少,主要针对水、啤酒、血浆、尿液等液体基质。选择提取剂时,除去水产品样品中的多余水分非常关键。提取剂选用不当,不能充分渗透到样品中,将导致提取效率低,造成目标物回收率不能满足要求。本实验发现,用乙腈或丙酮提取,除草剂的回收率满足要求,但由于提取液中含有大量水分,其浓缩过程较长,且对代谢物MEA、DEA的回收率低;而采用非极性的正己烷提取,目标物的回收率不能满足要求。经试验,采用二氯甲烷-乙酸乙酯(3∶2)混合溶剂进行提取时,代谢物MEA、DEA与5种酰胺类除草剂的回收率结果满意。
2.1.2净化方法的优化由于水产品样品成分较复杂,而目标物的含量很低,需对提取液进行充分的净化处理,以提高检测方法的灵敏度和准确性。固相萃取法[20-21]为常见的食品中药物残留检测的净化方法,其净化效果依赖于待测成分与固体萃取剂相互作用力的强弱[22],因此选择合适的固体萃取剂和过柱方法非常重要。固相萃取技术操作简单、前处理快速,在水产品分析中具有很大优势,同时,对去除色素和生物大分子的干扰效果良好[23]。HLB固相萃取柱是广泛应用的一种新型萃取柱,其填料既有亲脂性,也有亲水性,容量高、保留能力强[24]。本实验结果表明,使用HLB固相萃取柱净化样品提取液,能排除大部分干扰物质的影响,提高目标物的信噪比、保证方法的灵敏度。
合适的洗脱液和洗脱体积是获得良好净化效果的关键因素。甲醇是HLB固相萃取柱的最常用洗脱剂,但须经过浓缩、转换溶剂才能用于GC-MS分析。本实验发现,采用甲醇洗脱时,无论采用旋蒸还是氮吹方法浓缩,洗脱液中MEA、DEA均损失严重,回收率较低。选用正己烷、丙酮作为洗脱剂时,为避免浓缩过程的损失,对洗脱液体积进行优化,结果见图1。实验结果表明,用3 mL正己烷或丙酮洗脱,洗脱液不经浓缩,直接进行GC-MS分析,可保证7种目标物的回收率均满足要求。由于丙酮洗脱液中含有少量水,需要除水后进行GC-MS分析,增加了操作步骤。因此,本实验最终采用3 mL正己烷洗脱。
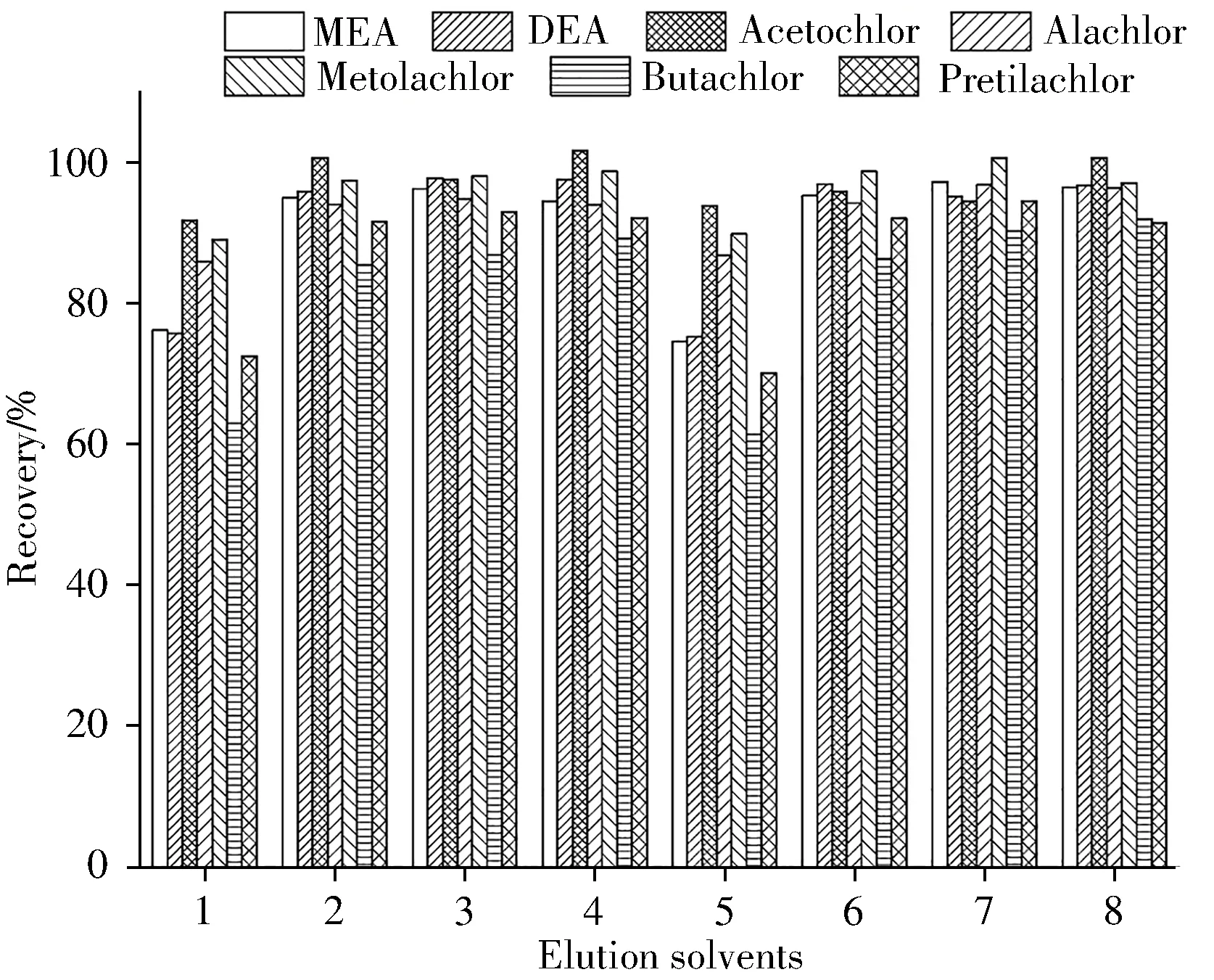
图1 7种目标物在不同洗脱液下的回收率Fig.1 Recoveries of 7 target compounds under different elution solvents
2.2 特征离子的选择
以全扫描模式对7种目标物的标准溶液进行分析,选择质谱图中丰度高、干扰少的离子作为特征离子,采用SIM模式进行测定。7种目标物的监测离子见表1。
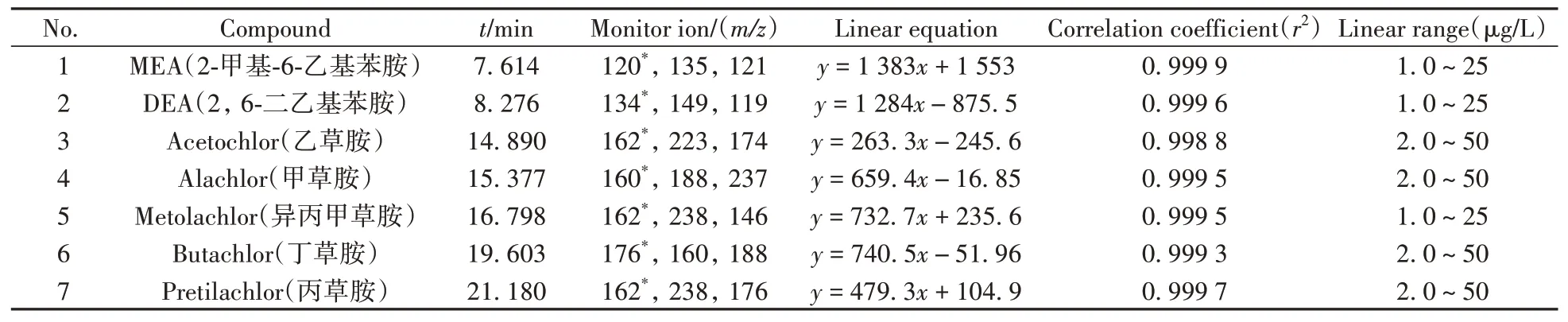
表1 7种目标物的保留时间、监测离子、线性方程、相关系数及线性范围Table 1 Retention times,monitoring ions,linear equations,correlation coefficients and linear ranges of 7 compounds
2.3 色谱条件优化
气相色谱-质谱分析的定性依据是保留时间和特征离子,柱温是目标物保留时间的决定因素。本实验对柱升温程序进行了优化,有效避免了杂质干扰,7种物质的分离效果以及峰形良好。混合标准溶液、空白样品(四角蛤蜊)及空白加标样品的总离子流色谱图见图2。
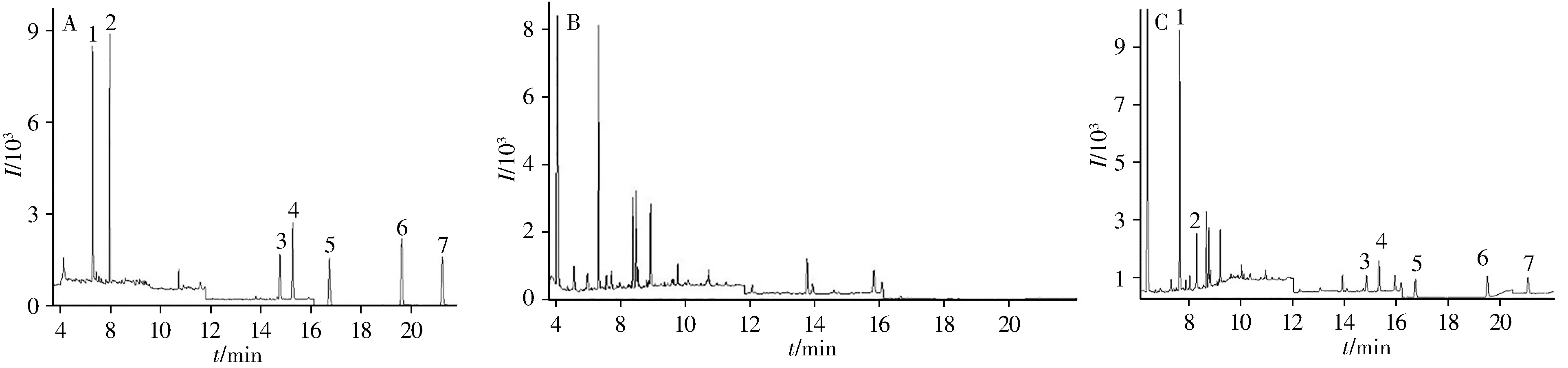
图2 7种目标物标准溶液(A,50μg/L)、空白样品(四角蛤蜊)(B)及空白加标样品(C)的总离子流色谱图Fig.2 Total ion chromatograms of 7 compounds standards(A,50μg/L),blank sample of Mact ravener ifor mis(B)and spiked sample of Mactrav enerif or mis(C)
2.4 检出限与线性范围
取MEA、DEA、异丙甲草胺质量浓度分别为1.0、2.5、5.0、10、25μg/L,乙草胺、甲草胺、丁草胺、丙草胺质量浓度分别为2.0、5.0、10、20、50μg/L的混合标准工作液进样分析,以定量离子峰面积为y轴,对应的质量浓度为x轴绘制标准曲线。MEA、DEA、异丙甲草胺在1.0~25μg/L质量浓度范围内,其余4种目标物在2.0~50μg/L质量浓度范围内与其响应值线性关系良好,相关系数(r2)均不低于0.998 8。7种目标物的线性方程、相关系数和线性范围见表1。
以信噪比S/N≥3为检出限(LOD),S/N≥10且回收率、精密度满足残留检测要求为定量下限(LOQ)。其中MEA、DEA、异丙甲草胺的LOD为0.5μg/kg,LOQ为1.5μg/kg;另外4种的LOD为1.0μg/kg,LOQ为3.0μg/kg。
2.5 回收率与相对标准偏差
称取3组,每组4个(5.00±0.05)g的空白样品,分别进行四角蛤蜊、许氏平鮋(S ebast es sch legelii)、三疣梭子蟹(Portunus t ritub erculatus)中7种化合物低、中、高3个加标水平的回收试验。其中MEA、DEA、异丙甲草胺的低、中、高3个加标水平分别为2.5、5.0、10μg/kg,甲草胺、乙草胺、丙草胺、丁草胺的低、中、高3个加标水平分别为5.0、10、20μg/kg,重复测定6次。四角蛤蜊的加标回收率为69.7%~111%,相对标准偏差(RSD)为0.40%~7.6%(表2);许氏平鮋的加标回收率为65.3%~118%,RSD为1.7%~9.3%;三疣梭子蟹的加标回收率为61.4%~113%,RSD为0.90%~7.1%。

表2 四角蛤蜊样品的加标回收率及相对标准偏差(n=6)Table 2 Recoveries and relative standard deviations of the target compounds of M a ct ravenerif or mis(n=6)
2.6 实际样品检测
将本方法用于山东省沿海海域四角蛤蜊、大菱鲆、中国对虾和半滑舌鳎样品的检测。其中1份四角蛤蜊样品中检出代谢物MEA,检出量为3.74μg/kg,检出率为2.5%。阳性样品的色谱图见图3。

图3 四角蛤蜊阳性样品的离子流色谱图Fig.3 Ion chromatogram of a Mactr ave neri formi s positive sample
3 结 论
本研究以二氯甲烷-乙酸乙酯混合溶剂为样品提取液,通过HLB固相萃取柱净化,建立了水产品中5种酰胺类除草剂及其代谢物MEA、DEA的GC-MS测定方法。该方法样品前处理简单,定量下限、回收率以及精密度均能满足实验室检测要求,适用于水产品中5种酰胺类除草剂及其代谢物的同时测定。
