食用明胶中猪源性成分检测研究进展
2022-03-22朱晓艳古淑青邓晓军
朱晓艳,古淑青,孙 欣,钮 冰,邓晓军
(1.上海大学 生命科学学院 食品工程系,上海 200436;2.上海海关动植物与食品检验检疫技术中心,上海 200135)
明胶是一种重要的食品添加剂,通常用于糖果、果冻等食品的生产[1-2],此外,还应用于药品胶囊等医疗领域[3-5]。食用明胶主要来源于猪、牛、鱼等动物的骨和皮,是胶原蛋白的水解产物[6]。在伊斯兰教中,严禁食用含猪源性成分的非清真产品。一些伊斯兰国家制定严格的法规[7],要求生产商和进口商在产品上标明清真认证,以区别非清真产品。清真食品以其“健康”的理念,同样吸引着非穆斯林消费者,清真产业成为快速增长的消费领域[8],然而部分不法商家为降低成本采用较廉价的原材料(如猪明胶),导致掺假和贴错标签的现象时有发生。而不同物种间DNA和蛋白质的相似性、加工过程中DNA和蛋白质的降解,对食品中明胶来源的鉴定造成困难,因此迫切需要开发一种用于检测猪源性明胶的可靠且灵敏的分析方法。
目前,已建立了多种检测明胶及含明胶食品中猪源性成分的方法,主要包括聚合酶链式反应(PCR)[9-15]、酶联免疫吸附法(ELISA)[16-18]、液相色谱-串联质谱法[19-25]和衰减全反射傅立叶变换红外光谱法(ATR-FTIR)[26-28]等,方法可大致分为基于DNA的方法和基于蛋白质的方法(如图1)。本文主要对不同分析方法的优点与不足进行综述,以期为明胶中猪源性成分的鉴定提供参考。

图1 加工食品中猪源性明胶的检测方法Fig.1 Detection methods of porcine gelatin in processed food
1 基于DNA检测明胶中猪源性成分的方法
1.1 样品前处理
PCR检测的可靠性和敏感性取决于DNA的质量[29],脂肪、多糖和矿物质等PCR抑制剂的存在,可能导致假阴性结果[30];此外,食品加工过程会导致DNA的降解[31-32]。因此,对加工食品进行前处理以制备高质量DNA对PCR扩增至关重要。目前加工食品中DNA的提取方法主要分为裂解液提取法和试剂盒提取法。
1.1.1裂解液提取
该法可通过直接裂解释放DNA,常用裂解液有十六烷基三甲基溴化铵(CTAB)、十二烷基硫酸钠(SDS)和异硫氰酸胍。通常步骤为:加入蛋白酶K降解蛋白质,使DNA充分游离;以酚-氯仿-异戊醇抽提,去除杂质;加入异丙醇或无水乙醇沉淀DNA,并将沉淀溶解于三羟甲基氨基甲烷-乙二胺四乙酸(Tris-EDTA,TE)缓冲液中。王瑞元等[33]比较了5种不同裂解液对奶糖中DNA的提取效果,结果表明改良SDS裂解液提取的DNA浓度、纯度及PCR扩增效果最佳。
1.1.2试剂盒提取
市售DNA提取试剂盒多采用旋转柱技术和/或移动固相提取[34],可最大限度回收DNA片段以确保DNA的高质量。Lee等[9]利用试剂盒从明胶胶囊中提取的DNA得率为6.5~131 ng/μL;Sultana等[11]从高度加工的食品样品中得到的DNA提取量仍可达到约4~12 ng/μL。但该方法成本高昂、操作繁琐。
1.2 PCR检测方法
1.2.1常规PCR
常规聚合酶链式反应(Polymerase chain reaction,PCR)又称传统PCR,通过DNA聚合酶在一定反应体系中对DNA目标片段进行扩增,如图2所示。常用的遗传标记12S rRNA、16S rRNA、细胞色素b(Cytb)和细胞色素氧化酶I(COI)基因以及内部转录间隔区(ITS)和置换环(D-loop)区域,拷贝数高且高度保守,已被广泛用于哺乳动物、鱼类等物种的鉴定[35]。与单拷贝基因相比,这些多拷贝基因的使用可使PCR方法达到更低检出限(LOD)。Lee等[9]利用16S rRNA基因成功区分了市售胶囊中的明胶来源,其中猪源性DNA的检出限(LOD)达0.01 ng/μL。

图2 PCR特异性引物原理图Fig.2 Schematic diagram of PCR specific primer
1.2.2多重PCR
多重PCR(Multiplex polymerase chain reaction,MPCR)指在常规PCR基础上使用两对及以上不同引物,同时扩增或检测多个靶标。此方法较常规PCR具有高通量、特异性好、简便快速等优点[36]。Nikzad等[10]利用线粒体DNA(mtDNA)同时检测胶囊中猪和牛的DNA,检测灵敏度可达0.1%;Sultana等[11]针对Cyt b基因对清真品牌糖果进行四重PCR测定,成功区分了产品中的猪、牛和鱼明胶,LOD可达0.001 ng。此方法由于在体系中同时进行多个PCR反应,对引物设计要求较高,技术要素和影响因素控制不当易造成特异性和灵敏度降低,甚至无法检出[37]。需控制引物个数,并在保证引物特异性前提下减少引物间的非特异性结合。
1.2.3实时荧光定量PCR
实时荧光定量PCR(Real-time fluorescent quantitine PCR,qPCR)指在常规PCR基础上向体系中加入荧光基团,通过荧光信号进行实时监测的一种核酸定量技术[38]。其扩增与检测在封闭体系中进行,避免了常规PCR检测中电泳带来的污染问题。目前常用的荧光系统包括SYBR green、Taq Man探针和分子信标(MB),原理如图3所示。Sudjadi等[12]采用D-loop序列检测市售胶囊中猪源性DNA,LOD为5 pg;Mohamad等[13]利用染色体MPRE42重复序列结合MB检测实际样品中的猪DNA,LOD低至1 pg;Cai等[14]利用Taq Man探针在低至1 pg/mL的浓度下灵敏地检测到胶囊中的猪DNA。
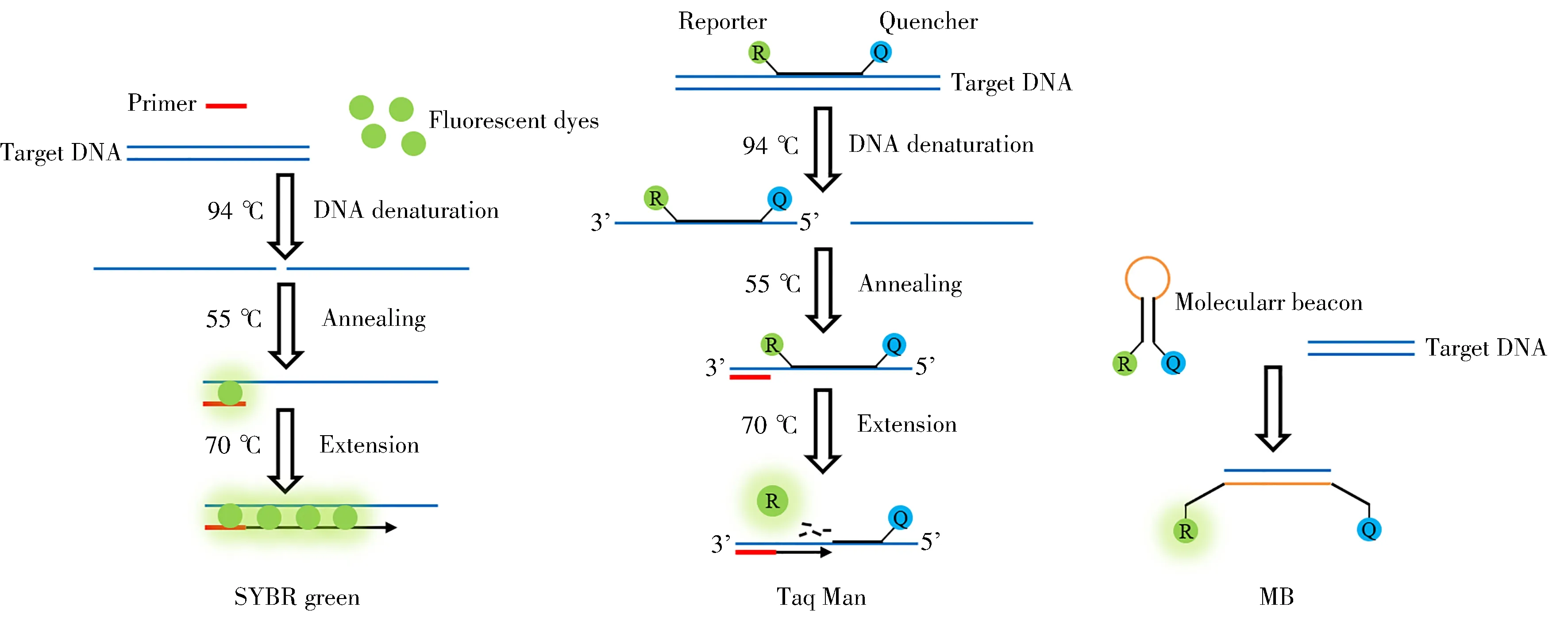
图3 qPCR常用荧光系统原理示意图Fig.3 Schematic diagram of common fluorescence system of qPCR
1.2.4多重荧光定量PCR
多重荧光定量PCR(Multiple fluorescence quantitative PCR)指在qPCR基础上使用两对及以上不同引物和相应探针,同时对多个靶标进行检测。此方法兼具多重PCR和荧光定量PCR的优点,重复性好、灵敏度高、特异性强,可进行定量和定性分析,同时减少了环境污染[37]。Taq Man探针是多重荧光定量PCR体系中的常用探针,通过在不同序列末端标记不同荧光基团(Reporter)及相应的猝灭基团(Quencher),即可形成不同的Taq Man探针[39]。Sultana等[15]建立的qPCR方法对混合明胶的检出限可达0.005 ng/μL,并成功应用于口香糖、果冻等市售清真样品的鉴定。
1.2.5PCR-Southern杂交
PCR-Southern杂交是通过将变性生物素标记的扩增片段与固定在膜上的特异性探针杂交,对物种特异性进行识别的方法,其流程图见图4。Mutalib等[40]针对mt DNA Cytb基因设计引物,在Olipro™猪基因芯片上进行Southern杂交,LOD可达0.001 ng,而常规PCR方法均未检出。将Southern杂交和PCR技术相结合,可以检测到极少量的DNA扩增产物,方法灵敏、重复性好,但操作繁琐。
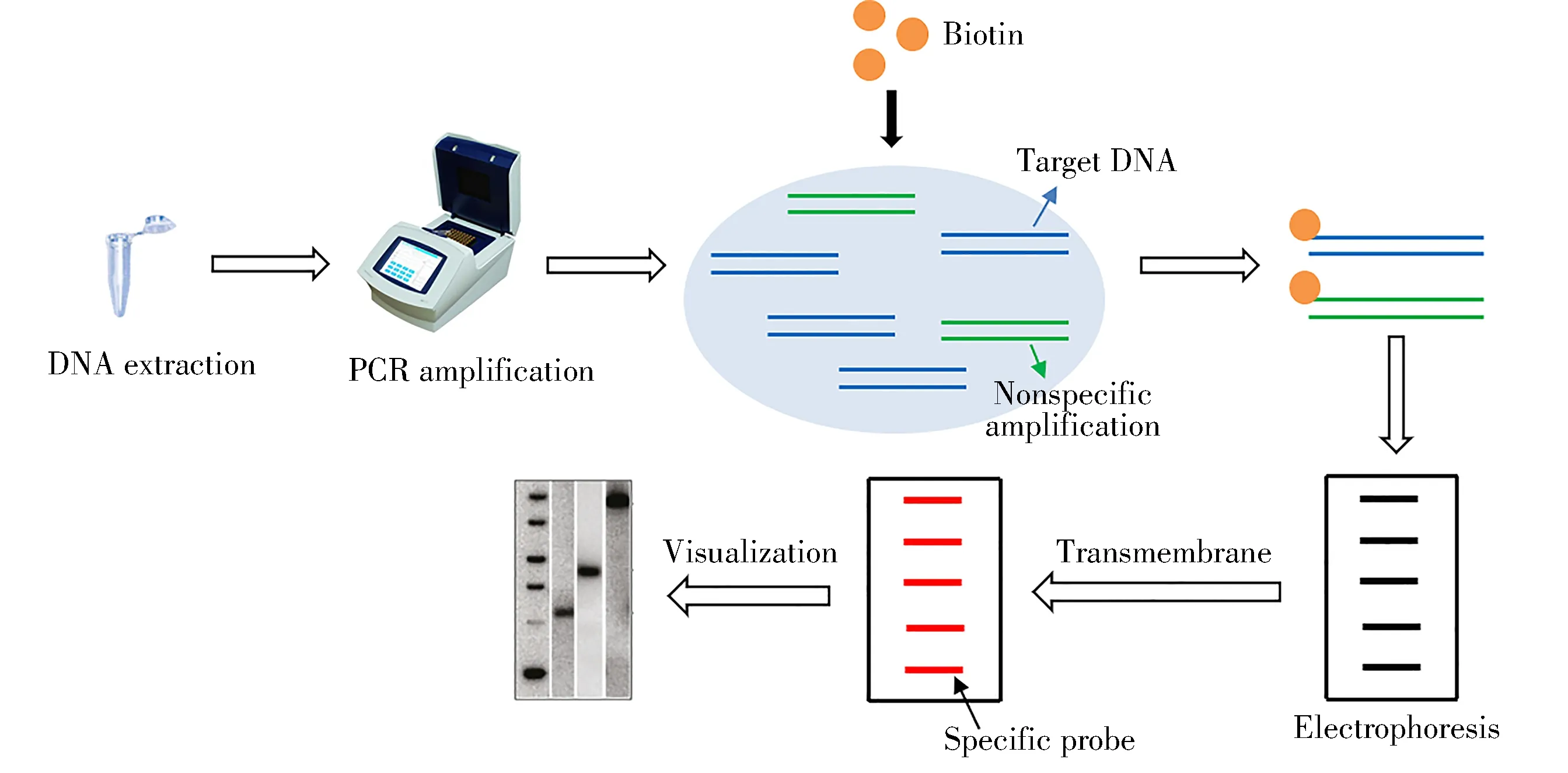
图4 PCR-Southern杂交流程图Fig.4 Flow chart of PCR-Southern blot
2 基于蛋白质检测明胶中猪源性成分的方法
2.1 样品前处理
食品中的蛋白质经深加工后遭到严重破坏,因此对加工食品中微量蛋白质的提取显得尤为重要。样品前处理与检测方法有关,在衰减全反射傅立叶变换红外(ATR-FTIR)光谱法测定中,所有样品不需要任何预处理[27-28];采用质谱检测时通常需要将提取的样品进行酶解[19-21,23-24]。蛋白质的提取方法主要包括有机溶剂沉淀法、盐析法和表面活性剂吸附法。
2.1.1有机溶剂沉淀法
有机溶剂可通过降低水溶液的介电常数,破坏蛋白质的水化膜,导致蛋白质分子发生聚集和沉淀[41]。常用的有机溶剂有甲醇、乙醇和丙酮。但该方法易造成蛋白质变性,需将有机溶剂预冷(-20℃)并在低温下操作。沉淀后还需将有机溶剂吹干,并将蛋白颗粒溶解在缓冲溶液中,加入适量保护剂(如2-巯基乙醇、乙二胺四乙酸(EDTA)、SDS)稳定蛋白质[17,42-43]。
2.1.2盐析法
向含有蛋白质的溶液中加入盐溶液,可以改变蛋白质的疏水相互作用,增强或减少蛋白质的溶解性[41]。常用的中性盐主要有硫酸铵、硫酸钠、氯化钠等。此法不易使蛋白质变性,但提取效率较低,可通过适当加大样品浓度、调节pH值和温度提高分离效率。
2.1.3表面活性剂吸附法
由于蛋白质包含极性、非极性和带电基团,故表面活性剂可与蛋白质形成复合物。这一原理被广泛应用于提取和纯化蛋白质[44]。根据极性基团的解离性质,表面活性剂可分为阳离子型表面活性剂(Cationic surfactant,CS)、阴离子型表面活性剂(Anionic surfactant,AS)、两性表面活性剂(Zwitterionic surfactant,ZS)以及非离子型表面活性剂(Non-ionic surfactant,NIS)。聚山梨醇20(Tween20)是一种典型的食品级低分子量NIS,可以充分提取吸附蛋白[42,45]。较有机溶剂沉淀法和盐析法,表面活性剂吸附法可减少试剂使用和实验步骤。
2.2 明胶中猪源性蛋白质的检测方法
2.2.1酶联免疫吸附法(ELISA)
酶联免疫吸附法(Enzyme linked immunosorbnent assay,ELISA)是一种将抗原-抗体反应的高度特异性和酶的高效催化作用相结合的免疫分析方法[46],最常用的两种ELISA方法为间接法和夹心法。由于该方法样品制备简单,并且具有高通量、高灵敏度的优点,成为一种检测商业产品中明胶的可行方法,但近缘物种之间胶原蛋白序列的高度同源性,导致抗体受到交叉反应的限制,表现出较差的物种特异性。
Tukiran等[16]建立了3种竞争性间接ELISA方法用于快速检测食用燕窝(EBN)中的猪明胶,LOD分别为0.033、0.082、0.052 mg/mL;进一步研究表明,该方法同样适用于果冻、棉花糖等加工产品的检测,LOD为0.05μg/mL[17];Doi等[18]建立了两种适用于分析不含熟肉制品的加工食品中猪明胶的夹心ELISA方法,检测限可达0.78 ng/mL。
2.2.2十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)
SDS-PAGE电泳根据蛋白质分子量不同进行分离,通过物种特异性蛋白质条带分析明胶来源,方法准确、简单、快速、经济。Yap等[47]通过SDS-PAGE方法对市售胶囊进行检测,观察到猪明胶样品在110 kDa处有明显条带;Azira等[42]结合主成分分析(PCA)方法对数据进行分析,可以检测到牛明胶中5%的猪明胶掺杂率。但此方法分辨率较低,不适用于检测复杂基质中的明胶来源,可结合等电聚焦电泳分离蛋白质,经酶切成肽段后以高分辨率质谱进一步分析[48]。
2.2.3基于特征肽段的质谱法
2.2.3.1液相色谱与质谱联用法质谱是表征和鉴定蛋白质的首选方法。将蛋白质酶解成肽段后进行质谱分析,可根据氨基酸组成和物种特征肽段,确定复杂基质中蛋白质的来源[49]。此方法简单、准确、灵敏,被广泛应用于食品的掺假鉴定[50-51]。Zhang等[19]采用高效液相色谱-串联质谱(HPLC-MS/MS)得到猪特征肽段GPPGSAGAPGK,并发现脯氨酸羟基化引起的质量差异可影响多肽鉴定;Ward等[20]经超高效液相色谱-串联质谱(UPLC-MS/MS)检测到加工产品中的猪特异性识别肽AGPAGPDGPLGPAGSR、LNGPAPGR和LGPLGSPGL,其响应强且无杂峰;Guo等[21]在UPLC-MS/MS多反应监测(MRM)模式下,以AGVMGPOGSR作为特征肽段,对猪明胶的检测具有较高专一性,在0.04%低含量下仍可检出。
2.2.3.2高效液相色谱-线性离子阱/静电场轨道阱质谱法线性离子阱/静电场轨道阱(LTQ/Orbitrap)质谱利用离子在特定静电场中的运动频率不同进行质量分析,具有极高的分辨率和质量精确度[52],可以明确地区分明胶来源。Sha等[22]采用LTQ/Orbitrap质谱通过各自特征肽段对混合物中的牛皮明胶、猪皮明胶和阿胶明胶进行了明确区分。每种明胶中可检测到的特征肽段的数量随着混合物中目标明胶浓度的降低而减少;在目标明胶含量较低(<10%)情况下仍可检测到多个目标特征肽段。
2.2.3.3基质辅助激光解吸电离飞行时间质谱法基质辅助激光解吸电离飞行时间质谱法(MALDITOF MS)是一种简单、高效、低成本的物种鉴定常规技术。Flaudrops等[23]利用MALDI-TOF MS从猪明胶中鉴定出10个特异峰,猪明胶添加量降至1%时,仍在10个猪物种特征峰中发现了5个峰。但该项技术由于需要高性能质谱仪与色谱联用,其应用受到限制。
2.2.3.4纳升级超高效液相色谱-串联质谱法纳升级分离技术是使用流速在10~1 000 nL/min范围内的色谱柱进行食品分析的一种方法[53]。该技术提供了一种更快、更好的食品成分分离手段,具有前所未有的灵敏度和特异性,特别是当与MS检测联用时,有助于解决复杂样品中低浓度物质的分析问题。此外,该方法的新颖之处在于,可在不依赖数据的采集模式下工作,并借助交替的高、低碰撞能量提供明胶的母离子和子离子信息。但与传统的HPLC仪器相比,该方法耗时、成本高,不适宜常规分析[53-55]。
Yilmaz等[24]利用纳升级超高效液相色谱和电喷雾电离四极杆飞行时间质谱(nanoUPLC-ESI-QTOF MS)成功地区分了奶酪、酸奶和冰激凌中的猪和牛明胶;Dal Belloa等[25]开发了一种基于纳升级高效液相色谱-高分辨质谱(nanoUPLC-HRMS)的方法检测红酒中的猪明胶,最低检出限为5μg/mL。
2.2.4衰减全反射傅立叶变换红外光谱法(ATR-FTIR)
傅立叶变换红外光谱(FTIR)基于不同化合物的分子结构不同,通过不同和特定的红外光谱(生物分子指纹)区分明胶来源,具有快速、简便、无损且只需制备少量样品的优点,成为鉴别不同食品中掺假和真伪问题的有效工具[43]。但FTIR光谱法的数据结果通常需要结合主成分分析(PCA)和化学计量学等现代统计工具进行处理。Cebi等[26]依据由肽键的C==O伸缩振动引起的酰胺-Ⅰ吸收带以及酰胺-Ⅱ吸收带成功区分了牛明胶和猪明胶,并成功应用于软糖的分析[27];Aloglu等[28]结合模糊的多元规则建设专家系统(FuRES)和支持向量机(SVM)的分类方法成功区分了牛、猪和鱼明胶。
2.2.5微生物酶法
微生物酶法是利用微生物中天然明胶酶的特异性作用水解猪明胶的一种方法。该方法环保、快速,可以通过重组或定向进化提高酶活与特异性,但菌种筛选可能不尽人意[56],需有针对性的采集样品并通过大量实验确定培养条件。Shahimi等[57]对可能的产明胶酶菌落进行筛选,并确定了可能与猪明胶特异性水解表达相关的基因序列,重组酶的检出限为微摩尔(μmol)级。虽未确定特异性水解猪明胶的蛋白酶,但该方法有望成为利用微生物资源鉴定猪明胶的新型方法,并为开发基于蛋白质的快速试纸条法和生物传感器提供了参考。
表1~2分别列出了部分基于DNA与基于蛋白质检测明胶中猪源性成分的方法及特点。

表1 PCR检测明胶中猪源性DNA的方法Table 1 Detection methods of porcine DNA in gelatin by PCR

表2 基于蛋白质检测猪源性明胶的方法Table 2 Methods for determination of porcine gelatin based on protein
3 展 望
本文总结了各种分析方法在纯明胶样品和在食品系统中辨别明胶来源的潜力。其中,傅立叶变换红外光谱(FTIR)、液相色谱-质谱联用(LC-MS/MS)等理化分析方法为猪明胶的检测提供了良好的途径,SDS-PAGE电泳、ELISA和实时荧光PCR等生物学分析方法对猪明胶的检测具有良好的特异性。未来的研究应进一步探索现代技术对明胶来源进行分类的有效性。此外,为提高清真产品鉴定中明胶分析的精密度和准确度,今后应进一步将两种或两种以上分析方法联合应用;同时应探索新的快速和非破坏性的方法,如生物传感器、高光谱成像技术[58]和化学成像方法[59-60]。
