组织结构和细胞形态变异对诊断硬化性肺细胞瘤的影响
2022-03-22韩丽华苏秋香孙佩杰王恩华
韩丽华,苏秋香,孙佩杰,张 珉,王 亮,王恩华
硬化性肺细胞瘤是发生在肺实质内、起源于原始呼吸道上皮细胞的良性肿瘤,其突出的组织学特点是含有血管瘤样区、实性区、乳头区和硬化区,由肺泡Ⅱ型细胞样细胞和间质多角形细胞构成[1-2]。然而,在日常病理工作中仅仅掌握硬化性肺细胞瘤是由4种基本形态结构和2种主要类型细胞构成的,尚不能进行鉴别。尤其是对穿刺小活检材料和术中冷冻快速病理进行诊断,由于取材的局限性等原因,存在风险和陷阱[3-5]。WHO(2021)胸部肿瘤分类[6]中只是归纳了硬化性肺细胞瘤可能会出现的各种变异,本文收集281例硬化性肺细胞瘤患者的临床资料,分析其组织结构和细胞形态的变异,以提高临床与病理医师的认识水平。
1 材料与方法
1.1 材料收集1990年1月~2020年12月中国医科大学第一附属医院病理科诊断硬化性肺细胞瘤的存档切片和(或)蜡块标本281例。其中男性84例,女性197例;年龄23~78岁,平均43.6岁。根据典型的硬化性肺细胞瘤组织学结构和细胞形态特点,由两位资深的病理医师复查HE切片,发现变异的组织结构和(或)细胞后,共同予以确认。
1.2 方法
1.2.1HE和免疫组化染色 标本均经10%中性福尔马林固定24 h,常规石蜡包埋,4 μm厚连续切片,行HE、免疫组化SP法染色。兔抗人单克隆抗体SP-B、TTF-1、CKpan、vimentin、CD56和CD117,均购自福州迈新公司。二抗试剂盒(羊抗鼠/兔ab5878),均购自福州迈新公司。将制成的4 μm厚切片脱蜡至水,高压热修复抗原,3% H2O2去除内源性过氧化物酶,PBS水洗后分别加即用型一抗,室温孵育1 h,PBS水洗后加二抗,室温孵育30 min,DAB显色,封固。用PBS代替一抗作为阴性对照,以切片内的肺泡Ⅱ型细胞作为阳性对照。
1.2.2免疫组化结果判定 TTF-1阳性信号定位于细胞核,>50%的细胞核出现阳性信号为阳性,反之为阴性。SP-B和CKpan的阳性信号定位于细胞质和细胞膜,>50%的细胞质和细胞膜出现阳性信号为阳性,反之为阴性。vimentin的阳性信号定位于细胞质,出现弥漫阳性信号为阳性,点灶状信号或不着色为阴性。
1.3 组织学结构和细胞形态变异判定根据经典的硬化性肺细胞瘤的4种组织学结构和细胞形态学特点,由两位资深的病理医师复查HE切片并对照免疫组化染色结果,发现变异的组织结构和(或)细胞后,共同予以确认。
2 结果
2.1 硬化性肺细胞瘤的基本形态变异肿瘤位于肺实质内,边界清晰,无包膜或假包膜。结节直径0.5~6.0 cm。2例在同一肺叶内多发病灶,4例伴局部淋巴结侵袭或转移,1例合并典型类癌。镜下同时表现为实性、乳头状、血管瘤样和硬化区的病例相对较少(17.08%,48/281),以实性为主占9.96%(28/281),以乳头状为主占13.17%(37/281),以血管瘤样为主占7.12%(20/281),绝大多数的硬化性肺细胞瘤表现为2~3种混合型组织结构,占52.67%(148/281)。
2.2 硬化性肺细胞瘤的组织结构和细胞形态变异
2.2.1多核瘤巨细胞形成 31.67%(89/281)的病例中均可见多核瘤巨细胞形成,细胞大,其核的数量不等,核的形态与周围的Ⅱ型细胞的核类似。多核瘤巨细胞出现的数量不等,其分布差异也较大。有的位于细胞性乳头表面(图1A),有的位于硬化性乳头的表面或硬化性乳头之间(图1B)。瘤巨细胞表达CK、TTF-1和SP-B,与Ⅱ型肺泡上皮细胞免疫组化标记一致。
2.2.2模拟乳头或微乳头结构 典型的硬化性肺细胞瘤中的乳头状结构则是一个“细胞性乳头”,即乳头的中心是由疏密不等的间质细胞填充,并非纤维血管轴心,但也不像微乳头那样完全缺少轴心结构(图1C),这种模拟乳头或微乳头的变异发生率较小(3/281),但在小活检标本中出现时则难以鉴别。
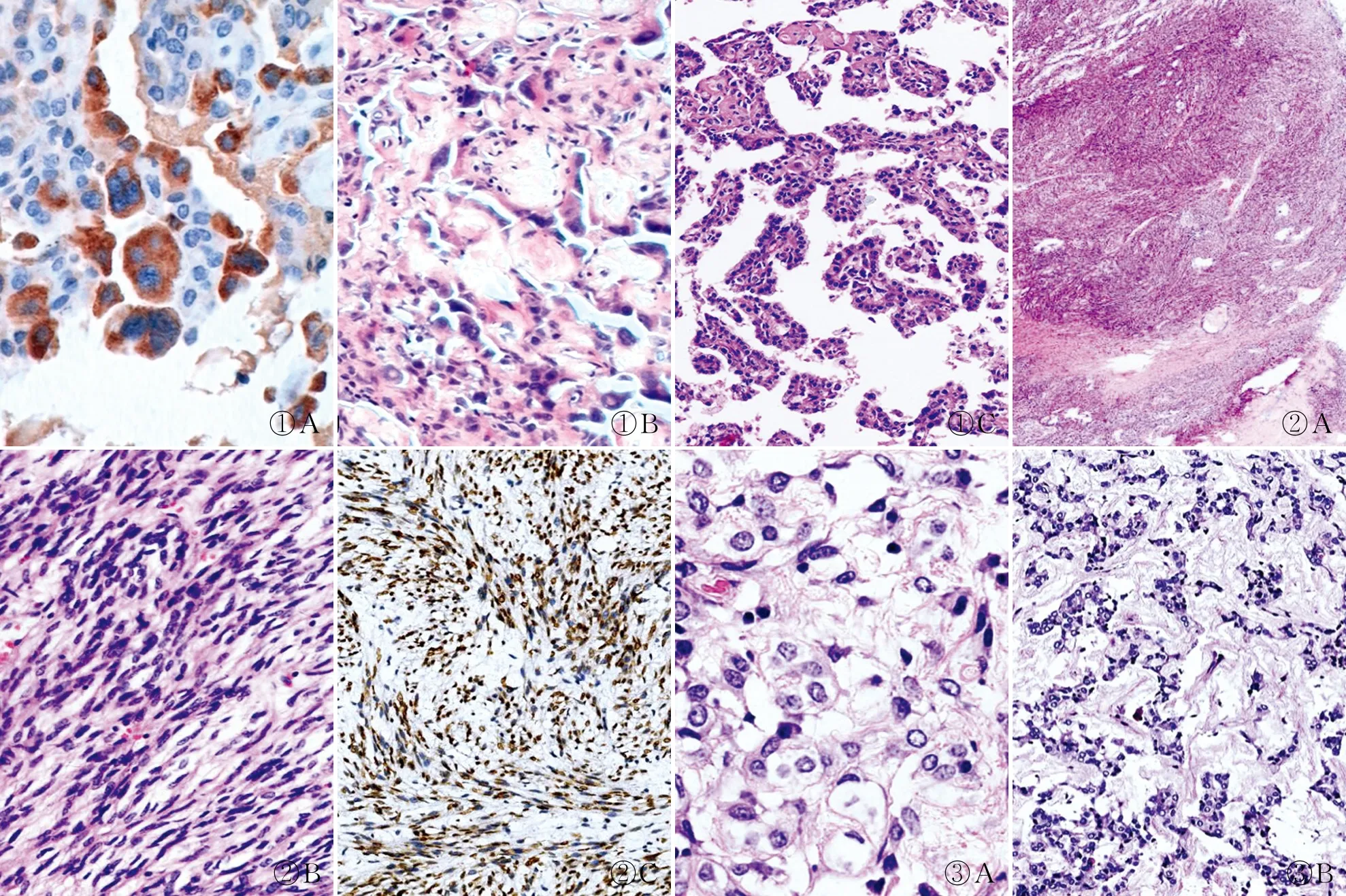
图1 A.多核瘤巨细胞位于细胞性乳头表面,多核,SP-B呈胞质阳性,SP法;B.较多的瘤巨细胞出现在硬化性乳头表面;C.穿刺活检材料中可见多数乳头状结构,缺少纤维血管轴心,模拟乳头或微乳头 图2 A.硬化性肺细胞瘤的实性区间质细胞梭形变,细胞密集,交错排列,类似软组织肿瘤;B.高倍镜下见细胞温和,短梭形,胞质淡染;C.梭形细胞TTF-1核阳性,SP法 图3 A.间质细胞弥漫分布,其胞质透明,部分细胞呈印戒样;B.基质广泛的黏液变,大量黏液样基质中漂浮着间质细胞混有少量表面细胞的“细胞条索”
2.2.3硬化性乳头 硬化性乳头是指乳头中的间质细胞成分明显减少而胶原沉积明显增多,乳头表面覆有表面细胞和(或)瘤巨细胞。46.98%(132/281)的硬化性肺细胞瘤病例中可见硬化性乳头,尤其是大范围的出现时,类似于炎性纤维化或机化性肺炎,甚至是乳头状腺癌的组织构象。
2.2.4间质细胞的梭形变 在少数情况下(32/281),间质细胞可发生局部、甚至是大范围的梭形变。梭形的瘤细胞呈束状、交错排列(图2A、B),其间少有内陷的立方上皮细胞。梭形变的间质细胞TTF-1阳性(图2C)。
2.2.5间质细胞透明变 硬化性肺细胞瘤的间质细胞多为圆形或椭圆形,胞质略嗜酸,一般无核仁或仅见小核仁。间质细胞的胞质有时呈透明状、空亮(28/281),甚至呈印戒样的改变(图3A)。
2.2.6间质广泛的黏液变 间质出现胶原沉积和硬化则有助于硬化性肺细胞瘤的诊断,但在少数情况下(8/281)间质可以发生广泛的黏液变,黏液变的间质成分将细胞成分(间质细胞和上皮细胞)挤压成条索状,漂浮在黏液样基质中,类似于伴黏液产生的上皮性肿瘤(图3B)。
2.2.7其它变异 本组有3例在腺样腔隙内出现大量的类似于肺泡蛋白沉积症样的蛋白样物质,18例出现类似于血管瘤或特发性含铁血黄素沉积症的含铁血黄素颗粒沉着,2例间质细胞中出现大量的肥大细胞,11例出现钙化和(或)骨化等。
2.3 硬化性肺细胞瘤与典型类癌共存本组发现1例典型的硬化性肺细胞瘤结构中混有典型的类癌成分,约各占1/2。类癌细胞温和,呈实性巢状分布,与硬化性肺细胞瘤成分混杂存在。神经内分泌标记(CD56)弥漫强阳性,而在硬化性肺细胞瘤中为阴性。
3 讨论
硬化性肺细胞瘤复杂的组织学结构既是我们诊断的依据,也给我们诊断带来了较大的困难。无论从硬化性肺细胞瘤的临床表现、影像学改变,还是病理诊断上均存在一定的误诊率,尤其是术中快速病理诊断和小活检的病理诊断始终都伴随着风险[7-8]。硬化性肺细胞瘤组织结构的多样性和各种变异又给病理诊断布下难以规避的陷阱。如多核瘤巨细胞[9]和硬化性乳头的出现,易与腺癌等混淆;间质细胞的广泛梭形变,易与各种梭形细胞构成的软组织肿瘤混淆[10];间质细胞的胞质有时呈透明状、空亮,甚至呈印戒样的改变,易与转移性肾透明细胞癌混淆;而间质出现广泛的黏液变时,与伴黏液产生的上皮性肿瘤等鉴别困难。因此,在掌握硬化性肺细胞瘤中的4种基本组织学结构、2种主要细胞的基础上,了解硬化性肺细胞瘤的各种变异,对正确诊断非常有帮助。当怀疑为硬化性肺细胞瘤,但组织结构和细胞形态又不典型时,快速冷冻病理诊断建议再次取材,穿刺小活检标本病理诊断时加做免疫组化标记,是防止误诊的最佳方法。认识和了解硬化性肺细胞瘤中各种组织结构和细胞形态变异,对提高诊断率非常重要。
硬化性肺细胞瘤可与其它恶性肿瘤如类癌、腺癌等同时发生在一个结节内[11-13]。尤其是当类癌与硬化性肺细胞瘤两种成分混杂存在时,温和的间质细胞类似于类癌细胞且部分硬化性肺细胞瘤间质细胞少量表达部分神经内分泌标记,如未进行充分的免疫组化标记,两者难以进行鉴别,应引起注意。
关于硬化性肺细胞瘤的性质是医学研究者共同关注的问题,同时也是颇有争议的话题。虽然硬化性肺细胞瘤肿块一般界限清楚但常缺少包膜,有时呈浸润性生长,侵及周围的组织甚至大血管[14],少数病例则为肺内多发,可发生淋巴结转移、骨转移[15-17]及胃转移[18]等。这部分病例不仅表现为具有恶性潜能的生物学行为,甚至有硬化性肺细胞瘤发生恶性转化的报道[19]。分子遗传学研究发现,部分硬化性肺细胞瘤病例中有p53[20]和高频率次AKT1基因的突变[21-22]。但无论是多发病灶间还是原发灶与转移灶之间,其形态学改变无明显差异,其基因的改变也尚无定论。
在硬化性肺细胞瘤中形态和免疫表型存在巨大差异的2种主要细胞均为肿瘤的实质细胞,目前已经得到了公认,且硬化性肺细胞瘤起源于原始呼吸道上皮细胞的观点也得到了广泛的认可。文献报道超微结构、免疫表型和干细胞标记都提示表面立方细胞的分化更为成熟,类似于成熟的Ⅱ型肺泡细胞,而间质细胞不仅形态多变并具有多向分化的潜能[23-24]。从转移灶内发现的转移细胞多为间质细胞,提示间质细胞的分化可能更不成熟。
