肺腺癌中HMGB1的表达及意义
2022-03-22王晓敏高增艳
王晓敏,高增艳
肺癌的发病率及病死率位居恶性肿瘤的首位,腺癌是肺癌最常见的组织学分型。尽管靶向药物已应用于临床治疗,但是非小细胞肺癌患者复发后5年生存率仍较低(约20%)[1],癌细胞转移是抗肿瘤治疗的主要难点。近年研究发现HMGB1在肝癌、卵巢癌等中高表达,并与肿瘤的侵袭和转移密切相关,上皮-间质转化(epithelial-mesenchymal transition, EMT)可以促进肿瘤的迁移和侵袭能力,HMGB1在肺腺癌中的表达及与EMT的关联尚不明确。因此,本文采用免疫组化法检测肺腺癌中HMGB1及EMT表型蛋白(E-cadherin、N-cadherin、vimentin)的表达,探讨两者的相关性,为临床治疗及预后评估提供理论依据。
1 材料与方法
1.1 材料收集2020年1~12月潍坊医学院附属益都中心医院手术切除的新鲜肺腺癌组织和癌旁正常肺组织20例。收集2019年1月~2020年6月潍坊医学院附属医院和潍坊医学院附属益都中心医院手术切除的肺腺癌组织90例和癌旁正常肺组织30例。临床病理资料包括患者年龄、性别、吸烟史、远处转移、淋巴结转移及TNM分期。所有患者术前均未行任何治疗。
1.2 试剂RNA稳定剂、Trizol试剂盒及Qiagen 74134 RNeasy Plus Mini Kit试剂盒,均购自北京中杉金桥公司。鼠抗人单克隆抗体E-cadherin(4A2C7)、N-cadherin(D-4)及vimentin(SP20),均购自福州迈新公司。鼠抗人单克隆抗体HMGB1(1D5),购自武汉艾美捷科技公司。
1.3 方法
1.3.1qRT-PCR 新鲜标本置于RNA稳定剂RNA later中2 ℃保存备用。RNA提取:用Trizol试剂提取组织中的总RNA,RNeasy Plus Mini Kit试剂盒纯化RNA。荧光染料嵌合法(SYBR Green I)和StepOnePlus qRT-PCR反应体系(美国应用生物系统公司)进行实时PCR检测。用2-ΔΔCt方法和GAPDH水平为基线对结果进行标准化校正处理。HMGB1引物序列:上游5′-TGTGCAAACTTGTCGGGAG-3′,下游5′-TCTTTCATAACGGGCCTTGTC-3′。
1.3.2免疫组化 将4 μm厚的肺腺癌组织切片烤制1 h,使用BenchMark XT全自动免疫组化染色机(美国罗氏)进行染色,脱水封固,光镜下判读。HMGB1、E-cadherin、N-cadherin和vimentin均设阴、阳性对照。
结果判定:E-cadherin、N-cadherin和vimentin阳性着色均定位于细胞膜及细胞质,HMGB1阳性着色定位于细胞核。(1)根据阳性细胞染色强度计分:未着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。(2)根据阳性细胞百分比计分:阴性为0分,<25%为1分,25%~50%为2分,51%~75%为3分,>75%为4分。上述两项得分之和即为肿瘤细胞的染色评分,其中0~4分为阴性,5~7分为阳性[2]。
1.4 统计学分析采用SPSS 17.0软件进行统计学分析,组间率的比较采用χ2检验;相关性分析采用Spearman相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 新鲜肺腺癌及配对正常肺组织中HMGB1 mRNA的表达新鲜肺腺癌组织中HMGB1 mRNA高表达13例(13/20, 65%);其在癌旁正常肺组织中低表达,肺腺癌组织中HMGB1 mRNA的相对表达水平高于癌旁正常肺组织,差异有统计学意义(P<0.05,图1)。
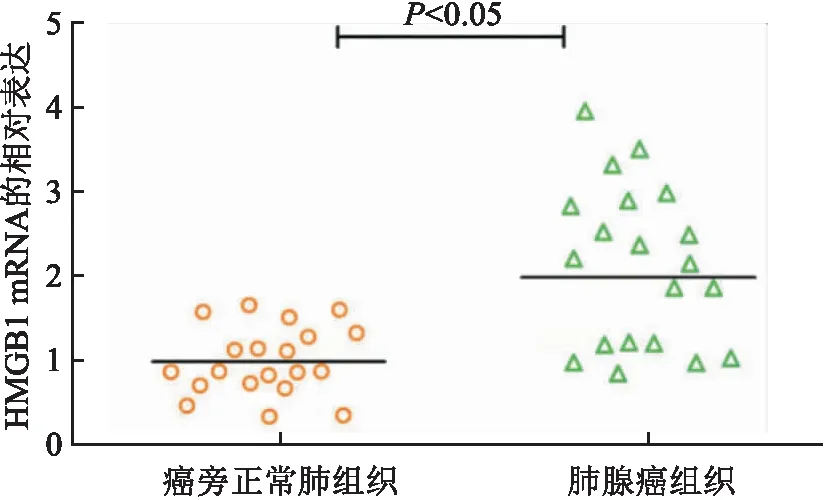
图1 肺腺癌组织和癌旁正常肺组织中HMGB1mRNA的相对表达水平
2.2 肺腺癌组织中E-cadherin、N-cadherin、vimentin及HMGB1蛋白的表达本组90例肺腺癌组织中vimentin阳性41例(41/90, 45.6%,图2A),阴性49例(49/90, 54.4%);E-cadherin阳性49例(49/90, 54.4%),阴性41例(41/90, 45.6%,图2B);N-cadherin阳性43例(43/90, 47.8%),阴性47例(47/90, 52.2%)。以E-cadherin和(或)N-cadherin阳性、vimentin阴性表征为上皮型,即EMT阴性;反之为间质型,即EMT阳性。本组肺腺癌组织中EMT的发生率为45.6%,癌旁正常肺组织EMT均阴性(0),差异有统计学意义(P<0.05)。肺腺癌组织中HMGB1阳性55例(55/90, 61.1%)(图2C),癌旁正常肺组织中HMGB1阳性6例(6/30, 20%),HMGB1在肺腺癌组织中的阳性率明显高于癌旁正常肺组织,差异有统计学意义(P<0.05)。
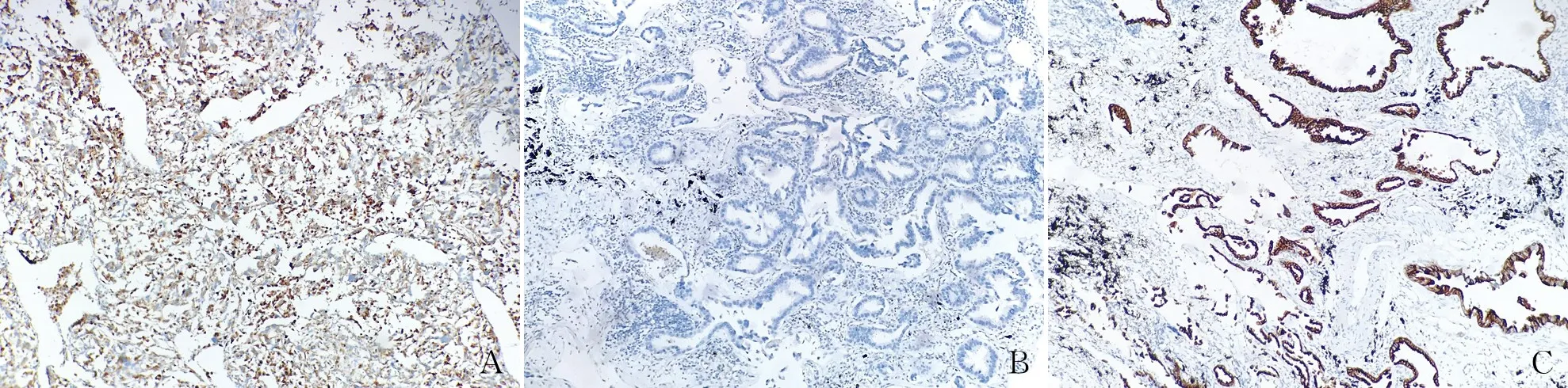
图2 肺腺癌组织中各蛋白的表达,EnVision法:A.vimentin阳性;B.E-cadherin阴性;C.HMGB1阳性
2.3 肺腺癌组织中EMT、HMGB1的表达与临床病理特征的关系肺腺癌组织中EMT发生率及HMGB1阳性率在TNM分期Ⅲ+Ⅳ期(59%)组高于Ⅰ+Ⅱ期组(32.6%);有淋巴结转移组(62.9%)高于无淋巴结转移组(34.5%);有远处转移组(60.6%)高于无远处转移组(36.8%),差异均有统计学意义(P均<0.05)。EMT发生率及HMGB1阳性率与患者性别、年龄和有无吸烟史均无相关性(P均>0.05,表1)。
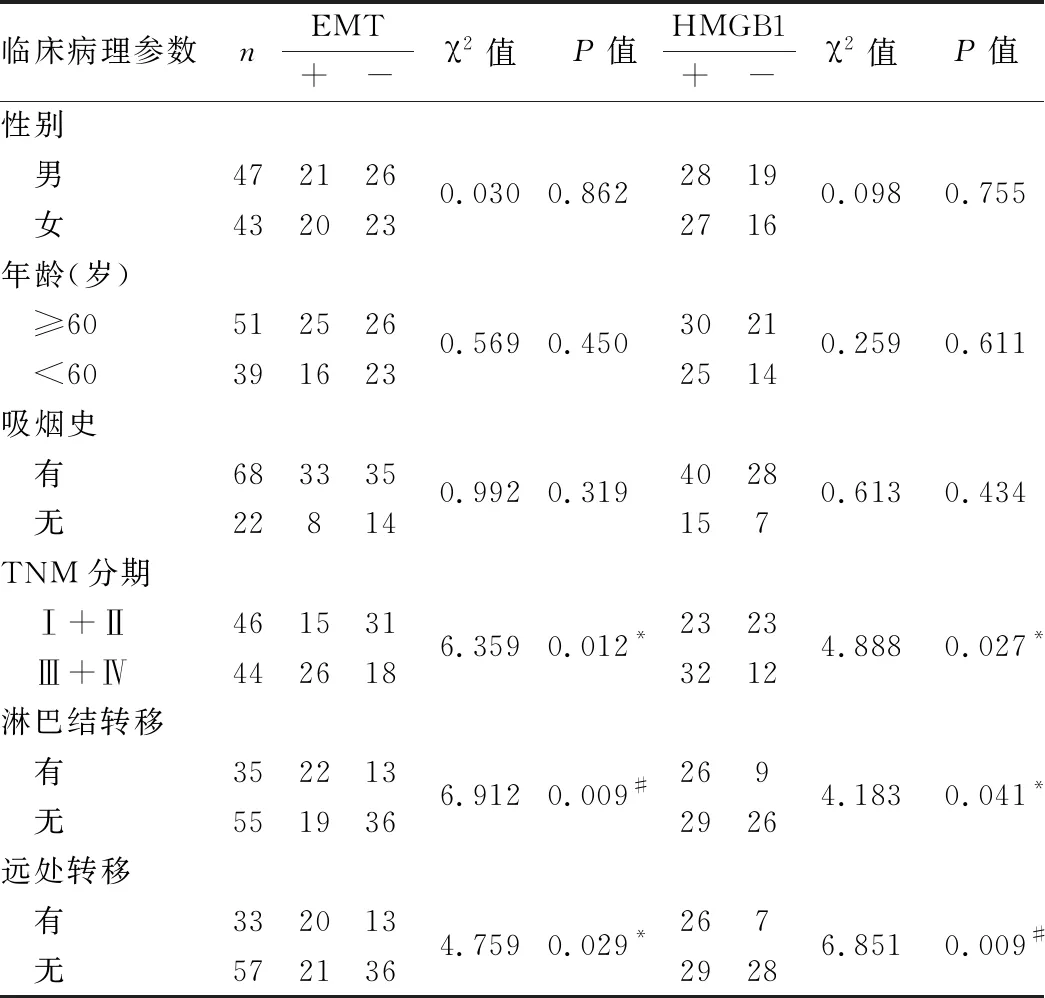
表1 肺腺癌中EMT、HMGB1与临床病理特征的关系
2.4 HMGB1表达与EMT的相关性Spearman相关性分析显示,肺腺癌组织中HMGB1表达与EMT之间具有相关性(χ2=4.608,P1=0.032,r=0.226,P2=0.032),提示两者呈正相关(表2)。

表2 HMGB1表达与EMT的相关性
3 讨论
目前,分子靶向治疗已成为非小细胞肺癌的一线治疗方法,其中应用最广泛的是EGFR-TKIs,患者无进展生存期明显延长,但仍有20%的EGFR突变患者对靶向药物存在原发性耐药[3]。近年研究发现,非小细胞肺癌细胞发生EMT与EGFR-TKIs耐药密切相关,EMT是一个复杂的分子过程,是细胞从上皮细胞转化为间充质状态的过程,动物的许多生理和病理过程均与EMT有关,涉及非常复杂的信号通路。EMT细胞不仅具有形态特征,而且在蛋白表达上也有变化,如细胞黏附分子E-cadherin和N-cadherin表达降低,Ⅲ型中间丝蛋白vimentin等表达增加,导致细胞间的黏附力降低,从而促进肿瘤组织发生EMT,肿瘤细胞获得侵袭和迁移能力[4]。恶性胸腔积液中非小细胞肺癌细胞也具备EMT表型,进一步从细胞学角度证实EMT现象存在于非小细胞肺癌[5]。本组实验数据显示,EMT在肺腺癌中的发生率为45.6%,而且在TNM分期(Ⅲ+Ⅳ期)、有淋巴结转移及远处转移组的发生率分别为59%、62.9%和60.6%,显著高于Ⅰ+Ⅱ期、无淋巴结转移及无远处转移组(32.6%、34.5%和36.8%),提示EMT是促进肺腺癌侵袭及转移的作用因素之一。
肿瘤细胞的EMT表型不是固定不变的,非小细胞肺癌经过烷化类化疗药物治疗后可诱导EMT发生,从而导致EGFR-TKIs继发性耐药。有研究表明,非小细胞肺癌细胞系上皮表型恢复后,原本耐药的细胞重获EGFR-TKIs的敏感性[6-8]。越来越多的研究结果证实EMT是EGFR-TKIs获得性耐药机制之一。大量研究表明,导致EMT的因素较多,包括肿瘤微环境、信号通路激活及表观遗传调控等[9-15]。目前,其已成为肺癌靶向治疗耐药研究领域中的热点。
HMGB1是调节基因转录和基因修复的非组蛋白,是高迁移率组蛋白的主要成员之一,在细胞核、细胞质和细胞外环境中有许多生物学功能,并在多种疾病中发挥重要作用,特别是炎症性疾病和癌症。本组前期研究发现,在慢性阻塞性肺疾病急性加重患者的外周血中HMGB1的表达水平显著升高,但是HMGB1在肺腺癌中的表达及临床意义的相关研究较少。国内外研究显示,HMGB1在乳腺癌、子宫内膜癌和膀胱尿路上皮癌等恶性肿瘤中过表达[16-18],且对预后有不良影响。HMGB1表达上调可促进细胞增殖,表达下调可促进细胞凋亡,影响细胞迁移[19-21]。本组结果显示,HMGB1在肺腺癌中过表达,在正常肺组织中较少表达,且在高临床分期、有淋巴结转移及远处转移的肺腺癌患者中呈HMGB1高表达率,提示HMGB1表达与肺腺癌的转移和侵袭有密切的关系。
肿瘤组织上皮表型蛋白丢失、转录因子表达和信号传导通路活化开启等均可引起EMT发生。国内外研究显示,HMGB1在促进鼻咽癌、肝癌、卵巢癌等多种肿瘤发生EMT中发挥重要作用。TGF-β诱导咽癌FaDu细胞发生EMT时,HMGB1在此过程中维持细胞间质表型,而HMGB1沉默表达可显著抑制上述细胞的侵袭和转移能力[22]。Liu等[23]研究发现HMGB1基因敲除可明显抑制Huh7和MHCC97H肝癌细胞EMT,迁移和侵袭能力显著降低。王真等[24]通过体外细胞实验发现,HMGB1可能通过激活Snail/NF-κB信号通路诱导卵巢癌Skov3细胞的EMT。目前,国内尚未见HMGB1对肺腺癌实体肿瘤组织中发生EMT作用的研究,本实验应用免疫组化法检测肺腺癌组织中EMT表型蛋白及HMGB1蛋白的表达,发现HMGB1表达与EMT呈正相关,提示HMGB1过表达可能会诱导肺腺癌由上皮表型向间质表型转化。
综上所述,HMGB1在肺腺癌组织中过表达,与EMT相关,进而增强肿瘤侵袭和转移能力。HMGB1过表达在肺腺癌进展中具有重要作用,可能是重要的预后因素,为肺癌的临床研究和治疗提供新的理论依据。HMGB1高表达是否能促进肺腺癌EMT的发生,仍需进一步实验加以验证。
