食管鳞状细胞癌中SNORA71B的表达及其与临床病理特征的关系
2022-03-22沈素朋郭艳丽董稚明
沈素朋,梁 佳,刘 磊,郭 炜,郭艳丽,董稚明
食管癌是消化系统常见的恶性肿瘤,我国食管癌主要以食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)为主,由于缺少可靠的早期诊断标志物和抑制肿瘤转移的治疗靶标,中、晚期患者的5年生存率较低[1-2]。核仁小RNA(small nucleolar RNA, snoRNA)是指长度60~300个核苷酸长的RNA分子,具有复杂的一级和二级结构[3-4]。研究发现snoRNA与肿瘤的发生、发展、侵袭、转移及术后复发关系密切[4-6]。核仁小RNA 71B(SNORA71B)位于人类染色体20q11.23,其在ESCC中的表达及功能尚未见报道。本文检测SNORA71B在人ESCC细胞系及组织中的表达,分析其与ESCC临床病理特征及预后的关系,旨在为ESCC的靶向治疗及预后评估提供参考。
1 材料与方法
1.1 临床资料收集2014年4月~2015年9月河北医科大学第四医院诊治的ESCC手术患者75例,术前均未接受放、化疗。另收集癌旁正常组织(3~5 cm)作对照。收集1份新鲜组织置于-80 ℃低温冰箱保存,提取总RNA;1份组织制成蜡块用于HE染色观察组织形态。随访75例ESCC患者,最长随访时间为65个月。本实验经我院伦理委员会批准,患者均签署知情同意书。
1.2 细胞株及主要试剂食管癌细胞系TE1、TE13、Eca109、Kyse150由河北医科大学第四医院肿瘤研究所病理研究室留存并传代;Trizol购自SBS公司;胎牛血清购自PAN公司;RPMI 1640培养基购自Gibco公司;Lipofectamine 2000购自Thermo公司;逆转录试剂盒、MTS试剂购自Promega公司;Transwell小室、Matrigel胶购自Corning公司。
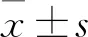
1.3 总RNA提取以及qRT-PCR检测SNORA71B基因的表达根据Trizol试剂盒说明书提取总RNA,将其反转录成cDNA,再以cDNA为模板进行。应用qRT-PCR进行扩增,用于检测SNORA71B基因的表达,上游引物:5’-GAGAGGAAT CAATGAAAGCGCT-3’,下游引物:5’-GCATGTAC GAAAGCTCCAGAGTT-3’,片段大小为81 bp,反应条件:95 ℃预变性10 min后;95 ℃变性15 s、60 ℃退火30 s、72 ℃延伸30 s,合计40个循环;72 ℃延伸7 min,SNORA71B基因以GAPDH作为内参,每个样本设3个复孔。根据每孔荧光信号达到阈值时经历的循环数作为Ct值,采用相对定量法,以N=2-ΔΔCt表示目的基因的相对表达量,其数值表示癌组织相对于配对癌旁正常组织的相对倍数。
1.4 特异性shRNA的构建、细胞培养及转染2条shRNA-SNORA71B由上海吉玛基因公司设计合成,分别命名为sh1-SNORA71B和sh2-SNORA71B另附送sh-NC(转染空质粒的对照组)作为对照。细胞系常规培养于含10%FBS的RPMI 1640培养基,置于37 ℃ 5%CO2的条件下培养。转染前一天选择生长状态良好的细胞均匀铺于6孔板内,细胞一般长至70%开始转染,利用Lipofectamine 2000转染试剂盒分别将4条shRNA-SNORA71B及sh-NC转染至食管癌细胞Eca109中,6 h后更换含血清培养基继续培养,培养24 h,并用荧光倒置显微镜观察各组的转染效率,提取各组细胞总RNA,用于观察转染4条shRNA-SNORA71B后mRNA的表达水平,选取干扰效率最高的shRNA-SNORA71B进行后续功能试验。
1.5 MTS实验检测SNORA71B表达对细胞增殖的影响转染细胞培养24 h后用胰酶消化悬浮于含10%胎牛血清的培养基中,调整细胞浓度接种于96孔板,每孔100 μL培养基含有1 000个细胞。分别在细胞贴壁后0、24、48、72、96 h每孔中加入MTS试剂20 μL(500 μg/mL),孵育4 h后酶标仪测定492 mm处的吸光度值。每组实验设6个复孔,实验重复3次。
1.6 Transwell小室侵袭实验检测SNORA71B表达对细胞侵袭的影响将Matrigel胶稀释后,向小室上层加入50 μL稀释的Matrigel胶,37 ℃过夜。细胞首先使用无血清培养基饥饿24 h,胰酶消化并收集细胞,无血清培养基重悬细胞并调整细胞浓度为每毫升1×105个细胞,每孔上室加入200 μL细胞悬液,下室加入600 μL含20%胎牛血清的完全培养基。常规培养24 h后取出小室,PBS冲洗3次。染色固定,将小室上的聚碳酸酯膜轻轻剪下,放于载玻片上,树脂封固。显微镜下计数5个随机视野内的细胞数,比较各组穿膜细胞数判断细胞的侵袭性。实验重复3次。
2 结果
2.1 ESCC组织及食管癌细胞中SNORA71B基因的表达首先应用SNORic(http://bioinfo.life.hust.edu.cn/SNORic)在线数据分析网站分析SNORA71B在食管癌中的表达及其对患者生存期的影响,结果发现SNORA71B在癌组织中的表达高于癌旁正常组织(图1A),SNORA71B高表达组患者的5年生存率低于低表达组(图1B)。
本组检测SNORA71B基因在75例ESCC组织及相应癌旁组织中的表达,结果显示SNORA71B基因在ESCC组织中的相对表达量(3.242±1.074)明显高于癌旁正常组织(1.212±0.470)(P<0.01,图1C)。结合临床病理资料发现SNORA71B基因表达与ESCC淋巴结转移、分化程度、浸润深度和TNM分期相关(P<0.05,表1)。
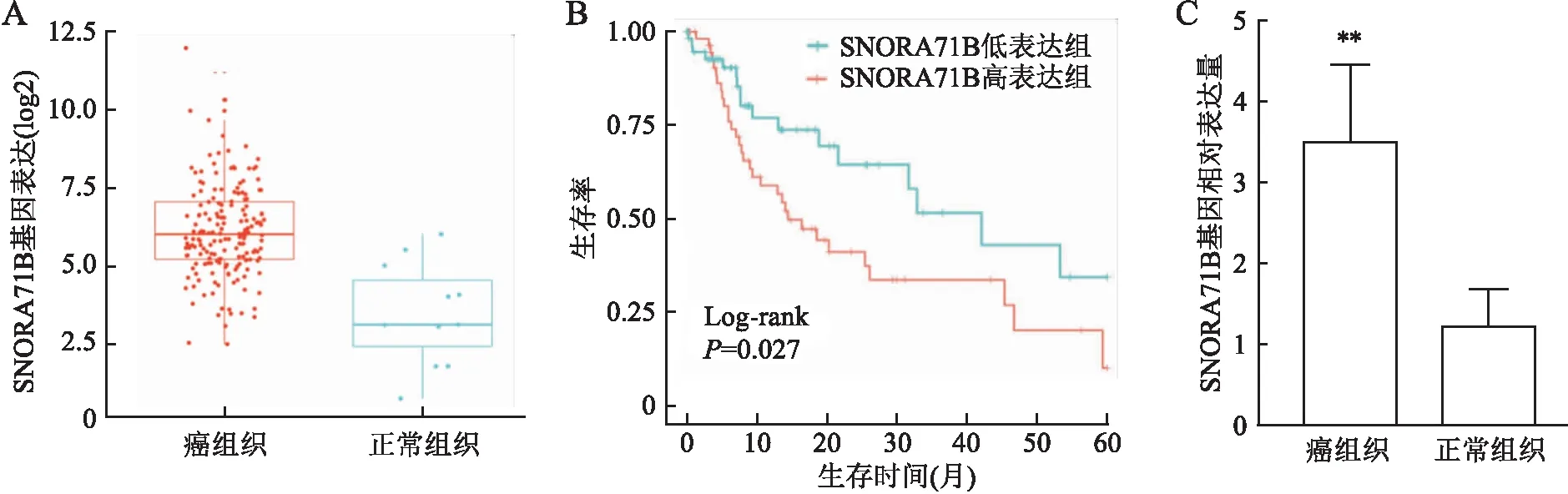
图1 不同食管组织中SNORA71B基因的表达:A.SNORic网站预测SNORA71B基因在食管癌及正常黏膜中的表达;B.SNORic网站预测SNORA71B表达对食管癌患者生存期的影响;C.75例食管鳞状细胞癌组织及癌旁正常组织中SNORA71B基因的相对表达量, **P<0.01
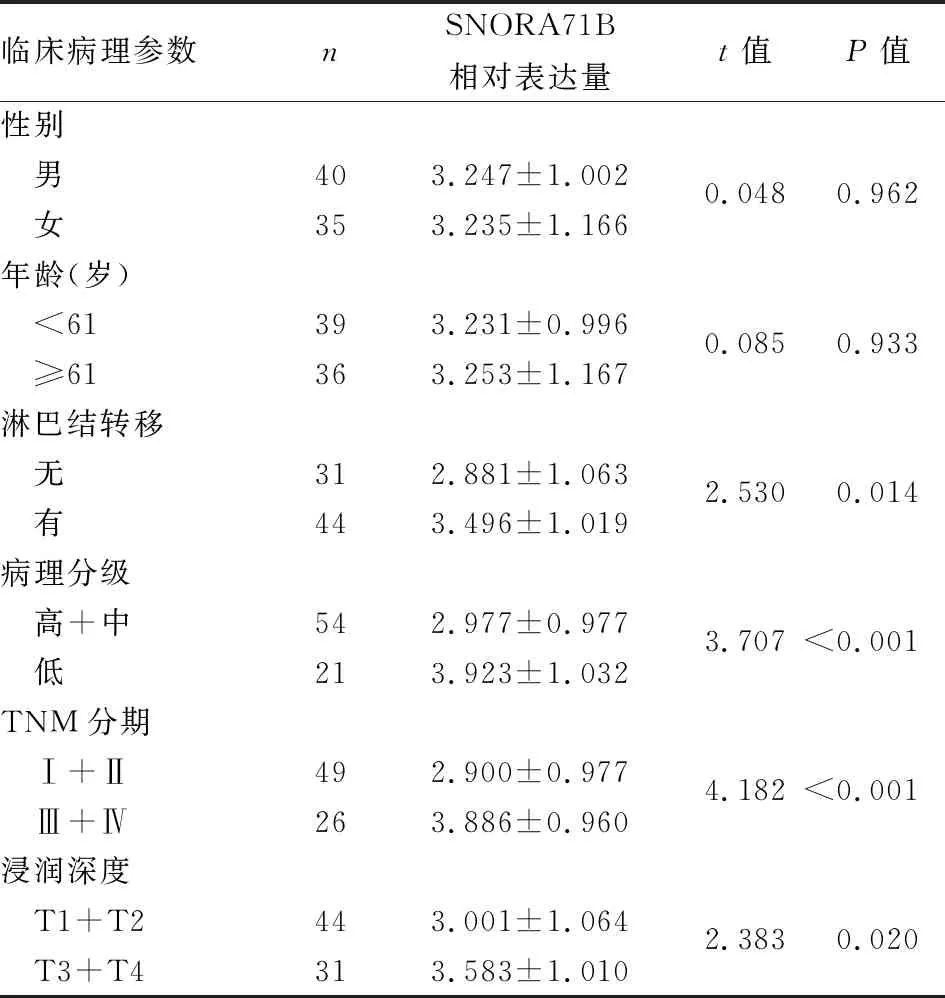
表1 食管鳞状细胞癌中SNORA71B的表达及与临床病理特征的关系
2.2 SNORA71B基因与ESCC患者预后的关系根据SNORA71B在ESCC组织中表达的均值将患者分为SNORA71B高表达组和低表达组,其中高表达组36例,低表达组39例。SNORA71B高表达组患者的5年生存率为12.3%(中位生存时间23个月),低表达组患者的5年生存率为25.7%(中位生存时间35个月)。经Log-rank检验分析显示,SNORA71B高表达可缩短ESCC患者的生存期(P<0.01,图2);为排除混杂因素对实验结果的影响,多因素Cox回归分析发现,SNORA71B基因表达可能是ESCC患者的独立预后危险因素(表2)。
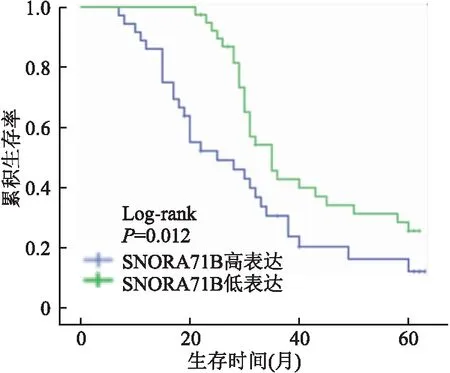
图2 SNORA71B表达与食管鳞状细胞癌患者预后的关系
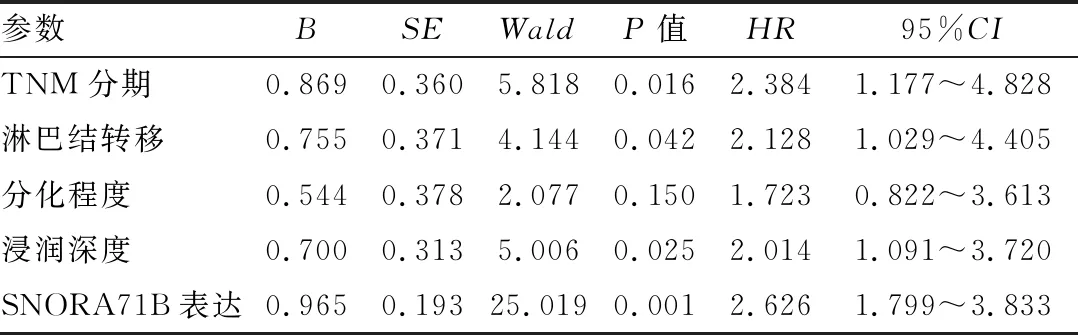
表2 多因素Cox回归分析食管鳞状细胞癌患者预后的危险因素
2.3 食管癌细胞株中SNORA71B的表达及对Eca109细胞增殖及侵袭的影响应用qRT-PCR检测结果显示,SNORA71B基因在4株食管癌细胞中的相对表达量(Eca109:2.36±0.21、Kyse150:1.67±0.21、Kyse170:1.46±0.19、TE1:1.36±0.10)高于对照组(1.04±0.08),差异均有统计学意义(P<0.05,图3A),在Eca109细胞中表达最高。
本组在SNORA71B表达最高的Eca109细胞中进行细胞功能实验,转染2个针对SNORA71B设计的shRNA;应用qRT-PCR法检测SNORA71B的敲低效率(sh1:0.41±0.04,sh2:0.65±0.04)。其中,sh1-SNORA71B的敲低效率最高,选其进行后续实验(P<0.01,图3B)。
MTS实验结果显示,48 h后sh1-SNORA71B组与对照组相比,其能够显著抑制食管癌细胞的增殖能力,差异有统计学意义(48 h:0.414±0.043vs0.319±0.037、72 h:0.540±0.057vs0.377±0.043、96 h:0.759±0.057vs0.537±0.059,P<0.05,图3C)。上述结果提示敲低SNORA71B基因,可以抑制食管癌细胞系Eca109的体外增殖能力。
Transwell小室侵袭实验结果显示,与对照组细胞穿膜数比较,sh1-SNORA71B组的穿膜细胞数显著减少,差异有统计学意义(268.33±20.82vs223.00±6.08,P<0.05,图3D),提示敲低SNORA71B基因后可以抑制食管癌细胞系Eca109的体外侵袭能力。
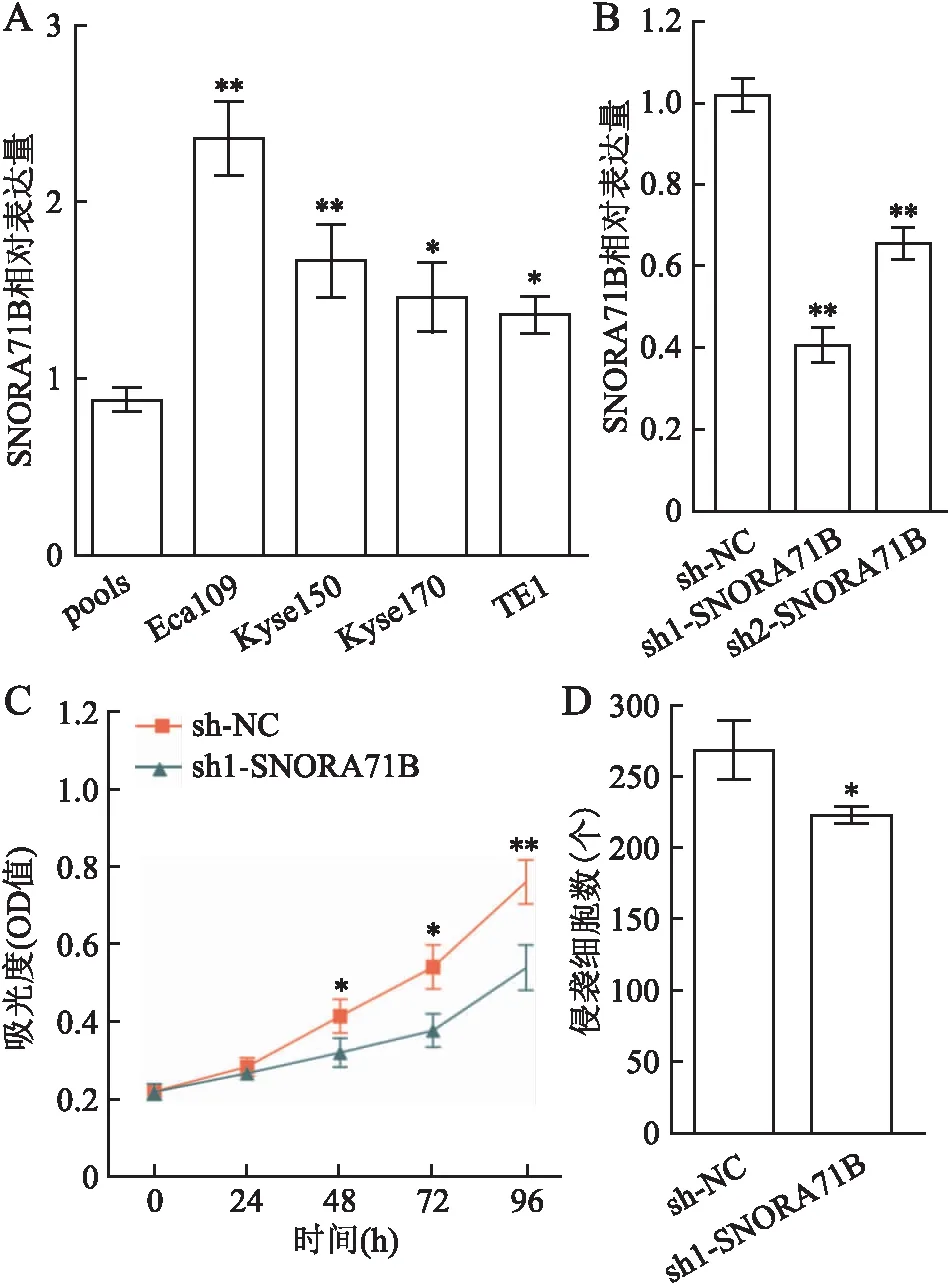
图3 SNORA71B在食管癌细胞中的表达及其对Eca109细胞增殖及侵袭能力的影响:A.SNORA71B在4种食管癌细胞株中的表达水平;B.qRT-PCR法检测Eca109细胞中sh-RNAs的沉默效果;C.MTS检测SNORA71B对Eca109细胞增殖能力的影响;D.Transwell侵袭实验检测SNORA71B对Eca109细胞侵袭能力的影响;pools.按等比例随机混合10例食管正常黏膜组织的cDNA;sh-NC.转染空质粒的对照组;*P<0.05,**P<0.01
3 讨论
snoRNA是一类广泛分布于真核生物细胞核仁的小分子非编码RNA,最初发现其在调节rRNA的假尿苷中起作用[7]。随着高通量测序技术的发展,越来越多的snoRNA被发现、鉴定,越来越多的结果显示snoRNA表达失调与各种恶性肿瘤的肿瘤发生相关[8-10],其在多种恶性肿瘤中发挥抑癌或致癌的作用。如SNORD126基因在肝细胞癌中起致癌作用,SNORD126过表达增加AKT、GSK-3β和p70S6K的磷酸化水平,并提高成纤维细胞生长因子受体2(fibroblast growth factor receptor 2, FGFR2)的表达[11]。SNORD89通过调节Notch1-c-Myc途径促进肿瘤细胞干性并在卵巢癌发生中充当癌基因,从而使卵巢癌患者预后不良[12]。
SNORA71B是由SNHG17的内含子剪接而来,主要在细胞核中表达,位于染色体20q11.23,其在多种恶性肿瘤中有基因拷贝数的异常扩增[13-15]。2017年Schulten等[16]通过分子探针技术鉴定SNORA71B在乳腺癌脑转移中过表达。2020年Duan等[17]研究发现SNORA71B在脑转移的乳腺癌中高表达,且其高表达与患者预后不良密切相关,同时SNORA71B可通过诱导上皮-间质转化促进乳腺癌细胞跨过血脑屏障进行转移。Wu等[18]研究发现lncRNA SNHG17通过正反馈回路调节其同源物SNORA71B表达上调,从而加重前列腺癌的进展。以上结果提示SNORA71B可能参与恶性肿瘤的进程。本组分析在线网站SNORic中SNORA71B在食管癌的表达及与其预后关系,结果发现SNORA71B在ESCC组织中的表达高于癌旁正常组织,生存分析发现SNORA71B高表达组患者的5年生存率显著低于其低表达组。本组检测75例ESCC及癌旁正常组织中SNORA71B的表达,分析SNORA71B表达与临床病理特征的关系,结果显示SNORA71B基因在ESCC组织中表达高于癌旁正常组织,SNORA71B表达水平与淋巴结转移、分化程度、浸润深度及TNM分期相关。
本组结果显示,SNORA71B高表达明显缩短ESCC患者的生存期,与不良预后密切相关。采用多因素Cox回归模型进行分析,发现SNORA71B高表达可作为ESCC患者的独立预后因素。本组通过RNA干扰技术将sh-SNORA71B成功转染至食管癌细胞Eca109中,结果显示SNORA71B基因敲低后可抑制Eca109细胞增殖能力及侵袭能力。以上结果均提示SNORA71B基因在ESCC中可能发挥促癌作用。
总之,本实验结果显示SNORA71B基因在ESCC组织中表达升高,其高表达与不良预后密切相关。特异性的敲低SNORA71B基因表达,可抑制食管癌细胞的增殖及侵袭能力,提示SNORA71B基因可能在ESCC中发挥促癌作用,同时在ESCC恶性进程中发挥重要的调控作用,有望成为ESCC生物学标志物。
