二代测序技术检测650例非小细胞肺癌驱动基因突变
2022-03-22伍潇怡陈颖玮何章勇黄维纲王雪亮
赵 冉,伍潇怡,陈颖玮,何章勇,罗 鹏,黄维纲,王雪亮
肺癌是全球发病率及病死率最高的恶性肿瘤[1-2],其分子遗传学具有较强的异质性[3-4]。非小细胞肺癌(non-small cell cancer, NSCLC)约占肺癌总数的85%,是我国肺癌的主要病理类型,其5年生存率较低[5]。NSCLC的发生、发展与EGFR等一系列驱动基因变异有关[6]。二代测序(next-generation sequencing, NGS)技术可同时检测多样本、多基因、多位点突变信息,可较全面地指导肺癌患者个体化治疗或进一步发现新的基因突变,辅助肿瘤发病机制研究,已被越来越多地应用于临床[7-9]。然而,不同研究结果中NSCLC基因突变位点及频率存在差异,现有文献多为对西方人群的报道[4,10],其与我国人群基因突变情况不同[11]。此外,越来越多的NSCLC多基因突变共存情况被发现[12]。本实验通过NGS技术检测650例NSCLC中15种肺癌相关驱动基因突变情况,进一步明确中国人群驱动基因突变特征,为NSCLC的精准诊疗提供帮助。
1 材料与方法
1.1 临床资料收集2019年6月~2020年7月上海鼎晶生物医药公司医学检验实验室650例NSCLC标本,均经福尔马林固定石蜡包埋(formalin fixed and paraffin embedded, FFPE)保存。650例患者中男性353例(54.31%),女性297例(45.69%),年龄28~94岁,中位年龄65岁,平均(64.4±10.4)岁。本实验在上海市临床检验中心伦理委员会指导下进行,所有患者均知情同意。
1.2 NGS测序及分析采用QIAamp DNA FFPE Kit(德国Qiagen公司)对所有研究样本进行DNA提取,具体操作步骤严格按试剂盒说明书进行。对提取成功的DNA使用Qubit dsDNA HS Assay Kit(美国Thermo Fisher公司)试剂盒及Qubit 4.0荧光定量仪检测浓度,采用聚丙烯酰胺凝胶电泳检测DNA降解程度。
使用Rapid DNA Lib Prep Kit for Illumina(武汉爱博泰克公司)试剂盒构建含目标基因的全基因组文库,建库过程中使用UMI接头保证数据结果的准确性,使用液相探针进行杂交捕获,确保文库的高均一性及高捕获效率。使用Qubit dsDNA HS Assay Kit(美国Thermo Fisher公司)对捕获文库进行定量。
使用Illumina HiSeq X Ten测序仪(美国Illumina公司)进行靶向NGS测序。测序原始数据经过滤后,进行生物信息学分析。以GRCh37/hg19为参考序列,分析的基因包括:ALK、BCL2L11、BRAF、EGFR、ERBB2、FGFR、KRAS、MAP2K1、MET、NRAS、NTRK、PIK3CA、RET、TP53、ROS1;检测分析覆盖的区域为全部热点外显子(exon)区域以及部分基因内含子;检测基因变异类型包括点突变、插入缺失变异、融合变异、拷贝数变异等。检测变异丰度1%及以上的基因变异判定为阳性。
1.3 统计学方法采用SPSS 17.0软件对数据进行统计学分析。组间比较采用t检验或χ2检验,基因突变数、突变位点数、突变频率等计数资料采用例数或率(百分比)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC驱动基因突变在650例NSCLC标本中,252例(38.77%)未检测出基因突变,398例(61.23%)检测有至少1个基因突变,包括274例(42.15%)单个基因位点突变的患者及124例(19.08%)携带2个及以上基因突变位点的患者,分别占检测有基因突变患者的68.84%及31.16%。
本组检测共有566个突变位点,突变频率最高的3种基因为EGFR(67.65%)、KRAS(9.22%)和PIK3CA(4.52%)(图1)。所有检测有突变的样本中,BCL2L11基因突变者10例,均为intron2 del(缺失); ALK基因突变者6例,3例为EML4-ALK融合,其余3例分别为exon 19 P1029S、exon 20 R1084L及exon 23 S1206Y位点突变。
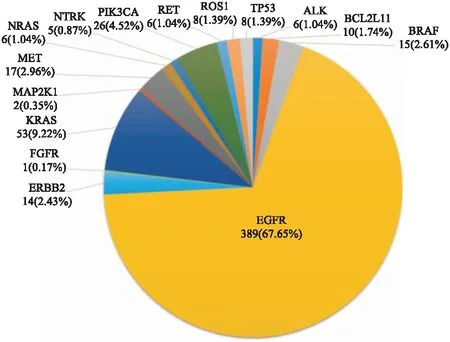
图1 非小细胞肺癌中各基因突变位点分布
2.2 EGFR基因突变在650例NSCLC患者中313例(48.15%)检测有EGFR基因突变,包括250例(38.46%)仅携带1个EGFR突变位点的患者,51例(7.85%)携带2个EGFR突变位点的患者,11例(1.69%)携带3个EGFR突变位点的患者,1例(0.15%)携带4个EGFR突变位点的患者。其中携带≥2个EGFR突变位点的患者合计63例,占NSCLC的9.69%,占EGFR突变的20.13%。
统计学分析:81.5%的EGFR突变为热点突变,包括L858R(33.93%)、exon 19del(33.16%)、T790M(12.08%)和exon 20ins(2.31%)。其余18.52%的EGFR突变包括24种不同的位于EGFR基因其他外显子或结构域上的位点,如位于胞外区域exon 3上的R108I和N110H突变(1.02%)、exon 7上的E282K和A289V突变(1.55%)以及激酶区域exon 18上的G719A/C/S突变(3.34%)、exon 21上的L861Q/R(1.80%)、exon 20上的C797S(0.77%)突变等(表1)。

表1 非小细胞肺癌中EGFR突变位点
2.3 EGFR基因与其他基因共突变除EGFR基因突变之外,本实验中还检测有170例(26.15%)NSCLC携带其他14种基因突变,频率较高的有KRAS、PIK3CA、MET、ERBB2、BRAF等;其中38.24%(65/170)的患者合并有EGFR突变(表2)。
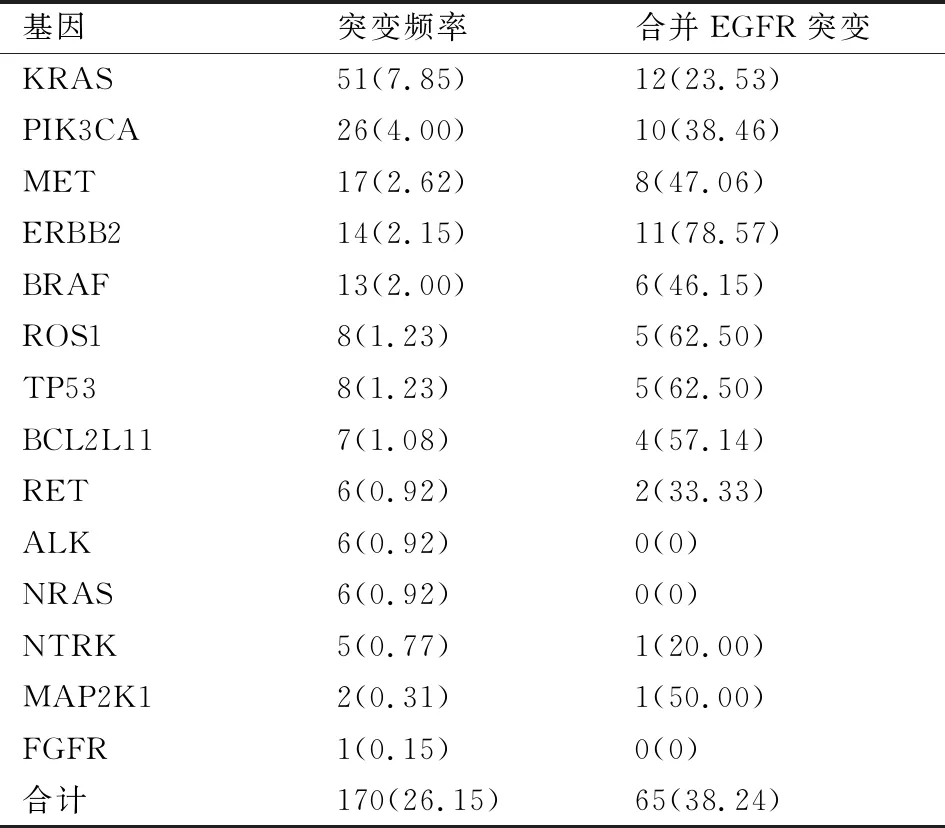
表2 其他基因突变频率及合并EGFR基因突变[n(%)]
本实验检出313例EGFR突变患者中,56例合并其他基因突变,占EGFR突变患者的17.89%,占NSCLC的8.62%。其中48例为EGFR合并另1种基因共突变,7例为EGFR合并其他2种基因共突变,1例为EGFR合并其他3种基因共突变(表3)。
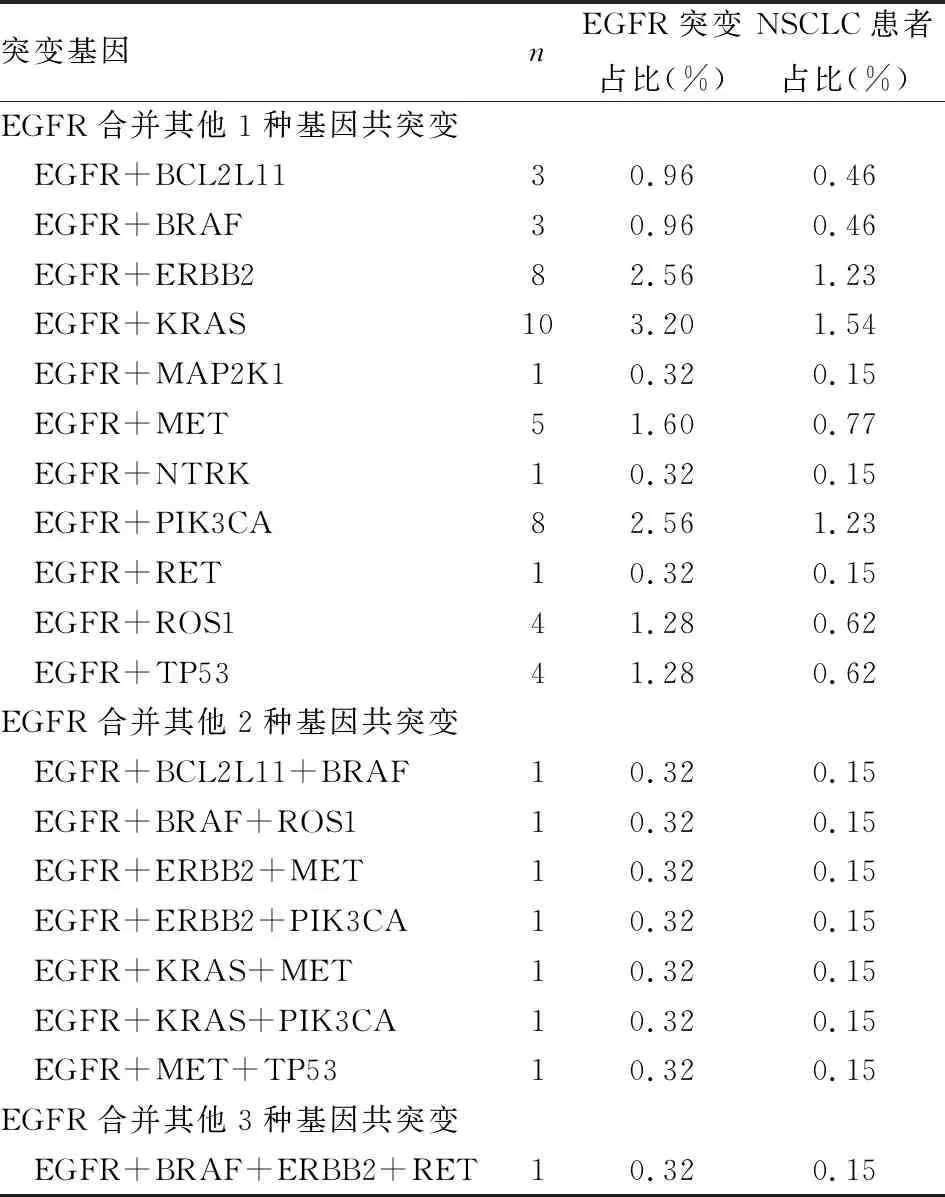
表3 EGFR基因合并其他基因突变
2.4 NSCLC中驱动基因突变与临床病理特征的关系本实验中女性NSCLC患者发生驱动基因突变的比例高于男性,差异有统计学意义(P<0.05)。腺癌患者发生驱动基因突变的比例明显高于鳞状细胞癌患者,腺癌中携带基因突变的患者(67.24%)高于无基因突变的患者(32.76%),鳞状细胞癌中无基因突变的患者(64.1%)高于携带基因突变的患者(35.9%),差异有统计学意义(P<0.05)。鳞状细胞癌患者中检测有14例(35.90%)携带基因突变:1例ERBB2单一突变,1例ROS1单一突变,1例BRAF单一突变,1例PIK3CA单一突变,7例EGFR单一突变,1例发生3处EGFR基因突变,1例EGFR合并BCL2L11基因突变,1例EGFR、ERBB2、PIK3CA三基因共突变。5例腺鳞癌患者中检测有1例携带KRAS基因突变。此外,本实验中不同年龄组间驱动基因突变率差异无统计学意义(P>0.05,表4)。
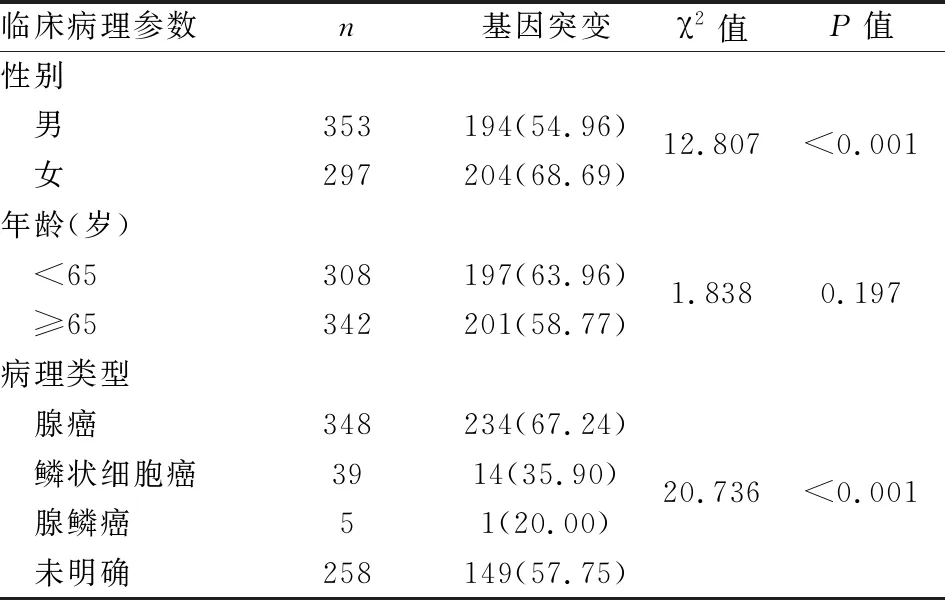
表4 不同分组间驱动基因突变情况比较[n(%)]
3 讨论
我国每年约40万人死于肺癌,多数患者在确诊时已处于晚期,失去手术机会。肺癌的诊断及分型需要综合临床、病理、影像、分子生物学等多学科信息,以寻求精准诊疗方案。其中,分子生物学检测对提高NSCLC的早期诊断率、改善患者预后具有重要意义,如EGFR、ALK、ROS1等作为重要的肺癌基因靶点已得到广泛认同[11,13]。因此,NSCLC的治疗策略已逐渐从传统的以肿瘤分期为基础的方法,转变为以组织形态学和基因突变引导的靶向治疗[13-14]。
近年NGS已逐步应用于临床,为NSCLC的早期诊断及精准药物治疗提供更可靠的理论和实验依据。一项对22例晚期NSCLC患者的多基因靶向NGS结果显示,TP53、EGFR、KRAS等基因突变最常见[15]。有国内研究结果显示,EGFR、TP53、KRAS在29例肺腺癌中的突变率位居前3位[16]。本研究NSCLC患者中突变频率最高的3种基因为EGFR、KRAS和PIK3CA,而TP53的突变频率仅为1.39%,在NGS检测15种基因结果中突变频率排第8位,低于文献报道[15-16]。
EGFR突变在NSCLC基因分型中具有代表性,发生突变的位点个数最多,在本实验结果中占67.65%。本组NSCLC患者中EGFR突变频率为48.15%,远高于已报道的西方NSCLC群体中的10%~35%[4,10,15]。除L858R、exon 19del、T790M、exon 20ins等热点突变外,本实验还发现24种不常见的EGFR突变,占EGFR突变的18.52%;在6例ALK突变中,除3例EML4-ALK融合外,还发现3例其他不同位点突变。上述结果均提示中国NSCLC患者基因突变特征的不同。此外,本实验选取6例NGS检测EGFR基因未突变及9例EGFR突变的样本进行exon 18、exon 19、exon 20、exon 21热点突变区域的一代测序验证,结果与NGS结果一致,进一步确认了NGS检测结果的准确性。
在NSCLC中已发现越来越多的多驱动基因变异共存情况,同一NSCLC患者可同时携带多个基因突变,或同一种基因上发生多个位点突变。在本实验中63例(9.69%)患者检出≥2个EGFR基因突变位点,占EGFR突变携带者的20.13%;56例(8.62%)患者为EGFR合并其他基因突变,占EGFR突变携带者的17.89%。然而,在美国及欧洲人群的研究报道中,EGFR突变肺癌患者中共突变基因占比较高的为TP53(54.6%~64.6%)、PIK3CA(9%~12.4%)等[17-19],与本实验结果中发现易合并EGFR突变的基因ERBB2(78.57%)、TP53(62.50%)、ROS1(62.50%)、BCL2L11(57.14%)、PIK3CA(38.46%)等共突变频率略有差异。本实验中未发现有EGFR与ALK共突变情况,与文献报道ALK重排和EGFR突变相互排斥的结果一致[20]。不同基因共突变情况会影响EGFR突变NSCLC患者进行TKI治疗[17-18],如EGFR突变-TP53野生型肿瘤对EGFR-TKI的应答率、中位无进展生存率和总生存率,均高于EGFR突变-TP53突变型肿瘤[18]。然而,针对各种不同的基因突变患者,临床如何选择合适及有效的治疗方案,仍需更多的研究与验证。利用NGS技术全面检测患者肿瘤相关基因突变,探索基因共突变情况对于指导患者靶向治疗、判断预后具有重要意义。
NSCLC驱动基因突变情况与不同临床特征具有一定的相关性。本实验结果显示,NSCLC女性患者基因突变率高于男性,与文献报道较一致[21]。此外,腺癌患者基因突变频率明显高于鳞状细胞癌患者;腺癌中携带基因突变的患者比例较高,而鳞状细胞癌中无基因突变的患者比例较高。因此,对于腺癌患者行基因突变检测指导其靶向治疗更有意义。目前,肺鳞状细胞癌的靶向治疗尚不明确,已有研究表明PIK3CA、TP53等基因在肺鳞状细胞癌患者中突变频率相对较高,可作为影响肺鳞状细胞癌患者治疗方案及判断预后的指标[22-23]。后续可进行更多样本量的临床研究验证。
综上所述,利用NGS技术可全面分析患者多基因突变情况,不仅有助于NSCLC早期诊断,也可为患者靶向治疗及预后评价提供依据。NSCLC驱动基因突变的频率与临床病理特征有关,EGFR、KRAS、PIK3CA等基因在NSCLC中的突变频率较高,且EGFR突变患者中存在一定比例的与其他基因共突变情况。这些结果对指导NSCLC患者精准诊疗有帮助,但仍需积累更多病例进一步分析。
