TaRanGAP2在小麦抵抗叶锈菌侵染中的作用
2022-03-22宋姗姗张欣婷芦远景侯春燕王冬梅
宋姗姗,张欣婷,王 琦,芦远景,侯春燕,2,3,王冬梅,2,3
(1.河北农业大学 生命科学学院,河北 保定 071000;2.省部共建华北作物改良与调控国家重点实验室,河北 保定 071000;3.河北省植物生理与分子病理学重点实验室,河北 保定 071000)
小麦(TriticumaestivumL.)是我国重要的粮食作物,保证小麦的产量对于我国粮食安全具有至关重要的作用。小麦叶锈病是小麦三大锈病之一,在我国小麦的主产区均有过发生,其流行年份可使小麦产量减少30%~40%,严重危害粮食安全[1]。因此,研究小麦抵抗叶锈病的分子机制,为小麦抗叶锈病育种给予分子水平的指导,对于小麦叶锈病的预防和治理具有非常重要的意义。
小麦叶锈病是由小麦叶锈菌(Pucciniatriticina)侵染所引起的小麦真菌性病害[2]。在小麦与叶锈菌互作的不亲和组合中,叶锈菌吸器母细胞(Haustorium mother cell,HMC)接触寄主叶肉细胞后会引起叶肉细胞发生快速死亡,以阻止叶锈菌对寄主的进一步侵染。这种寄主细胞快速死亡的现象被称为过敏性反应(Hypersentive reaction,HR)。HR属于植物细胞程序性死亡(Programmed cell death,PCD)现象,是生物体在自身生理病理或受到外界不良环境刺激时,按照一定程序结束细胞生命的主动防卫过程,受到严格调控[3]。
RanGAP2是一个GTPase激活蛋白,可激活细胞内非常保守的一类重要小GTPase蛋白Ran,从而参与细胞内一系列重要的生物活动,包括有丝分裂过程中着丝粒的形成、核膜形成等[4-5]。RanGAP2还可以通过结合GTP或者GDP而与不同细胞因子结合,形成出入细胞核膜内外的不同构象,帮助细胞内大分子在细胞核与细胞质之间运输和转移。有研究发现,RanGAP2通过影响NB-LRR蛋白的胞质定位发挥作用,而NB-LRR蛋白的胞质定位对于HR的诱发至关重要。如马铃薯NB-LRR免疫受体Rx仅定位于细胞质时可以发挥免疫功能,RanGAP2可以影响Rx的核质分配,从而决定Rx的功能[6]。马铃薯NB-LRR蛋白Gpa2能够识别孢囊线虫(Globoderapallida)分泌蛋白RBP-1,诱发HR反应,而与Gpa2互作的RanGAP2是Gpa2防御功能所必需的[7]。这些研究说明,RanGAP2在植物防御中也发挥重要作用。
在分析小麦与叶锈菌互作的转录组数据时发现,在亲和及不亲和组合中TaRanGAP2基因的表达具有明显差异。在此基础上,对TaRanGAP2基因在小麦抵抗叶锈菌侵染中的表达情况及其抗病分子机制进行了初步研究。证明TaRanGAP2基因在小麦抵抗叶锈菌侵染的寄主过敏性反应发生具有重要作用。
1 材料和方法
1.1 试验材料
供试小麦品种:小麦近等基因系TcLr26及其轮回亲本Tatcher(Tc)。供试菌种:叶锈菌生理小种260。TcLr26和Tc分别与叶锈菌生理小种260组成不亲和(TcLr26×260)及亲和(Tc×260)组合[8]。供试烟草:本氏烟草。
1.2 试验方法
1.2.1TaRanGAP2基因编码蛋白系统进化分析 使用在线软件PFAM对TaRanGAP2蛋白保守结构域进行分析。为了研究小麦TaRanGAP2与其他物种中同源蛋白之间的进化关系,通过NCBI数据库进行BlastP同源比对,利用 MEGA 7软件对其氨基酸序列进行系统进化树分析。
1.2.2 小麦与叶锈菌互作过程中TaRanGAP2转录水平的表达 当TcLr26和Tc小麦幼苗第2片叶生长至1~2 cm,在其第1片叶上接种叶锈菌生理小种260。在接种后0,8,16,24,48,72 h取样,取样质量为0.1 g,样品于液氮速冻后提取 RNA。样品总RNA的提取方法参照UNlQ-10柱式总RNA 抽提试剂盒说明书。以提取的总RNA为模板反转录cDNA,具体方法参照TaKaRa公司反转录试剂盒。
根据TaRanGAP2基因序列,使用TB tools软件设计特异性结合引物(表1),交由通用生物公司合成。以稀释后的cDNA为模板,检测TaRanGAP2基因在小麦Tc/TcLr26品种分别接种叶锈菌生理小种260后不同时间点的相对表达量,每个样品共3个重复。采用诺唯赞2×ChamQ Universal SYBR Master Mix试剂盒进行RT-qPCR反应。以小麦甘油醛-3-磷酸脱氢酶基因(GAPDH)为内参基因,利用2-ΔΔCt法计算相对表达量。

表1 引物序列Tab.1 Primer sequence
1.2.3 TaRanGAP2亚细胞定位 去除TaRanGAP2基因CDS区终止密码子,利用DNAMAN软件设计特异性引物(表1),并添加SalⅠ和SpeⅠ酶切位点。利用PrimeSTAR®GXLDNA Polymerase高保真酶扩增TaRanGAP2基因序列。PCR扩增的TaRanGAP2基因片段长度为1 662 bp,与pSuper1300-GFP载体连接,构建pSuper1300-TaRanGAP2-GFP载体。利用热激法将该重组质粒转入农杆菌感受态细胞GV3101中,保存菌液[9]。
培养包含pSuper1300-TaRanGAP2-GFP载体质粒的农杆菌菌液,用侵染液离心洗涤,去除YEB培养基。使用分光光度计调悬浮菌液的OD600值在0.6~0.8。使用不带针头的注射器注射烟草叶片,40~48 h后,取样,压片,使用激光共聚焦显微镜(CLSM)观察TaRanGAP2-GFP蛋白绿色荧光的分布状态。
1.2.4 利用VIGS技术探究TaRanGAP2基因功能 以大麦条纹花叶病毒(Barleystripemosaicvirus,BSMV)为载体构建TaRanGAP2的VIGS载体BSMV∶TaRanGAP2。将该载体以及河北省植物生理与分子病理学重点实验室保存的载体α、β、BSMV∶00、BSMV∶PDS进行酶切线性化,并对线性化产物进行纯化,以纯化产物为模板进行体外转录RNA病毒,将转录产物于-80 ℃保存。待TcLr26小麦幼苗第2片真叶生长至1~2 cm时,对其第1片真叶进行病毒转染,选用各体外转录的BSMV病毒组成不同的组合和硅藻土(FES)混匀(表2),摩擦接种至第1片真叶。选用八氢番茄红素脱氢酶基因(Phytoene desaturase,PDS)为沉默指示基因,当该基因被沉默13 d左右时,小麦第3片叶出现漂白现象,表明转染试验操作成功。此时,分别在转染BSMV∶00和BSMV∶TaRanGAP2植株的第3片叶上接种叶锈菌生理小种260。在接种后48,96 h取样,进行沉默效率检测和Fluorescent Brightener染色,用荧光显微镜观察叶锈菌发育和HR面积,采集并保存图像。
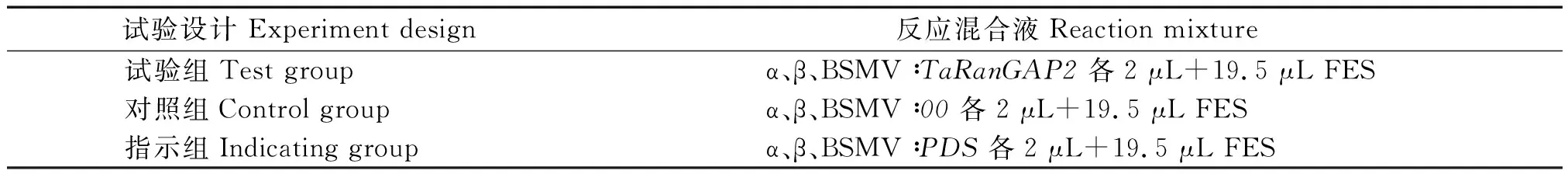
表2 VIGS试验体系Tab.2 System of VIGS assay
2 结果与分析
2.1 TaRanGAP2保守结构域及系统进化分析
使用在线软件PFAM分析发现,该TaRanGAP2的CDS长度为1 665 bp,编码554个氨基酸。包含一个WPP 结构域和4个LRR重复序列(图1-A)。

A.保守结构域:绿色为WPP保守结构域;红色区域表示LRR亮氨酸重复序列。B.红色方框内为TaRanGAP2。A.Conserved domain:Green area is the conserved domain of WPP;Red area is the LRR leucine repeat sequence.B.TaRanGAP2 is in the red box.
为了研究TaRanGAP2与其他物种中同源蛋白之间的进化关系,通过NCBI数据库进行BlastP同源比对,利用 MEGA 7软件对其氨基酸序列进行系统进化树分析,如图1-B所示,单子叶植物和双子叶植物分别聚为一类,TaRanGAP2与单子叶植物处于同一分支,而且与大麦同源关系最近。
2.2 TaRanGAP2在小麦抵抗叶锈菌侵染过程中的表达分析
小麦Tc、TcLr26品种在接种叶锈菌生理小种260后,利用RT-qPCR技术检测TaRanGAP2基因在不同时间表达量的变化。结果表明,在不亲和组合(TcLr26×260)中,TaRanGAP2基因的表达量出现显著上调,在接种后16 h达到0 h的7.8倍(图2)。而在亲和组合(Tc×260)中,TaRanGAP2基因的表达在接种后8 h只是轻微上调,为0 h的2.1倍。说明TcLr26中的TaRanGAP2基因对叶锈菌的侵染具有更加明显的应激表达。
RT-qPCR值是3个独立试验数据的平均值±标准误,利用SPSS软件对其进行差异显著性分析,由同一字母表示的平均值无显著差异(P>0.05)。图4,6同。
2.3 TaRanGAP2定位于细胞质
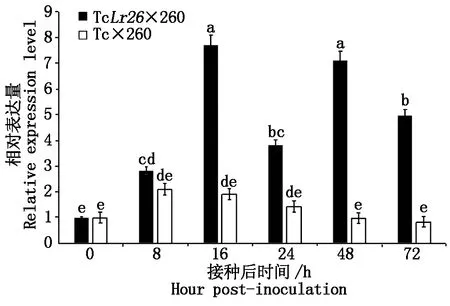
为进一步研究TaRanGAP2在植物细胞内的分布情况,利用烟草瞬时表达系统进行TaRanGAP2亚细胞研究。将包含有pSuper1300-TaRanGAP2-GFP重组载体质粒和包含pSuper1300-GFP空白对照质粒的农杆菌注射烟草叶片。48 h后通过CLSM观察荧光的分布。如图3所示,TaRanGAP2-GFP荧光分布在细胞质中。
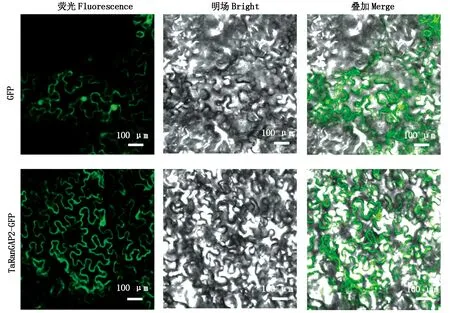
图3 TaRanGAP2亚细胞定位Fig.3 Subcellular localization of TaRanGAP2
2.4 TaRanGAP2基因沉默对小麦抗叶锈菌侵染的影响
待小麦第2片真叶长为1~2 cm时,在第1片真叶上接种体外转录得到的RNA病毒。本试验以BSMV∶PDS为指示组,转染13 d后,观察发现PDS沉默植株的第3片叶出现了预期的漂白现象。同时转染BSMV∶00、BSMV∶TaRanGAP2病毒植株的第3片叶也均出现了BSMV成功侵染的条纹症状,表明病毒转染成功(图4-A)。
当指示组的植株叶片出现漂白现象时,分别在转染BSMV∶00和BSMV∶TaRanGAP2植株的第3片叶上接种叶锈菌生理小种260,在接种48,96 h后分别取样,利用RT-qPCR技术检测该植株TaRanGAP2基因的沉默效率(图4-B),以转染BSMV∶00的植株作为对照组,结果表明,转染BSMV∶TaRanGAP2植株中TaRanGAP2基因相对表达量显著下降,表明其被有效沉默。

A.转染病毒后13 d叶片表型观察;B.利用RT-qPCR技术检测TaRanGAP2基因沉默效率。A.Observation of leaf phenotype 13 days after virus transfection;B.The detection of TaRanGAP2 gene silencing efficiency by RT-qPCR.
同时将48,96 h取样的部分小麦叶片样品进行Fluorescent Brightener染色处理(图5),观察沉默植株叶片的单侵染点吸器母细胞数量及HR面积。
随机统计分析了50个单侵染点的HMC数量(图6-A)和HR面积(图6-B),从统计结果可以看出,相比对照组植株,TaRanGAP2基因沉默植株的HR面积显著增大,其HMC数量也显著增多;由于小麦叶肉细胞通过形成HR来限制叶锈菌的发育,因此,推测沉默TaRanGAP2后,HR发生进程减慢,小麦抗性减弱,无法阻止叶锈菌的生长,进而使HMC数量增加,导致诱发更为严重的HR,使得HR面积有所增加。
紫外光激发观察HMC个数;蓝光激发观察HR面积。Number of HMC observed by ultraviolet excitation;HR area observed by blue-light excitation.
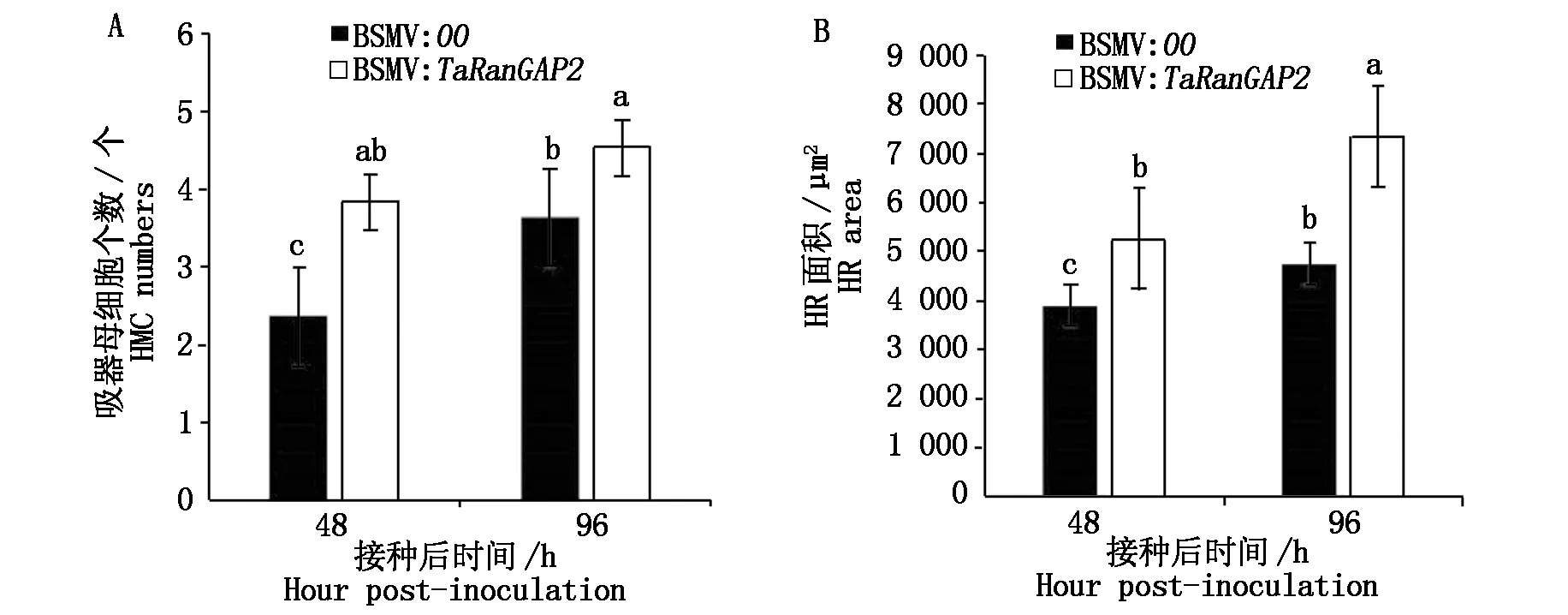
A.接菌后单侵染点的HMC数量统计;B.接菌后单侵染点的HR面积统计。A.Statistics of the number of HMCs at a single infection site after inoculation; B.Statistics of HR area of single infection site after inoculation.
3 结论与讨论
本研究通过分析小麦与叶锈菌互作的转录组数据库,观察到在亲和及不亲和组合中TaRanGAP2基因的表达量具有显著差异。借助RT-qPCR技术检测发现,在不亲和组合中TaRanGAP2被显著诱导表达,提示在不亲和组合中TaRanGAP2可能与HR的发生相关。因此,利用VIGS技术沉默TcLr26植株的TaRanGAP2基因,在接种叶锈菌后与对照组相比,沉默TaRanGAP2基因的植株叶片单侵染点HR面积显著增大,HMC数量显著增多。
由于小麦叶肉细胞通过形成HR来限制叶锈菌的发育,因此,推测沉默TaRanGAP2后,HR发生进程减慢,小麦抗性减弱,无法阻止叶锈菌的生长,进而HMC数量增加,增加的HMC接触到寄主细胞又进一步引起死亡,导致诱发更为严重的HR,使得HR面积增大。以上结果表明,TaRanGAP2在抵抗叶锈菌侵染时发挥正调控作用。
研究表明,植物NB-LRR蛋白的亚细胞定位与抗性激活密切相关,NB-LRR类蛋白的亚细胞排布状态,可能决定其不同的作用,如启动转录再编程或启动细胞死亡信号。许多NB-LRR受体包括拟南芥RPS4、SNC1、烟草N、马铃薯Rx、大麦MLA10以及水稻Pb1既定位于细胞质也定位于细胞核[10]。大麦MLA10的CC结构域存在于细胞质时诱导细胞死亡的活性可进一步得到增强,导致HR的发生[11],但当其识别病原微生物(如白粉病菌效应子A10)被激活时,在细胞核中的积累量明显增加,参与调控防御相关基因的表达[12]。烟草TIR-NB-LRR蛋白N,其自身的LRR区域可以与细胞核内的转录因子互作,进而激活对烟草花叶病毒的抗性[13],当其结合核输出信号时,N在细胞核中的积累消失,检测到其对烟草花叶病毒的抗性也随之消失[14-15]。马铃薯Rx同样为核质分布,当马铃薯X病毒外壳蛋白(PVX-CP)定位于细胞质时,Rx发生激活并引起强烈的HR。RanGAP2可以影响Rx的核质分布状态[16],当Rx与RanGAP2共表达时,它们均匀分布在细胞质内[17-18]。有研究指出,借助基因沉默手段抑制马铃薯RanGAP2的表达,会严重削弱Rx蛋白对PVX的抗性反应[19-20]。本研究将含有pSuper1300-TaRanGAP2-GFP载体的农杆菌瞬时转化本氏烟草叶片,利用激光共聚焦荧光显微镜观察,发现TaRanGAP2蛋白定位在细胞质中。推测TaRanGAP2可能在细胞质内发挥与马铃薯RanGAP2类似的作用,还需要进一步筛选TaRanGAP2的互作蛋白进行深入研究。
