灌浆充实调节剂对大穗型水稻弱势籽粒灌浆的调控效应
2022-03-22静莉丽赵亚帆赵帅兵王童童杜彦修孙红正赵全志
静莉丽,彭 廷,赵亚帆,赵帅兵,王童童,李 源,程 远,杜彦修,张 静,孙红正,赵全志
(河南粮食作物协同创新中心,河南省水稻生物学重点实验室,水稻河南省工程实验室,河南农业大学 农学院,河南 郑州 450046)
大穗型水稻品种弱势籽粒灌浆充实度差是制约其产量和品质进一步提高的瓶颈[1]。水稻籽粒灌浆是受多种因素调控的复杂有序的生化过程。已有研究证明,水稻籽粒灌浆过程中差异表达的miRNA通过调控其靶基因在灌浆充实中发挥重要作用[2],其中miR167和miR1432分别通过调节其下游靶基因OsARF12和OsACOT的表达,进而负调控水稻籽粒的灌浆充实[3-4]。Zhang等[5-6]研究发现,类萌发素蛋白(GLP)和14-3-3蛋白是弱势籽粒灌浆启动的关键信号蛋白,灌浆早期弱势籽粒中GLP蛋白的表达丰度低、14-3-3蛋白的冗余是造成弱势籽粒灌浆差的主要原因,在胚乳中特异性低表达14-3-3蛋白家族成员GF14f可显著增加籽粒的粒长和粒质量。在籽粒灌浆过程中,蔗糖到淀粉的复杂合成途径受到多种酶的调控[7-9],这些蔗糖-淀粉代谢关键酶活性及基因表达量低是限制弱势籽粒灌浆的重要原因[10-11],研究表明,通过灌浆期外源涂抹R18显著增强水稻弱势籽粒蔗糖-淀粉代谢关键酶的活性,提高弱势籽粒千粒质量及结实率,促进弱势籽粒灌浆[12]。大穗型水稻强弱势籽粒内各激素含量与其灌浆速率密切相关[13-14],籽粒中低的玉米素和玉米素核苷和吲哚乙酸含量是弱势籽粒胚乳细胞数量少、灌浆慢、粒质量低的主要原因[15-16],外源施加低浓度生长素可增强淀粉酶活性,促进同化物的运输,而高浓度可增加弱势籽粒实粒数[17]。
灌浆充实调节剂因其用量少、效果好等优点被广泛应用于改善水稻籽粒品质和产量上[18-20]。研究表明,喷施灌浆充实调节剂通过提高水稻弱势籽粒的灌浆起始势、最大及平均灌浆速率,进而提高弱势籽粒的千粒质量,且蔗糖-淀粉代谢关键酶基因的表达量显著增加[21]。目前,市场已有多种灌浆充实调节剂,但各灌浆充实调节剂效果如何,其调节水稻籽粒灌浆充实,尤其是弱势籽粒灌浆充实的生理和分子机制尚无相关报道。
本研究通过探究市售灌浆充实调节剂对大穗型水稻产量及其构成因素、强弱势籽粒灌浆动态、籽粒灌浆充实相关miRNA及其靶基因的表达量、激素含量、编码灌浆充实相关蛋白基因及蔗糖-淀粉代谢关键酶基因表达量等方面的影响,旨在明确市售灌浆充实调节剂对大穗型水稻品种灌浆充实的调节作用,提升大穗型水稻的产量和品质。
1 材料和方法
1.1 试验材料
供试材料为大穗型杂交稻品种交源优216(由上海交通大学张大兵教授提供);供试灌浆充实调节剂为禾立丰(由郑州郑氏化工产品有限公司提供)和新美洲星(由安徽神农农业技术开发有限公司提供)。
1.2 试验方法
试验于2020年5月在河南农业大学原阳科教园区开展。采用大田试验,随机区组设计,各小区面积均为40 m2。采用机插秧专用秧盘育秧,株距14 cm,行距30 cm。设置抽穗开花期喷施2种灌浆充实调节剂处理,禾立丰喷施量为0.9 L/hm2,新美洲星喷施量为1.0 L/hm2,分别记作T1和T2;以喷施清水为对照(CK)。于抽穗期对各处理选择同一天抽穗开花、生长状态一致的穗子进行红绳标记,每小区标记500穗。其他管理同一般高产田。
1.3 测定项目及方法
1.3.1 强弱势籽粒粒质量变化动态及灌浆速率的测定 分别于花后5,10,15,21,27,35,42 d在各小区中选取红绳标记的代表性穗子10个,参照Peng等[22]的方法分强弱势籽粒,105 ℃杀青0.5 h,80 ℃烘干至恒质量,计算强弱势籽粒千粒质量。参照朱庆森等[23]的方法,以Richards方程拟合强弱势籽粒的灌浆过程,并对各处理水稻强弱势籽粒灌浆进行分析。
Richards方程:W=A(1+Be-k t)- 1 / N
式中,W为各时期生长量,即千粒质量(g);t为花后天数(d);A为生长终值量(g);B、k、N为方程参数。
根据Richards方程推导出下列灌浆特征参数:灌浆起始势R0= k/N;平均灌浆速率V=Ak/(2(N+2));活跃灌浆期AGP= 2(N+2)/k;将灌浆速率为最大时的日期tmax=(lnB-lnN)/k代入kW(1-(W/A)N)/N中求出最大灌浆速率Vmax。
1.3.2 miRNA和相关基因的相对表达量测定
1.3.2.1 水稻籽粒总RNA的提取 分别于花后6,12,21 d选取对照、禾立丰和新美洲星处理的弱势籽粒,立即置于液氮中,随后保存于-80 ℃低温冰箱。将去除颖壳的强弱势籽粒样品置于装有液氮的研钵中充分研磨至粉末状,使用RNA提取试剂盒(TransGen Biotech ET121 Transzol Plant)进行籽粒RNA提取。
1.3.2.2 反转录 使用反转录试剂盒(TIANGEN FastKing RT Kit with gDNase:KR116)将模板RNA反转录为cDNA。采用Stem-loop qRT-PCR中的方法对需测定miRNA表达量的RNA进行反转录,其中所用引物为 miRNA 特异反向引物和内参反向引物(Stem-loop_U),引物序列见表1;用于其他基因反转录的引物为试剂盒中的FQ-RT PrimerMix。根据RNA的浓度进行稀释后反转录,最终体系为20 μL。

表1 引物序列Tab.1 Primer sequence
1.3.2.3 荧光定量PCR 使用荧光定量PCR试剂盒(Vazyme ChamQ Universal SYBR qPCR Master Mix Q711-02/03)进行荧光定量PCR。将cDNA按照1∶20稀释,20 μL反应体系:10 μL 2×ChamQ Universal SYBR qPCR Master Mix,1 μL正向引物,1 μL反向引物和3 μL RNase-Free ddH2O,5 μL模板cDNA;以β-actin为内参基因,引物序列详见表1。miRNA 定量采用 Stem-loop 方法进行,所用引物为miRNA 正向引物与通用反向引物(Stem-loop_U);其他基因定量引物为该基因对应的正向和反向引物。反应程序:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环。实时荧光定量PCR在CFX 96 Real Time System上进行,所有样品均设置 3次重复,相对表达量用2-ΔΔCt方法计算。
1.3.3 籽粒激素含量测定 设置RIGOL L3000高效液相色谱仪波长为254 nm,色谱柱为RIGOL C18反相色谱柱(250 mm×4.6 mm,5 μm),柱温30 ℃,流速0.8 mL/min,进样体积10 μL,1%乙酸水溶液与甲醇(流动相)的体积比为 6∶4。称取约0.15 g籽粒,经前处理后,取适量溶液用针头式过滤器过滤于带有内衬管的样品瓶内,进行籽粒中吲哚乙酸(IAA)和玉米素+玉米素核苷(Z+ZR)含量的测定。精确称取IAA、ZA和ZR标准品,分别用甲醇溶解配制1 mg/mL的贮备液,逐级稀释配制出6个不同质量浓度(0.01~2.00 μg/mL)的标准溶液,按上述色谱条件依次检测各标准溶液的峰面积,以峰面积为纵坐标,质量浓度为横坐标绘制标准曲线。根据标准曲线计算得到籽粒中IAA和Z+ZR的含量。
1.3.4 考种及测产 于成熟期在每小区随机选取具有平均有效穗数的5株稻株,放在室内自然风干。考种内容包括强弱势籽粒千粒质量、穗数、结实率、穗粒数。另每小区随机选取3 m2用于测产,3次重复。
1.4 数据处理
所有试验数据均采用Excel 2016和IBM SPSS Statistics 25.0进行整理及分析。
2 结果与分析
2.1 灌浆充实调节剂对水稻产量构成因素和产量的影响
由表2可知,T1和T2处理的产量分别比对照高0.56,0.51 t/hm2,分别显著增产5.03%,4.58%(P<0.05)。分析产量构成因素可知,T1和T2处理的结实率分别比对照显著高6.96,4.06百分点(P<0.05);T1处理的强势籽粒千粒质量比对照高出1.50%,而T2处理的强势籽粒千粒质量比对照降低1.20%,但差异均未达到显著水平;T1和T2处理的弱势籽粒千粒质量分别比对照显著高出16.07%,15.89%(P<0.05)。

表2 灌浆充实调节剂对水稻产量构成因素和产量的影响Tab.2 Effects of the grain filling regulators on rice yield components and yield
2.2 灌浆充实调节剂对水稻强弱势籽粒灌浆动态的影响
由图1可知,各处理强势籽粒千粒质量快速增加,随后逐渐趋于稳定,T1和T2处理基本在花后15 d达到最大值,均比对照先达到最大值。花后5 d T2处理的强势籽粒千粒质量比对照显著高17.58%(P<0.05)。T1和T2处理强势籽粒的最大灌浆速率分别比对照显著高105.77%,97.60%(P<0.05)。弱势籽粒千粒质量随籽粒灌浆进程基本呈逐渐增加的变化趋势,在花后42 d T1和T2处理的弱势籽粒千粒质量分别比对照高2.05,1.75 g,分别显著增加了12.76%,10.92%(P<0.05)。随着籽粒灌浆进程,弱势籽粒灌浆速率呈现先上升后下降的趋势。
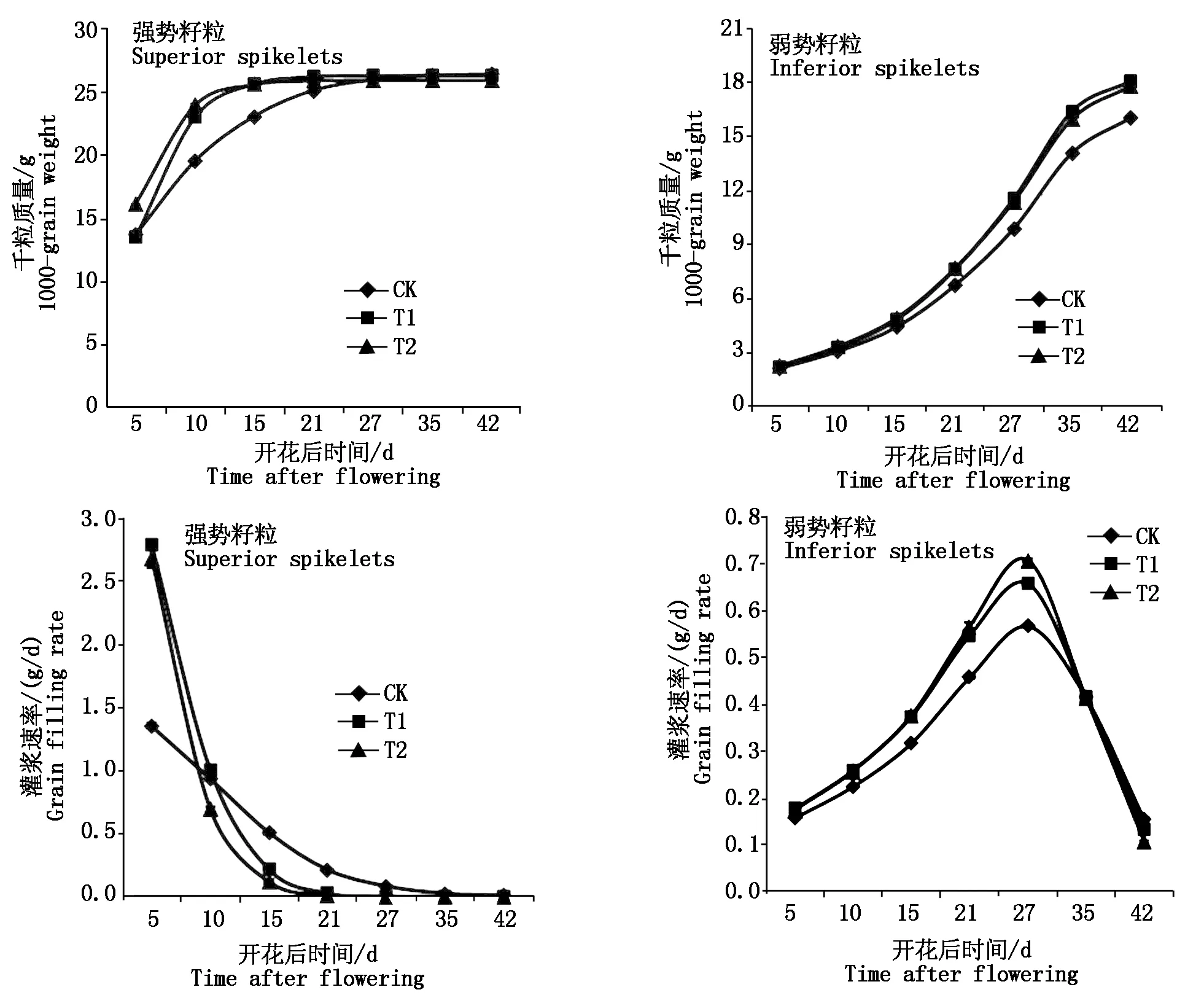
图1 灌浆充实调节剂对水稻强、弱势籽粒千粒质量及灌浆速率的影响Fig.1 The effects of the grain filling regulators on the 1000-grain weight and the grain filling rate of superior and inferior spikelets of rice
由表3可知,T1和T2处理显著提高了弱势籽粒的灌浆起始势;T1处理的弱势籽粒最大灌浆速率和平均灌浆速率均高于T2处理,且2个处理均显著高于对照(P<0.05);T1和T2处理显著缩短了弱势籽粒活跃灌浆期(P<0.05),表现为T1、T2、CK依次延长。

表3 灌浆充实调节剂处理下水稻弱势籽粒灌浆过程的Richards方程特征参数Tab.3 Grain-filling Richards equation parameters for inferior spikelets of rice under the grain filling regulators
2.3 灌浆充实调节剂对水稻弱势籽粒中miRNA及其靶基因相对表达量的影响
由图2可知,T1处理显著抑制花后6 d弱势籽粒中miR167a-c、miR167d-j和miR1432的表达,分别比对照下调46.65%,44.28%和74.89%,显著促进靶基因OsARF12和OsACOT的表达(P<0.05),分别比对照上调51.85%,45.39%;T1处理显著抑制花后12 d弱势籽粒中miR167a-c的表达,比对照显著下调46.12%(P<0.05);T1处理显著抑制花后21 d弱势籽粒中miR167a-c、miR167d-j、miR1432的表达,分别比对照显著下调36.15%,49.50%,62.85%(P<0.05),促进miR1432靶基因OsACOT的表达。T2处理显著抑制花后6 d弱势籽粒中miR167a-c、miR167d-j、miR1432的表达,分别比对照显著下调30.66%,46.89%,49.12%(P<0.05),促进其靶基因OsARF12、OsACOT的表达,且OsACOT上调显著,比对照显著上调56.33%(P<0.05);T2处理抑制花后12 d弱势籽粒中miR167a-c的表达,促进miR167a-c靶基因OsARF12的表达;T2处理抑制花后21 d弱势籽粒中miR167a-c、miR167d-j和miR1432的表达,且miR167a-c和miR1432下调显著,分别比对照下调25.59%,46.33%,显著促进miR1432靶基因OsACOT的表达(P<0.05),比对照上调65.11%。
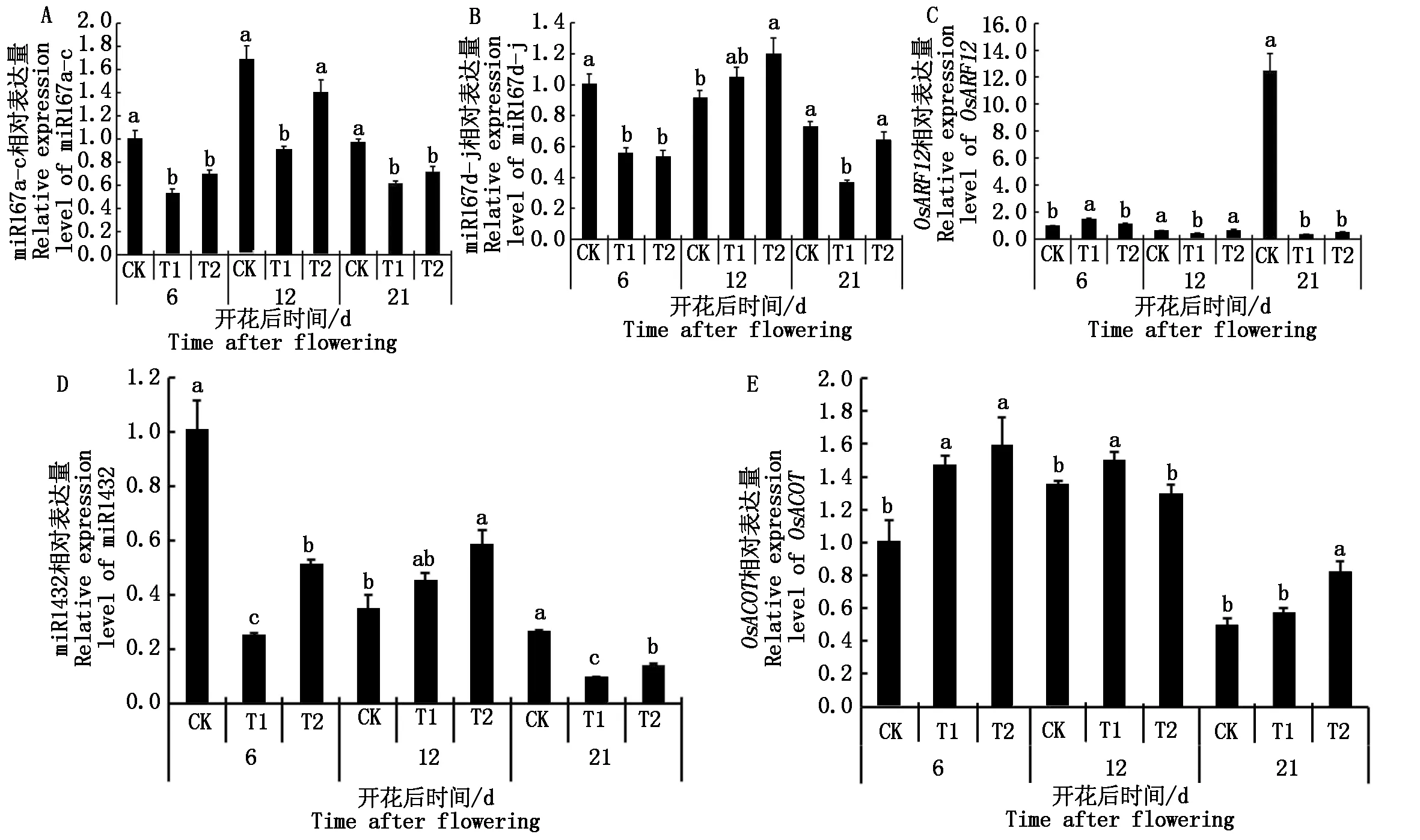
不同字母代表同一开花后时间不同处理间的差异显著(P<0.05)。图3—5同。The different letters represent the significant difference among different treatments in the same days after flowering(P<0.05).The same as Fig.3—5.
2.4 灌浆充实调节剂对水稻弱势籽粒灌浆启动关键信号蛋白基因表达量的影响
由图3可知,T1处理弱势籽粒中OsGLP3的表达量在花后6,21 d显著上调,分别比对照显著上调了26.94%,70.46%(P<0.05);OsGF14f和OsGF14b的表达量在花后12 d与对照相比显著下调了19.54%,30.48%(P<0.05)。T2处理弱势籽粒中OsGLP3的表达量在花后6,12,21 d显著上调(P<0.05),分别比对照上调了175.69%,14.91%,98.71%;OsGF14b的表达量在花后6,12 d显著下调,分别比对照下调了45.22%,23.82%(P<0.05);OsGF14f的表达量在花后12 d与对照相比显著下调了11.88%(P<0.05)。

图3 灌浆充实调节剂对水稻弱势籽粒灌浆启动关键信号蛋白基因表达量的影响Fig.3 Effects of the grain filling regulators on the gene expression level of key signal proteins of filling initiation in inferior spikelets of rice
2.5 灌浆充实调节剂对水稻弱势籽粒中蔗糖-淀粉代谢关键酶基因表达量的影响
由图4可知,T1处理显著提高了花后6,12 d弱势籽粒中OsSUS3和OsGBSSⅠ的表达量,OsSUS3的表达量分别比对照显著上调了619.92%,45.40%(P<0.05),OsGBSSⅠ的表达量分别比对照显著上调了818.28%,27.18%(P<0.05);OsAGPS2的表达量在花后6,12,21 d上调,其中在花后6 d比对照显著上调了87.08%(P<0.05)。T2处理显著提高了花后6,12,21 d弱势籽粒中OsAGPS2和OsGBSSⅠ的表达量,OsAGPS2的表达量分别比对照显著上调了256.04%,27.20%,473.08%(P<0.05),OsGBSSⅠ的表达量分别比对照显著上调了133.39%,14.36%,567.16%(P<0.05);OsSUS3在花后6,12 d上调,且在花后6 d比对照显著上调了1 565.51%(P<0.05)。

图4 灌浆充实调节剂对水稻弱势籽粒中蔗糖-淀粉代谢关键酶基因表达量的影响Fig.4 Effects of the grain filling regulators on the gene expression level of key enzymes of sucrose-starch metabolism in inferior spikelets of rice
2.6 灌浆充实调节剂对水稻弱势籽粒中IAA和Z+ZR含量的影响
由图5可知,T1和T2处理显著提高花后9,21 d弱势籽粒中Z+ZR含量(P<0.05),增加的幅度分别为29.55%和7.47%,4.34%和26.54%。T1和T2处理IAA含量在花后9,15,21 d均显著高于对照(P<0.05),增加幅度分别为126.19%和222.20%,9.70%和1.90%,34.62%和101.19%。
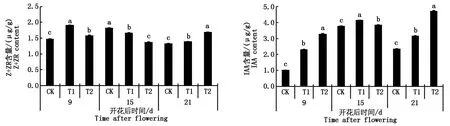
图5 灌浆充实调节剂对水稻弱势籽粒中Z+ZR和IAA含量的影响Fig.5 Effects of the grain filling regulators on the contents of Z+ZR and IAA in inferior spikelets of rice
2.7 相关性分析
由图6可知,弱势籽粒的灌浆速率与其中的miR1432(R2=0.463 2,P<0.01)和OsGF14f(R2=0.157 2,P<0.05)表达量呈显著负相关关系,而与其中的IAA含量(R2=0.268 1,P<0.05)呈显著正相关关系。

图6 水稻弱势籽粒灌浆速率与miR1432、OsGF14f表达量及IAA含量的相关性Fig.6 Correlation between the filling rate and the expressions of miR1432,OsGF14f,and the content of IAA in inferior spikelets of rice
3 结论与讨论
miRNA是一类长度为18~24个碱基的非编码小RNA[24],已有研究证明,水稻籽粒灌浆过程中差异表达的miRNA通过调控其靶基因在灌浆充实中发挥重要作用。Peng等[3]采用 STTM 技术在水稻中低表达 miR167,其下游靶基因OsARFs的表达量显著上调,转基因水稻籽粒的粒长、粒宽和粒质量分别增加6.94%,6.46%和26.31%。Zhao等[4]研究结果表明,miR1432负调控靶基因OsACOT,低表达 miR1432和过量表达抗 miR1432 切割版本靶基因OXmACOT,转基因植株籽粒的千粒质量分别增加18.88%~20.28%和38.92%~46.70%,粒长分别增加8.03%~10.54%和15.87%~19.24%,粒宽分别增加4.76%~6.72%和6.89%~7.30%。本研究发现,禾立丰和新美洲星处理显著提高大穗型水稻交源优216弱势籽粒的千粒质量和结实率,抑制花后6 d弱势籽粒中miR167a-c、miR167d-j和花后6,21 d弱势籽粒中miR1432的表达,促进其靶基因OsARF12和OsACOT的表达,且相关分析结果表明,弱势籽粒的灌浆速率与miR1432的表达量呈极显著负相关关系。因此,灌浆充实调节剂禾立丰和新美洲星可能通过抑制灌浆前中期弱势籽粒中miR167、miR1432的表达,进而调节灌浆充实,增加弱势籽粒千粒质量和结实率。
弱势籽粒胚乳细胞分裂停滞与灌浆早期低丰度表达的GLP有关[6],本研究发现,禾立丰和新美洲星处理显著促进花后6 d弱势籽粒中编码GLP基因OsGLP3的表达。You等[25]去除穗顶部的强势籽粒后,发现弱势籽粒中14-3-3蛋白表达量显著下调,进而提高弱势籽粒的千粒质量和结实率。张志兴等[5,26]通过构建胚乳特异性转基因水稻植株发现,在灌浆期特异减少胚乳中14-3-3蛋白亚型GF14f的表达,显著促进弱势籽粒灌浆;灌浆期分别喷施外源植物激素(ABA、IAA、GA、ZT和BR)后发现,籽粒中14-3-3蛋白家族成员GF14b上调表达,而GF14b通过蛋白互作的形式负调控淀粉合成代谢相关基因的表达。本研究发现,禾立丰和新美洲星处理显著抑制花后12 d弱势籽粒中编码14-3-3蛋白的基因OsGF14b和OsGF14f的表达,且相关分析结果表明,弱势籽粒的灌浆速率与籽粒中OsGF14f的表达量呈显著负相关关系。因此,灌浆充实调节剂禾立丰和新美洲星可能通过促进GLP蛋白、抑制14-3-3蛋白的表达,进而提高弱势籽粒灌浆起始势,促进大穗型水稻弱势籽粒的灌浆充实。
已有研究证明,水稻籽粒中蔗糖合成酶(SuSase)、腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)和淀粉合成酶(StSase)等的活性与灌浆速率呈极显著正相关关系[27],较高水平的IAA和Z+ZR含量可能促进维持灌浆进程,促进弱势籽粒灌浆充实[13,28]。本研究发现,禾立丰和新美洲星处理促进花后6,12 d弱势籽粒中蔗糖-淀粉代谢关键酶基因OsSUS3、OsAGPS2和OsGBSSⅠ的表达,显著提高弱势籽粒花后9,21 d的Z+ZR含量,花后9,15,21 d的IAA含量,且相关分析结果表明,弱势籽粒的灌浆速率与籽粒中IAA的含量呈显著正相关关系。因此,灌浆充实调节剂禾立丰和新美洲星可能通过调节灌浆前中期弱势籽粒蔗糖-淀粉代谢关键酶基因和内源激素的含量,进而提高弱势籽粒的灌浆速率和粒质量。
综上,禾立丰和新美洲星这2种灌浆调节剂可能是通过调节灌浆前中期灌浆充实相关miRNA及靶基因、编码灌浆充实相关蛋白和蔗糖-淀粉代谢关键酶基因表达量,提高激素IAA和Z+ZR含量,促进弱势籽粒灌浆充实,增加水稻产量。
