SLC16A11调控小鼠骨骼肌Akt/GLUT4通路的研究及运动对SLC16A11和GLUT4表达的影响
2022-03-21张坦漆正堂丁树哲
张坦 漆正堂 丁树哲
1 上海体育学院运动科学学院(上海200438)
2 上海市运动与代谢健康前沿科学研究基地(上海200438)
3 华东师范大学青少年健康评价与运动干预教育部重点实验室(上海200241)
SLC16A11 基因编码的单羧酸转运载体11(mono⁃carboxylate transporter 11,MCT11),定位于内质网[1]和细胞膜[2],运输底物为丙酮酸。2014年SIGMA 2 型糖尿病联盟[1]的一项针对墨西哥和拉丁美洲人群的全基因组关联分析发现,SLC16A11 是一种新的2 型糖尿病风险基因,其mRNA高表达于肝脏、甲状腺和唾液腺等部位,通过人为方法使HeLa 细胞表达SLC16A11 可引发一系列脂质代谢指标的变化(正常情况下HeLa细胞不表达SLC16A11),尤其是细胞内甘油三酯(triglycer⁃ide,TAG)含量的升高最为显著。已知甘油三酯水平与2 型糖尿病的发生发展密切相关[3],因此推测SLC16A11可能通过调控脂质代谢进而加重肥胖、糖尿病等代谢性疾病的发生发展。随后一些针对不同种族人群的流行病学调查也证实SLC16A11 基因与2 型糖尿病的发生存在相关性[1,2,4-10],但也有一些研究表明SLC16A11 与糖尿病发病率之间并无关联[6,11-13]。此外,与2014年SIGMA 2 型糖尿病联盟的研究结果不同,动物实验发现SCL16A11表达增加有助于改善代谢性疾病[2]。由此可见,关于SLC16A11 与代谢之间的关系仍存在较大争议,亟需进一步研究证实。
适度运动作为一种健康且无副作用的干预方式,对机体具有巨大的有益价值。尤其大量的研究已证实长时间的中等强度运动能够通过调控糖、脂代谢,进而缓解肥胖、糖尿病等代谢性疾病,但其具体机制尚不明了。已知目前有关运动与MCTs 的研究主要集中于MCT1 和MCT4,关于运动与MCT11 的研究仍是未知。鉴于SLC1611 在调控糖脂代谢中的可能作用,本文进一步探讨运动对SLC16A11表达的影响。
腺相关病毒(adeno-associated virus,AAV)是用于基因传递与表达的常用载体,其利用病毒对细胞的感染能力,将携带的外源基因转移到细胞中,实现目的基因过表达或者基因沉默,最终达到基因治疗的目的。与其它类型病毒,如反转录病毒、慢病毒、腺病毒相比,AAV 具有安全性好、免疫原性低、表达稳定等优点,目前已广泛应用于疾病,如癌症、杜式肌营养不良等的基因治疗。因此,本研究通过对小鼠尾静脉注射AAV 的方法来抑制SLC16A11 表达,进而探讨SLC16A11 表达抑制对高脂饮食条件下葡萄糖转运的影响,以期为代谢性疾病的治疗提供理论依据。
1 研究对象与方法
1.1 实验动物及分组
清洁级4 周龄C57BL/6 雄性小鼠80 只,由上海斯莱克实验动物有限公司提供。所有小鼠适应性喂养1周。首先,将60只小鼠随机分为普通饮食对照组(Con⁃trol 组)、高脂饮食组(HFD 组)和高脂饮食加AAV 注射组(HFD+AAV组),每组20只。小鼠喂养8周后经尾静脉注射AAV,其中Control 组和HFD 组注射阴性对照AAV,HFD+AAV 组小鼠注射靶向SLC16A11 基因的干扰AAV。本研究中靶向SLC16A11 基因的干扰AAV9质粒及阴性对照空病毒质粒均购买于吉满生物科技(上海)有限公司,质粒的注射参考本课题组前期实验[15]。AAV 注射后2 周处死小鼠。在干预前和干预结束后记录小鼠体重。此外,将另外20只小鼠适应性运动1 周,然后随机分为安静对照组(Sed 组)和运动组(Ex组)。每周记录小鼠体重。运动方案见1.2部分。
实验所用饲料均由上海普路腾生物科技有限公司提供,其中普通饲料为国家标准啮齿类动物饲料;高脂饲料配比为基础饲料49.5%、猪油20.4%、蔗糖15%、酪蛋白12.3%、预饲料2%、麦芽糊精0.8%。高脂饲料供能比:蛋白质19%,脂肪45%,碳水化合物36%。小鼠饲养环境温度为22℃± 2℃,相对湿度为50% ~70%,自然光照,自由饮食、饮水。
1.2 运动方案
小鼠适应性喂养1周后,再进行1周的适应性跑台运动,运动强度从12 m/min 逐渐增加至20 m/min,运动时间从20分钟/天增加至60分钟/天。适应性运动结束后,将小鼠随机分为安静对照组(Sed 组)和运动组(Ex 组)。Ex 组运动方案为8 周中等强度跑台运动,运动强度为20 m/min,1小时/天,5天/周[15]。Ex组末次运动结束后,Ex组和Sed组小鼠禁食12小时,随后处死小鼠并取样。
1.3 葡萄糖耐量试验(IPGTT)
在Ex组小鼠运动结束前一周,对Sed组和Ex组小鼠进行IPGTT 试验。首先将小鼠过夜禁食,次日称取小鼠体重,根据小鼠体重计算葡萄糖注射量(1 g/kg)。罗氏血糖仪分别检测小鼠0 min(空腹血糖)、15 min、30 min、45 min、60 min、90 min、120 min 时刻的血糖值。
1.4 取材
干预结束后,将小鼠禁食12 小时,次日取材。由于基础状态下p-Aktser473水平较低,难以检测到,因此目前大部分研究采用胰岛素注射的方式来提高p-Aktser473水平[16]。为检测小鼠骨骼肌内胰岛素刺激的葡萄糖摄取量,Control 组、HFD 组及HFD+AAV 组小鼠在处死前20分钟各随机抽取10只经腹腔注射胰岛素(1 IU/kg),每组剩余10只小鼠注射1×PBS缓冲液[16]。处死小鼠后将股四头肌样本迅速置于液氮中,取样结束后将样本转移至-80℃冰箱保存。
1.5 骨骼肌甘油三酯含量(TAG)测定
Control 组、HFD 组和HFD+AAV 组中未注射胰岛素的小鼠骨骼肌内甘油三酯含量的测定参考Wendel等[17]方法。标记玻璃瓶,称空瓶,液氮预冷。将约100 mg 碾碎股四头肌组织转入瓶中,称重,置于干冰上。加入1 ml 氯仿甲醇混合液(2︰1),室温摇荡3~4 小时,萃取脂肪到有机相。加入100 μl 1M H2SO4摇匀,室温2000 rpm离心10分钟,分离水相和有机相。吸取下层有机相转入新玻璃瓶,弃掉上层水相。取10~30 μl脂质萃取层,置于玻璃试管,用氮气吹干。采用试剂盒检测股四头肌内甘油三酯含量。
1.6 Western Blot检测相关蛋白表达
小鼠股四头肌蛋白样品的制备、变性和浓度调平参考本课题组前期研究[15]。本文中涉及到的一抗有SLC16A11(Abcam,ab107753,1︰1000)、Akt(Cell Signaling Technology,8200S,1︰1000)、p-Aktser473(Cell Signaling Technology, 8200S, 1︰2000)、GLUT4(Cell Signaling Technology,2213,1︰1000)和GAPDH(Servicebio,1︰1000)。加入一抗抗体后4℃孵育过夜。次日,1×TBST洗膜后加入对应的二抗抗体(Cell Signaling Technology,1︰2000),室温孵育2 小时,再次洗膜。ECL 超敏试剂盒显影,Alpha 凝胶成像系统自动曝光,Image J 对图像进行灰度值分析,GAP⁃DH为内参蛋白。
1.7 统计分析
运用GraphPad Prism 8 软件进行统计分析,所有数据均采用平均数±标准差来表示。两组之间比较采用独立样本t检验进行分析,三组及以上比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 抑制SLC16A11 表达显著降低高脂饮食小鼠骨骼肌内甘油三酯含量
如图1所示,在高脂饮食干预开始前,各组小鼠体重没有差异,经过8 周高脂饮食喂养并注射AAV 后,HFD 组小鼠体重显著高于Control 组(P<0.05),但HFD组和HFD+AAV组之间没有差异。

图1 各组小鼠体重比较
如图2所示,与Control组未注射胰岛素小鼠相比,HFD组未注射胰岛素小鼠骨骼肌内甘油三酯含量有增加趋势。与HFD组未注射胰岛素小鼠相比,HFD+AAV组未注射胰岛素小鼠小鼠骨骼肌内甘油三酯含量显著减少(P<0.05)。
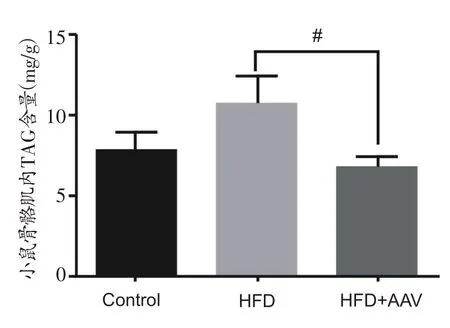
图2 各组小鼠骨骼肌内甘油三酯(TAG)含量比较
2.2 抑制SLC16A11 表达改善高脂饮食小鼠骨骼肌内Akt/GLUT4通路
如图3所示,与Control 组胰岛素注射小鼠相比,HFD组胰岛素注射小鼠骨骼肌内胰岛素刺激的p-Aktser473/Akt比值显著降低(P<0.05);与HFD组胰岛素注射小鼠相比,HFD+AAV 组胰岛素注射小鼠骨骼肌p-Aktser473/Akt比值有上升趋势但无显著差异。
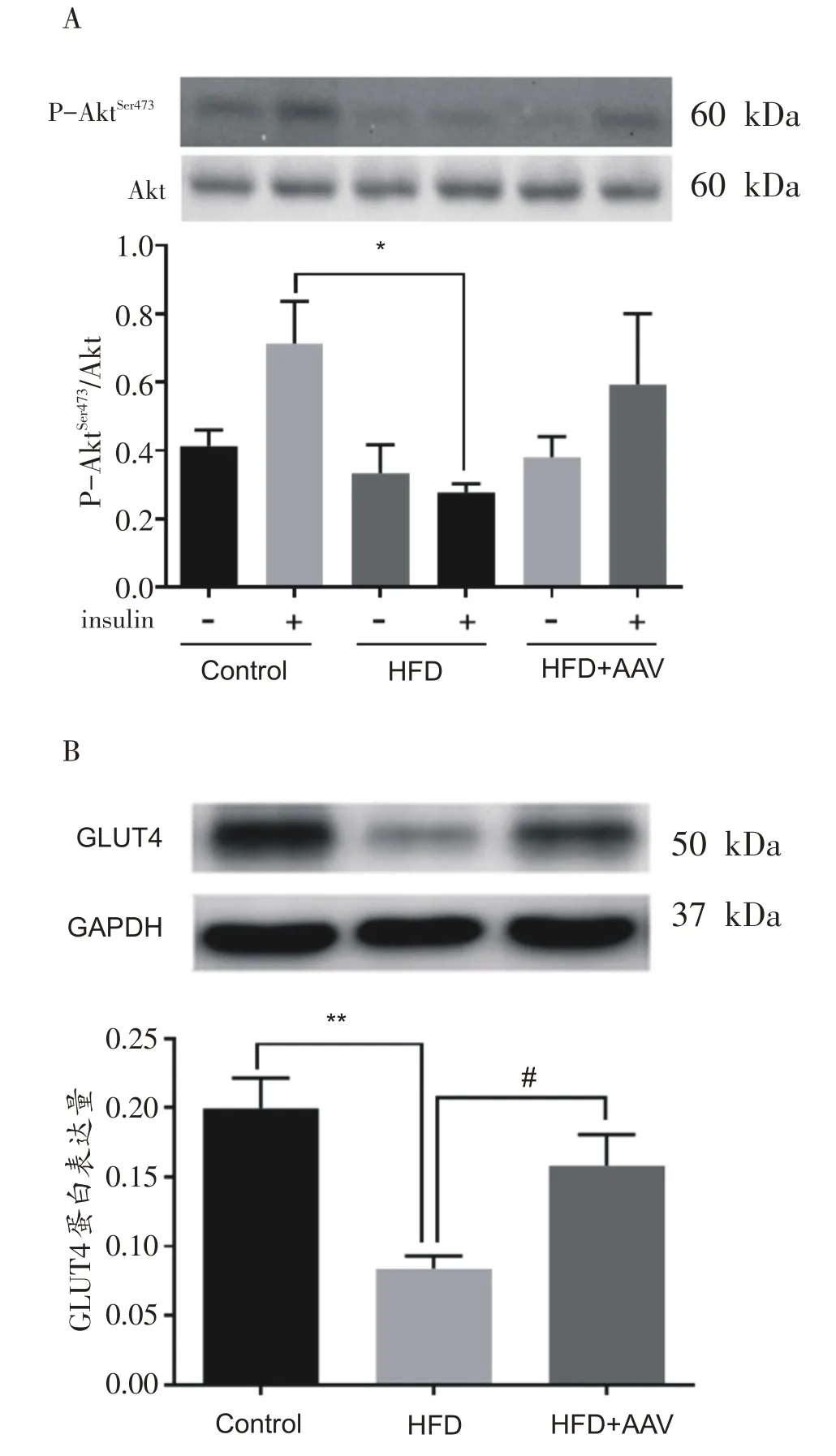
图3 各组小鼠骨骼肌内Akt/GLUT4通路相关指标比较
与Control 组未胰岛素注射小鼠相比,HFD 组未胰岛素注射小鼠骨骼肌内GLUT4蛋白表达显著减少(P<0.01);与HFD组未胰岛素注射小鼠相比,HFD+AAV组未胰岛素注射小鼠骨骼肌内GLUT4蛋白表达显著增加(P<0.05)。
2.3 长期中等强度运动显著下调SLC16A11 蛋白表达同时上调GLUT4蛋白表达
如图4所示,与Sed 组相比,Ex 组小鼠体重在运动后的第7周显著降低(P<0.05)。与Sed组相比,Ex组小鼠各个时间点的血糖值较低,但是差异没有统计学意义。如图5所示,与Sed 组相比,Ex 组小鼠骨骼肌内SLC16A11蛋白表达显著降低(P<0.05),而GLUT4蛋白表达则显著升高(P<0.01)。
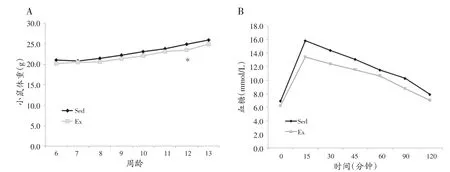
图4 各组小鼠体重、血糖值比较

图5 各组小鼠骨骼肌内SLC16A11、GLUT4蛋白表达量的比较
3 讨论
3.1 抑制SLC16A11 表达对小鼠高脂饮食小鼠骨骼肌内甘油三酯含量的影响
肥胖、糖尿病等代谢性疾病严重威胁人类健康。肥胖可引发脂质积累,进而发展为胰岛素抵抗和糖尿病。其中,高水平的甘油三酯是引发糖尿病的高危风险因素之一[18]。本研究发现8周高脂饮食后,小鼠骨骼肌内甘油三酯具有升高趋势但不具有显著性差异,而Gurley[19]等研究表明,12周高脂饮食可显著上调小鼠骨骼肌和肝脏内甘油三酯含量。推测原因可能与高脂饲料的配方以及饲养时间长短有关。此外,本研究进一步发现,采用AAV 干扰技术抑制SLC16A11 表达可明显降低小鼠骨骼肌内由于高脂饮食所导致的高水平甘油三酯。这提示SLC16A11 可能是通过上调甘油三酯水平进而在一定程度上增加糖尿病的发病风险。与本研究结论基本一致,2014年SIGMA 2型糖尿病联盟证实,HeLa 细胞中SLC16A11 的表达可显著上调细胞内甘油三酯水平[1]。值得注意的是,2017年Rusu 等[2]对SLC16A11 基因的功能进行了深入研究,结果表明,人SLC16A11编码区突变通过降低肝脏SLC16A11表达和阻碍SLC16A11 与伴侣蛋白basigin 之间的相互作用来减弱SLC16A11 功能,进而减少SLC16A11 在细胞表面的定位。并且采用siRNA 技术抑制人肝细胞中SLC16A11 表达可显著增加细胞内甘油二酯与甘油三酯的含量。因此,该研究提出通过提高SLC16A11表达水平或活性来治疗2型糖尿病的潜在策略。但该研究主要聚焦于体外细胞实验,缺乏体内实验数据。基于此,2019年Zhao等[14]探讨了生理状态下SLC16A11功能与代谢的关系,发现敲除SLC16A11基因对小鼠代谢没有显著影响,该研究进一步通过AAV 在肝脏组织里特异性回补蛋白表达的方式探讨了突变体SLC16A11 对代谢的影响,发现回补表达突变体SLC16A11可导致高脂饮食状态下血液和肝脏中甘油三酯含量显著增加。该研究对Rusu等的报道提出了质疑,推测两者不一致可能是由于多方面因素造成的。首先,与体外细胞实验相比,体内动物实验所承受的外界因素更多,如饮食、光照等;其次,在动物体内,可能存在其它的补偿机制来抵消甘油三酯的变化。此外,在实验技术方面,Rusu 等所采用的siRNA 技术与Zhao 等的小鼠基因敲除技术也不尽相同。
3.2 抑制SLC16A11表达对高脂饮食小鼠骨骼肌内Akt/GLUT4通路的影响
目前已知胰岛素抵抗是肥胖、糖尿病等代谢性疾病的典型特征和病理机制之一,其实质为胰岛素介导的葡萄糖转运与摄取能力障碍。骨骼肌是机体最大的代谢器官,胰岛素介导的葡萄糖摄取量的85%由骨骼肌完成[20],因此,骨骼肌对葡萄糖的摄取障碍是导致肥胖、糖尿病的重要原因。胰岛素介导的葡萄糖转运与摄取途径如下[21]:胰岛素与胰岛素受体结合后,引发胰岛素受体的酪氨酸位点发生磷酸化,随后进一步引发胰岛素受体底物(insulin receptor substrate,IRS)发生迅速磷酸化,磷酸化的IRS 结合并激活磷脂酰肌醇激酶(phosphatidylinositol 3-kinase,PI3K),PI3K 的活化进一步磷酸化激活蛋白激酶B(protein kinase B,PKB,即Akt)。骨骼肌细胞内存在两种葡萄糖转运蛋白(glucose transporter GLUT),即GLUT1 和GLUT4。正常安静生理状态下细胞对葡萄糖的摄取依赖于GLUT1,而GLUT4 在正常生理状态下主要定位于细胞内[22,23],对胰岛素和肌肉收缩敏感。活化的Akt可诱导GLUT4 从细胞内转位至细胞膜和T 管上,进而使得葡萄糖通过易化扩散进入骨骼肌细胞内[24],这也是骨骼肌细胞摄取葡萄糖的关键限速步骤[25]。因此,胰岛素刺激和运动情况下,胰岛素/IRS/PI3K/Akt/GLUT4 通路是骨骼肌细胞摄取葡萄糖的重要途径,该通路传导障碍可导致骨骼肌细胞对葡萄糖的摄取发生障碍,使得大量葡萄糖堆积于血液中,不能被组织吸收,进而出现高血糖症状,促进肥胖、糖尿病等疾病的发生发展。鉴于以往的研究多关注于SLC16A11 与脂质代谢,SLC16A11在糖代谢中的作用尚不清楚,而GLUT4又是维持骨骼肌细胞葡萄糖稳态的重要蛋白,因此,本研究进一步探讨了SLC16A11 与GLUT4 的关系,即抑制SCL6A11表达是否影响小鼠骨骼肌内GLUT4的蛋白表达。
然而,迄今为止,关于SLC 家族与肥胖、糖尿病的研究甚少,其中SLC30A8 是研究较为广泛的SLC 家族成员。全基因组关联分析显示,SLC30A8 是糖尿病的高危发病因素之一[26-30],其中Pound 等[31]发现,SLC30A8 基因缺失抑制胰岛分泌胰岛素,而Tamaki 等[32]特异性敲除小鼠胰岛β细胞中SLC30A8 基因则显著增加胰岛素的分泌量,但由于大量的胰岛素被肝脏降解,故外周血液内胰岛素水平降低,且肝脏中胰岛素的清除增加,说明SLC30A8 通过调控胰岛素的合成与清除进而影响糖尿病的发生发展进程。另外,SLC13A5亦被证实是参与调控胰岛素抵抗的另一重要基因[33],Neuschafer-Rube等[34]发现糖尿病大鼠肝脏SLC13A5表达显著增加,进一步研究表明SLC13A5 基因缺失可在一定程度上激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK),随后活化线粒体生物发生的核心调控因子过氧化物酶体增殖物活化受体γ辅激活蛋白-1α(peroxisome proliferator-activated receptor gamma coactivator-1 alpha,PGC-1α),增加线粒体数量,进而提高肝脏中脂质氧化,同时降低肝脏中脂质生成,从而防止高脂饮食和衰老引发的胰岛素抵抗[35]。此外,采用反义寡核苷酸技术(anti-sense oligonucle⁃otides,ASOs)选择性抑制高脂饮食大鼠肝脏中SLC13A5 表达可显著降低空腹血清胰岛素及TAG 水平,且肝脏中TAG 含量也显著下降,高胰岛素-正常血糖钳夹实验进一步证实胰岛素敏感性得到显著改善[36]。这说明抑制SLC13A5表达可在一定程度上缓解高脂饮食诱导的糖、脂代谢紊乱。
如前所述,目前关于SLC16A11 与肥胖、糖尿病的研究甚少且存在较大争议。一些流行病学研究表明SLC16A11 是糖尿病的发病因素之一[1,2,4-10],而其它研究则表明SLC16A11 与机体糖尿病发病率之间并无关联[6,11-13]。值得注意的是,Rusu 等[2]发现,人SLC16A11功能缺失可降低丙酮酸运输,导致肝脏脂滴积累增加,促进2 型糖尿病的发生。但Zhao 等[14]则发现敲除SLC16A11基因对小鼠代谢没有显著影响,通过AAV在肝脏组织里特异性回补表达突变体SLC16A11 可导致高脂饮食状态下血液和肝脏中甘油三酯含量显著增加,同时葡萄糖耐受性和胰岛素敏感性下降。机制研究表明突变型SLC16A11 能够显著提高肝脏中Lipin1表达,增加肝脏甘油三酯合成,促进2型糖尿病发生发展。这说明,关于SLC16A11与代谢关系的研究亟需进一步的深入探讨。本课题组前期研究结果表明,采用AAV 技术抑制SLC16A11 表达可显著改善高脂饮食导致的小鼠葡萄糖不耐受和肝脏胰岛素信号通路障碍[15]。同样地,本研究进一步发现,长期高脂饮食导致小鼠骨骼肌内负责葡萄糖转运摄取的Akt/GLUT4通路传导障碍,这与前人研究结果相似[19,37],而采用AAV 抑制SLC16A11 表达可在一定程度上改善高脂饮食导致的骨骼肌Akt/GLUT4 通路传导障碍。这提示抑制SLC16A11 表达能够促进骨骼肌内胰岛素信号通路的正常传导,增加骨骼肌葡萄糖转运摄取,进而降低血糖。推测可能是因为SLC16A11 作为一种单羧酸转运体,能够转运乳酸、丙酮酸等单羧酸至肝脏及其它部位,促进肝脏以这些单羧酸为原料进行糖异生,进而合成大量的葡萄糖,导致血糖升高,最终使得胰岛素敏感性下降,引发胰岛素抵抗。相反,抑制SLC16A11 表达则可抑制单羧酸向肝脏转运,使得糖异生合成减少,进而降低血糖。
3.3 长期中等强度运动对小鼠骨骼肌内SLC16A11、GLUT4蛋白表达的影响
已知长期中等强度运动可对机体带来积极的健康效益。其中,抗阻运动和耐力运动均能够促进脂质代谢,进而缓解代谢性疾病,但其机制尚未完全明了。鉴于本研究已证实抑制SLC1611表达可显著改善高脂饮食导致的骨骼肌葡萄糖转运障碍,故推测运动可能通过下调SLC16A11 表达进而增加骨骼肌葡萄糖转运。然而,目前有关运动与MCTs 的研究主要集中于MCT1和MCT4。其中不同运动方式,如耐力运动[38-40]、力量运动[41,42]和抗阻运动[43]均能够上调MCT1 和MCT4 水平,并伴随有转运乳酸能力的提高。但也有研究发现,运动并未引起MCT1及MCT4水平的显著变化[44,45]。推测可能是因为MCT 水平的变化受多种因素影响,如运动类型、运动强度和运动持续时间等,其中运动强度被认为是最重要的影响因素[46]。此外,也有研究表明耐力运动可显著降低小鼠肿瘤中MCT1的表达,但MCT4表达无显著差异,推测可能是因为运动对MCTs表达的影响呈多样化,不同亚型MCT对运动的敏感性不同。
本研究结果表明,运动组小鼠体重低于安静对照组,葡萄糖耐受性优于安静对照组,这说明,8周中等强度跑台运动对小鼠整体产生了积极的健康效益。另外,与前人研究结果相似[19],本研究发现,8周中等强度跑台运动可明显降低SLC16A11蛋白表达,但增加小鼠骨骼肌内GLUT4 蛋白表达,提示长期中等强度运动可能通过下调SLC16A11表达进而改善Akt/GLUT4通路,SLC16A11 可能是介导运动改善代谢性疾病的一个潜在靶点,这为后续研究SLC16A11与运动适应性的关系提供了一定理论依据。关于SLC16A11 在运动缓解代谢性疾病中的必要性及其具体作用机制尚待进一步研究证实。
4 小结与展望
长期高脂饮食导致小鼠骨骼肌内Akt/GLUT4通路传导障碍,而采用AAV 技术抑制SLC16A11 表达则能够显著改善骨骼肌内Akt/GLUT4 通路。此外,长期中等强度运动显著降低小鼠骨骼肌SLC16A11 蛋白表达同时上调GLUT4 蛋白表达。提示SLC16A11 是调控Akt/GLUT4 通路的一个潜在靶点,适度运动可能通过降低SLC16A11表达来改善Akt/GLUT4通路,进而缓解肥胖、糖尿病等代谢性疾病。然而,目前关于SLC16A11 的报道非常匮乏,尤其是SLC16A11 与代谢关系的研究仍存在较多问题。例如,SLC16A11调控代谢的具体机制是什么、是否与其单羧酸转运功能相关;SLC16A11 对于适度运动改善胰岛素抵抗是否必需?这些疑问的解答将有助于人们更好地理解SLC16A11的功能,从而为代谢性疾病的防治提供科学依据。
