非酒精性脂肪性肝病合并2型糖尿病患者血清抵抗素和黄醇结合蛋白4水平及其临床意义探讨*
2022-03-21莫超艳杨有强肖友雪
莫超艳,杨有强,钟 嫄,肖友雪
非酒精性脂肪性肝病(NAFLD)是常见的代谢综合征的肝脏表现,好发于肥胖和超重人群。随着人们饮食结构的改变和多坐少动生活方式的流行,NAFLD发病率居高不下[1]。NAFLD可导致肝纤维化,最后形成肝硬化,最终可发展成肝细胞癌。有研究表明,肝组织脂肪的累积、炎症反应、细胞应激、肥胖和胰岛素抵抗(insulin resistance,IR)是影响NAFLD的主要因素[2]。2型糖尿病(T2DM)是因胰岛素抵抗或/和胰岛素分泌不足引起的糖代谢紊乱性疾病[3]。糖代谢异常和脂代谢异常等因素可诱发胰岛慢性炎症反应,长期和过度的胰岛炎症反应是影响T2DM患者病情的主要因素[4]。有报道称,NAFLD合并T2DM的发病率高于单纯NAFLD或单纯T2DM的发病率,推测两者之间存在某种关联[5]。因此,NAFLD合并T2DM的发病机制以及两种疾病之间的关系广受关注。抵抗素(resistin)是存在于血浆中的富含半胱氨酸的分泌性蛋白,与胰岛素抵抗和T2DM的发病有关[6]。既往研究显示[7],NAFLD大鼠肝脏胰岛素mRNA水平增加,通过胰岛素抵抗参与NAFLD的发生发展。黄醇结合蛋白4(retinol-binding protein 4,RBP4)是视黄醇(维生素A)在血液循环中的主要转运蛋白[8]。既往研究显示,RBP4可能在IR、糖尿病和代谢综合征发病过程中发挥关键作用。已有研究报道称,NAFLD患者血清RBP4水平显著高于健康人,提示RBP4参与NAFLD的发生发展[9]。本研究检测了NAFLD合并T2DM患者血清抵抗素和RBP4水平,现将结果报道如下。
1 资料与方法
1.1 一般资料 2017年10月~2021年1月我院诊治的NAFLD合并T2DM患者106例,男性55例,女性51例,年龄为31~55岁,平均年龄为(45.1±9.2),体质指数(body mass index,BMI)为(26.5±3.8)kg/m2;NAFLD患者106例,男性48例,女性58例,年龄为30~54岁,平均年龄为(44.5±8.8),BMI为(26.8±4.2)kg/m2。符合《中国2型糖尿病防治指南》[10]和《非酒精性脂肪性肝病诊疗指南(2018年修订版)》[11]的诊断标准。排除标准:慢性病毒性肝炎、合并恶性肿瘤、药物性及其他遗传代谢性疾病所致的肝病、大量酗酒史、合并严重的心、肾、肺功能障碍。患者签署知情同意书,本研究已获得我院医学伦理委员会批准。
1.2 检测指标 使用雅培8200型全自动生化分析仪检测血生化指标;采用化学发光法检测血清空腹胰岛素( fasting insulin,FINS) 水平,计算HOMA-β指数= 20 × FINS ( pmol /L) /[FPG( mmol /L)-3.5],采用稳态模型公式评估IR:胰岛素抵抗指数(HOMA-IR)=FBG( mmol/L)×FINS(mU/L)/22;采用ELISA法检测血清RBP4、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白介素(interleukin-6,IL-6)和血清抵抗素(resistin)水平(上海蓝基生物科技有限公司)。
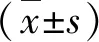
2 结果
2.1 两组血脂指标比较 合并T2DM患者血清TC和HDL-C水平显著低于NAFLD患者(P<0.05,表1)。
2.2 两组肝功能指标比较 合并T2DM患者血清GGT水平显著高于NAFLD患者(P<0.05,表2)。
2.3 两组糖代谢指标比较 合并T2DM患者血清FBG、FINS和HOMA-IR显著高于NAFLD患者(P<0.05),而HOMA-β显著低于NAFLD患者(P<0.05,表3)。
2.4 两组血清因子比较 合并T2DM患者血清抵抗素、RBP4、TNF-α和IL-6水平显著高于NAFLD患者(P<0.05,表4)。
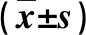
表1 两组血脂指标的比较
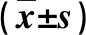
表2 两组肝功能指标的比较
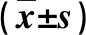
表3 两组糖代谢指标的比较
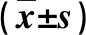
表4 两组血清因子水平的比较
3 讨论
NAFLD是一种无过量饮酒史的慢性肝病,严重威胁国人生命健康。该疾病与胰岛素抵抗、肥胖和遗传易感性相关,是一种代谢应激性肝损伤。NAFLD的疾病谱可以从非酒精性单纯性脂肪肝发展成非酒精性脂肪性肝炎和肝纤维化,最后可进展至脂肪肝相关肝硬化和肝细胞癌[12]。此外,有部分NAFLD存在代谢性疾病,比如T2DM,在一定程度上增加了心血管疾病和肝外癌发生的风险。
本研究发现,NAFLD合并T2DM患者血清TC和HDL-C水平显著低于NAFLD患者。TG是一种有机物,是脂质的组成成分。在正常情况下,血浆TG水平保持着动态平衡。血浆TG水平下降常见于甲状腺功能亢进症、肾上腺皮质功能降低、肝功能严重低下等疾病。既往研究显示[13],经治疗后NAFLD合并T2DM患者血脂水平明显降低。有学者研究显示,NAFLD患者血清TC和TG水平与肝脏脂肪变性程度呈正相关,对判断脂肪变性有较高的价值[14]。本研究结果显示血脂水平在NAFLD合并T2DM患者与NAFLD患者中存在差异,对肝脏能造成一定程度的损伤。此外,本研究发现NAFLD合并T2DM患者血清GGT水平显著高于NAFLD患者。ALT是临床用于检测肝损伤的常用实验室指标。在正常情况下,血清ALT水平较低,而在各种病毒性肝炎的急性期、药物中毒性肝细胞坏死时,ALT大量释放入血,血清ALT水平急剧升高[15]。有研究显示,ALT可能作为NAFLD患者的检验标志物,其敏感性较高[16]。本研究两组血清ALT、AST和ALP水平无显著性差异。既往研究显示[17],NAFLD患者血清ALT和AST水平显著升高,可作为诊断NAFLD的重要生化指标,但应用它们来区别是否合并T2DM可能比较困难。GGT是人体肝脏内分布最广泛的一种酶,在一定程度上可以反映肝细胞坏死和损伤,但其敏感性和特异性不及ALT[18]。既往研究显示,血清GGT水平在NAFLD患者升高[19]。本研究结果提示,NAFLD合并T2DM患者血清GGT水平更高,可能与其合并存在其他损肝因素有关。
通常,糖尿病患者处于高血糖状态。本文通过比较两组患者血糖和其他血糖指标,评估患者的糖代谢能力。研究结果发现,NAFLD合并T2DM患者血清FBG显著高于NAFLD患者,而HOMA-β显著低于NAFLD患者。IR是贯穿多种代谢相关疾病的主线,高胰岛素血症和高脂血症在肝细胞内储积脂肪,形成一个IR 与脂肪储积的恶性循环。所以,IR作为脂肪性肝病形成的“初次打击”已被广泛接受[20,21]。β细胞分泌的胰岛素作为机体唯一的降血糖激素, 与α细胞分泌的胰高血糖素一起共同调节机体血糖水平, 维持血糖平衡[22]。既往研究显示[23],NAFLD合并肝源性糖尿病患者经治疗后能有效降低HOMA-IR水平,提高HOMA-β水平,改善胰岛β细胞功能。本研究结果发现,NAFLD合并T2DM患者血清抵抗素和RBP4水平显著高于NAFLD患者,血清TNF-α和IL-6水平也显著高于NAFLD患者。RBP4是血液中转运视黄醇的蛋白,主要由肝脏和脂肪细胞合成并分泌,其水平异常升高与炎症、肥胖、T2DM、胰岛素抵抗、糖尿病大血管病变等多种疾病发生发展进程密切相关[24]。既往研究显示,RBP4系参与胰岛素抵抗的脂肪因子,促进单纯性脂肪肝向非酒精性脂肪性肝炎和肝纤维化发展,且是NAFLD合并T2DM的独立危险因素[25],本研究结果与其基本相似。NAFLD合并T2DM患者肝脏脂肪变性增加了脂肪细胞因子的分泌,如TNF-α和IL-6,促进机体炎症反应,加重患者病情发展。既往研究显示,TNF-α在血液和肝脏组织中水平升高可能是触发肝纤维化的开始阶段[26]。本研究结果发现血清抵抗素、RBP4、TNF-α和IL-6参与了NALFD合并T2DM患者胰岛素抵抗和慢性炎症反应过程。
综上所述,对于NAFLD合并T2DM患者要时刻关注血脂、血糖代谢指标和肝功能指标异常变化。通过改善胰岛素抵抗、提高胰岛素敏感性、调节血糖、血脂代谢平衡和降低RBP4水平,可能对防治NAFLD合并T2DM患者有重要的临床意义。在一般情况下,学者认知是在高脂血症的前提下,发生NAFLD,再合并存在高血压、糖尿病和其他代谢性疾病。至于无NAFLD的T2DM患者与合并存在脂肪肝基础的糖尿病患者存在哪些差异,需要认真研究和积累资料。在脂肪性肝病发病越来越高的情势下,如何控制胰岛素抵抗,加速糖脂代谢,是一个必须攻克的课题。
