安罗替尼维持治疗广泛期小细胞肺癌的疗效及对患者血清CEC、ES水平的影响
2022-03-21徐红燕王文静栾云雁宋成村殷军蕾高绍荣
徐红燕,王文静,姜 秀,栾云雁,郭 辉,孙 志,宋成村,殷军蕾,高绍荣
(威海市立医院化疗三科,山东 威海 264200)
小细胞肺癌(small cell lung cancer,SCLC)是肺癌的一种,发病率约占肺癌的1/5[1],其病因较明确,主要与吸烟有关,尤其是长期大量的吸烟。小细胞肺癌生长速度较快、恶性程度较高且具有较强侵袭性,早期易转移。早期的小细胞肺癌可采取手术治疗,但是其早期不易发现,部分患者确诊时已经发生局部的转移和远处的扩散;故化疗是其主要的治疗方式,但患者化疗后复发率高,预后差,生存期短。
新生血管可为肿瘤生长提供营养成分,因此抑制肿瘤血管的生成可延缓肿瘤生长。安罗替尼是一种新型的小分子多靶点抗血管靶向药,于2018年5月批准上市用于治疗小细胞肺癌,且效果显著[2]。循环内皮细胞(CEC)主要分布于外周血管。通过检测血管中CEC的数量可判定血管内皮损伤情况,故该细胞常被作为检测血管内皮细胞损伤的细胞[3]。内皮抑素(endostatin,ES)可抑制内皮细胞迁移和增生,拮抗肿瘤血管新生,减少肿瘤血液供应,进而抑制肿瘤生长[4]。本研究旨在研究安罗替尼维持治疗SCLC的效果及其对患者血清CEC、ES水平的影响,以期为临床治疗提供参考。
1 资料
1.1 一般资料
收集2018年6月至2019年2月于威海市立医院治疗的SCLC患者86例,按照随机对照表法将其分为观察组和对照组,每组各43例;因失访、中途退出等原因2组各剔除3例,2组最终共纳入80例。观察组服用安罗替尼,对照组给予依托泊苷治疗。2组患者的基线资料见表1,具有可比性。本研究获得本院伦理委员会的批准。

表1 2组基线资料比较 例
1.2 纳入和排除标准
纳入标准:1)经病理组织学和(或)细胞学诊断为广泛期小细胞肺癌;2)患者已进行5~6周期依托泊苷+顺铂的标准化疗,未使用其它血管靶向药;3)心电图、肝肾功能、凝血功能和血常规基本正常;4)预计生存期大于4个月;5)依从性较好,可接受随访;6)所有入组患者和家属均知晓此项研究并签署相关知情同意书。
排除标准:1)患者对所用药物过敏;2)患者合并有心血管系统疾病或者肝肾功能不全,或者血液系统疾病;3)患者同时合并有其它恶性肿瘤;4)有精神障碍难以控制者;5)治疗依从性差者。
2 方法
2.1 治疗方案
观察组每日口服12 mg的安罗替尼(正大天晴药业集团股份有限公司,批号:20180327),服用14 d停用7 d,一个疗程为21 d,共6个疗程。对照组予以依托泊苷维持治疗(江苏恒瑞医药股份有限公司,批号:20180504)60~100 mg·m-2,口服,每日1次,连用10日,每3~4周重复,共治疗18周,定期复查。依据NCI常见不良反应事件评价标准(CTCAE)4.0对患者的不良反应进行评价,不良反应为3~4级时患者停止治疗;不良反应为2级及以下时调整患者的给药剂量,若经过2周,患者未恢复,则停止治疗,该患者研究终止。患者疗效评价表现为疾病进展时,表示患者不适合继续治疗,则该患者研究终止。
2.2 观察指标
2.2.1 疗效评价
2组患者在治疗后,进行医学影像学评估。本研究治疗效果的评价主要依据实瘤疗效评价标准[5],治疗效果的评价阶段可以细分为病情进展的情况评价(PD)、疾病稳定情况的评价(SD)、部分缓解(PR)和完全缓解(CR)。有效=CR+PR;治疗总有效率=(CR+PR)例数/总例数×100%。
2.2.2 生存情况
无进展生存期(PFS)为本次研究的主要终点,所有患者在接受治疗后均进行门诊或电话随访,每3个月随访1次,主要包括影像、肿瘤标志物、血常规、肝肾功能等检查,询问患者近期健康状况及生活情况,末次随访时间为2019年11月30日。计算PFS。
2.2.3 肿瘤相关指标检测
采集2组患者治疗前、治疗(2、4、6周期)后空腹静脉血5 mL,采用高速离心机(LX-500小型高速离心机海门其林贝尔)以3000 r·min-1离心10 min分离血清,采用经酶标记免疫分析技术(贝克曼库尔特公司UniCel DxI 800免疫发光仪器)检测血清中神经元特异性烯醇化酶(NSE)。NSE试剂盒购于上海研生实业有限公司,批号为2017036802。
2.2.4 血清CEC、ES检测
采集2组患者治疗前、治疗后(2、4、6周期)空腹静脉血5 mL。采用PercoⅡ密度梯度离心法分离CEC;采用免疫发光仪(贝克曼公司)检测ES水平。
2.2.5 生活质量评估
采用KPS评分[6]评估2组患者治疗(2、4、6周期)后生活质量;KPS评分与患者生活质量成正比。
2.2.6 不良反应
记录2组患者治疗期间的不良反应。不良反应的评定方法参照美国国立癌症研究所指定的常见毒性反应标准[7]。
2.3 统计学方法

3 结果
3.1 2组疗效比较
对照组的治疗总有效率(35.00%)低于观察组(62.50%),差异有统计学意义(P<0.05)。见表2。

表2 2组疗效比较 n(%)
3.2 2组生存情况比较
观察组和对照组分别有4例在治疗6周期后脱落无法进行计算,可评价PFS共72例,对照组的中位PFS(mPFS)为(3.8±0.7)个月,95%CI为2.6~3.1,低于观察组的mPFS[(6.1±0.6)个月],95%CI为4.8~5.2,差异有统计学意义(P<0.05)。
3.3 2组肿瘤相关指标比较
观察组在治疗4周期和6周期后NSE水平均低于对照组(均P<0.01)。见表3。

表3 2组NSE水平比较
3.4 2组血清CEC、ES水平比较
2组治疗前血清中CEC、ES水平比较,其差异无统计学意义(P>0.05);观察组在治疗4周期和6周期后CEC水平均低于对照组(均P<0.01),但ES水平高于对照组(均P<0.01)。见表4和表5。
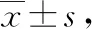
表4 2组患者血清CEC水平比较个·μL-1

表5 2组患者血清ES水平比较
3.5 2组生活质量评估比较
观察组的KPS评分在治疗4周期和6周期均优于对照组(均P<0.05)。见表6。

表6 2组KPS评分比较 分
3.6 2组不良反应比较
观察组的不良反应(甲状腺功能减退症、腹泻、蛋白尿、高血压、手足皮肤反应、皮疹、血促甲状腺激素升高)均显著高于对照组(均P<0.05)。见表7。观察组总不良反应率和3/4级不良反应率分别为70.0%(28/40)和5.0%(2/40),调整剂量(12 mg调整为10 mg)后其不良发应有所缓解;对照组总不良反应率和3/4级不良反应率分别为60.0%(24/40)和2.5%(1/40)。2组总不良反应发生率与3/4级不良反应发生率比较,差异无统计学意义(P>0.05)。

表7 2组不良反应比较 n(%)

表7(续)
4 讨论
相比于非SCLC,SCLC的细胞小,倍增时间短,恶性程度高,且患者常伴有内分泌异常或者类癌综合征,约70%~90%的SCLC患者在诊断时已出现转移,确诊后如不及时治疗则严重危及到患者生命[8]。SCLC治疗具有较高的复发率,通常一线化疗后6个月肿瘤常复发,且复发患者化疗的耐药率更高。维持治疗是一线化疗完成后,继续接受药物治疗,其目的在于使患者获得最大的肿瘤缓解率和生存期。
安罗替尼是一种新型小分子的多靶点酪氨酸激酶抑制剂,可多靶点全面性抑制血管生成,进而抑制癌细胞的增殖和转移[9]。有研究[10]发现安罗替尼治疗SCLC患者2个月后,患者体内的癌细胞生长受到明显抑制,各项指标均优于对照组。SPIGEL等[11]发现安罗替尼治疗可延缓SCLC患者1年存活率达50%。本研究结果显示,观察组治疗总有效率高于对照组(62.50%比35.00%),mPFS长于对照组[(6.1±0.6)个月比(3.8±0.7)个月]。这些结果表明安罗替尼维持治疗对SCLC有较好的效果,可延长患者的生存期。
血管生成的病理过程较复杂,受许多因子调控。其中,VEGF是一种促血管生成因子,而ES对血管生成有明显的抑制作用[12-15]。CEC主要分布在外周血管,可用于判定血管内皮损伤[16]。CALLES等[17]研究发现,SCLC患者血清中CEC水平明显高于正常人。NSE为常见的临床肿瘤标志物,是临床广泛应用的肺癌患者治疗疗效及预后评价的重要指标[18]。本研究观察组在治疗4周期和6周期后CEC和NSE水平均低于对照组(均P<0.01),ES水平均高于对照组(均P<0.01),表明安罗替尼维持治疗可提高SCLC患者体内的ES水平,降低CEC和肿瘤标志物NSE水平,从而达到抑制肿瘤细胞生长的作用。其机制可能是安罗替尼通过阻断VEGFR的磷酸化来拮抗下游信号的传导,包括介导血管内皮细胞增殖的Raf/Met/ErK信号通路、刺激血管内皮细胞迁移的p38-MAPK信号通路[2],从而抑制SCLC肿瘤组织新生血管的生成[19-20]。
本研究所有患者进行研究前均进行了为期5~6周期的EP化学治疗,在研究期间观察组的主要不良反应为甲状腺功能减退症、腹泻、蛋白尿、高血压、手足皮肤反应、皮疹、促甲状腺激素升高,有2例患者出现3/4级不良反应,主要症状体现在四肢和皮肤上,通过后期的调整治疗患者已恢复正常,后期亦未出现其他不良反应。本研究还发现观察组的KPS评分在治疗4周期和6周期均优于对照组,表明安罗替尼维持治疗未并发严重不良反应,可有效提高患者生活质量。
综上,安罗替尼维持治疗广泛期SCLC患者具有较好的疗效,可降低患者血清CEC水平,升高ES水平。
