口服普萘洛尔治疗婴幼儿血管瘤及对血清VEGF及PEDF的影响
2022-03-21李丽琴杨彩丽黄爱花
李丽琴,谭 鑫,杨彩丽,黄爱花,程 鹏,张 莲,罗 宏
(1.长沙市第一医院a.皮肤科; b.儿科; c.检验科,长沙 410005; 2.南昌大学第一附属医院a.皮肤科; b.儿科,南昌 330006)
血管瘤是婴幼儿最常见的良性肿瘤,一般在出生后1~2周发病,增生较快,前12个月为增生期[1]。口服普萘洛尔治疗婴幼儿血管瘤安全、有效,不良反应小,是治疗血管瘤的一线药物[2-3]。血管内皮生长因子(VEGF)为特异性生长因子,主要作用于血管内皮细胞,能够刺激内皮细胞增殖,还具有强烈的趋化和促分裂作用,可刺激肿瘤血管生长,在增生期血管瘤血清中的表达明显升高[4]。有研究[5-6]显示,普萘洛尔可能通过下调增生期血管瘤瘤体中VEGF的表达促进瘤体消退,然而,血管生成抑制因子(PEDF)的作用和影响却较少被关注。本研究观察增生期血管瘤患儿血清VEGF、PEDF水平的变化及与口服普萘洛尔疗效的关系,并探讨其疗效机制。
1 资料与方法
1.1 病例来源
选取2019年1月至2020年6月在长沙市第一医院及南昌大学第一附属医院皮肤科、儿科收治的增生期血管瘤患儿72例(增生组),消退期血管瘤患儿60例作为消退组,同期行健康体检的婴幼儿40例为正常对照组。增生组,年龄1个月~1岁,年龄(3.19±1.48)个月;男36例,女36例;头面部40例,颈部12例,躯干10例,四肢6例,外阴4例;消退组年龄1~3岁,平均(14.18±1.35)个月;男31例,女29例;正常对照组,年龄1个月~3岁,平均(3.58±1.51)个月;男22例,女18例。3组性别比较差异无统计学意义(P>0.05)。本研究经长沙市第一医院伦理委员会批准,且患儿家长知情同意并签署知情同意书。
1.2 病例选择标准
纳入标准:1)所有患儿均符合2016年国际血管异常研究协会(ISSVA)制定的血管瘤相关诊断标准[7];2)诊断为血管瘤(草莓状、海绵状、混合型),多发和(或)瘤体直径超过2 cm,或者瘤体部位在眼、鼻、口腔、女婴乳房、外阴等部位,不适应手术及激光等有损伤性治疗的血管瘤患儿。
排除标准:患有心脏病变(传导阻滞)、气道敏感性疾病、通气困难或其他肺部疾病(尤其有哮喘者)者。
1.3 治疗方法
增生组给予普萘洛尔口服,起始剂量为0.5 mg·kg-1·d-1,分2次口服,服药时心电监护,无不良反应时,年龄不足3个月患儿可选择1.0 mg·kg-1·d-1剂量,大于3个月患儿可选择1.5~2.0 mg·kg-1·d-1剂量,分2~3次口服,治疗期间定期复查血清电解质、血糖及肝肾功能,如有不良反应则及时处理,必要时停用药物。
1.4 标本采集及检测
增生期血管瘤组(治疗前,治疗后第4周、第8周、第12周)、正常对照组、消退期血管瘤组分别抽取空腹静脉血3 mL,以3000 r·kg-1速度离心10 min,取上层血清置于-20 ℃冰箱内,避免反复冻融,实验试剂选择人VEGF ELISA试剂盒(英国Abcam公司,产品编号:ab246535)和人PEDF ELISA试剂盒(英国Abcam公司,产品编号:ab222510),以酶联免疫吸附法(ELLSA)检测血清VEGF、PEDF水平。
1.5 疗效评价
参照国际常用4级分类标准:Ⅰ级(差),瘤体缩小<25%;Ⅱ级(中),瘤体缩小26%~50%;Ⅲ级(好),瘤体体积缩小51%~75%;Ⅳ级(优),瘤体缩小76%~100%[8]。有效率=(Ⅲ级+Ⅳ级)例数/总例数×100%。
1.6 统计学方法
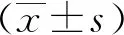
2 结果
2.1 增生组疗效
治疗12周时,增生组治疗总有效率为93.06%,见表1。

表1 增生组治疗12周时的临床疗效 n(%)
2.2 3组患儿血清VEGF、PEDF水平比较
治疗前,增生组血清VEGF水平高于正常对照组及消退期组(P<0.05),血清PEDF水平低于正常对照组及消退期组(P<0.05)。见表2。

表2 3组患儿血清VEGF、PEDF水平比较
2.3 增生组治疗前后血清VEGF、PEDF水平变化
增生组治疗前、治疗4周、治疗8周、治疗12周,血清VEGF水平依次降低(P<0.05),血清PEDF水平依次升高(P<0.05)。治疗12周时血清VEGF水平较治疗前下降(296.64±72.91)pg·mL-1、血清PEDF上升(7.61±1.43)μg·mL-1。见表3。

表3 增生组治疗前后血清VEGF、PEDF水平比较
2.4 增生组治疗12周时血清VEGF下降水平、PEDF上升水平与疗效的相关性分析
Spearman等级相关性分析结果显示,增生组治疗12周时血清VEGF下降水平与疗效呈正相关(r=0.489,P<0.05),血清PEDF上升水平与疗效呈正相关(r=0.380,P<0.05)。
2.5 增生组治疗12周时血清VEGF下降水平与PEDF上升水平的相关性分析
Pearson相关性分析结果显示,增生组患儿治疗12周血清VEGF下降水平与PEDF上升水平呈正相关(r=0.369,P<0.05)。见图1。

图1 治疗12周时增生组血清VEGF下降水平与PEDF上升水平的相关性分析
3 讨论
血管瘤对患儿的美容及心理影响较大,尤其发生在重要解剖部位(如面部、乳房、关节、外阴等)的增生期血管瘤,甚至会引起功能障碍,因此需要早期干预治疗。本研究使用普萘洛尔治疗72例增生期血管瘤患儿,治疗总有效率为93.06%,疗效显著。
有研究[9-10]表明,VEGF的表达与血管瘤发病关系密切,增生期血管瘤患者血清及组织中VEGF表达均明显升高。笔者的既往研究[6]也提示,口服普萘洛尔治疗增生期血管瘤的机制可能是下调患者血清VEGF水平。PEDF为重要的抗肿瘤因子,可通过促进细胞凋亡、减少肿瘤细胞侵袭及转移、抑制血管新生等多种机制抑制肿瘤生长,还可通过水解血管内皮生长因子受体-1的蛋白抑制血管增生,且在血管瘤发展过程中,PEDF水平升高可抑制VEGF表达[11-12]。本研究结果显示,增生组患儿血清VEGF水平高于正常对照组、消退组,血清PEDF水平低于正常对照组、消退瘤组,提示VEGF、PEDF与血管瘤疾病进展有关。增生组口服普萘洛尔治疗前、治疗4周、治疗8周、治疗12周血清VEGF逐渐降低,血清PEDF水平逐渐升高,提示,普萘洛尔治疗血管瘤疗效显著,可能与血清VEGF水平下调、PEDF水平升高有关,这与周昱川等[13]的研究结果一致。
本研究结果还显示,增生组治疗12周血清VEGF下降水平与疗效呈正相关(r=0.489,P<0.05),血清PEDF上升水平与疗效呈正相关(r=0.380,P<0.05);增生组治疗前与治疗12周时血清VEGF下降水平与PEDF上升水平呈正相关(r=0.369,P<0.05)。提示,血清VEGF下降水平和血清PEDF上升水平可能反映口服普萘洛尔治疗增生期血管瘤患儿的疗效,且血清VEGF下降的水平与PEDF水平上升的水平可能存在相关性。进而推测,口服普萘洛尔可能通过上调患儿PEDF水平,降低患儿VEGF水平,抑制血管瘤瘤体生长,促进瘤体消退。
虽然本研究发现PEDF上调水平与疗效等级具有正相关性,但仍需扩大病例数同时从PEDF核酸水平进行研究,观察其他抑血管形成因子及促血管形成因子间的相互作用,从而对普萘洛尔治疗增生期血管瘤的作用机制做更全面的评估。
