不同来源杀鲑气单胞菌毒力因子的比较基因组学研究
2022-03-20郝婧薇贺凤兰傅松哲申旭东
郝婧薇,王 艺,贺凤兰,傅松哲,申旭东,5,刘 鹰
( 1.大连海洋大学 海洋科技与环境学院,辽宁 大连 116023; 2. 大连海洋大学,设施渔业教育部重点实验室,辽宁 大连 116023; 3.河北科技师范学院 海洋资源与环境学院,河北 秦皇岛 066000; 4.南昌市疾病预防控制中心,江西 南昌 330038; 5.中国水产科学研究院 营口增殖实验站,辽宁 营口 115004 )
杀鲑气单胞菌(Aeromonassalmonicid)是一种嗜冷性革兰氏阴性菌,是气单胞菌属少数不运动的菌株之一,在全球均有分布且宿主范围广泛,它包括杀鲑亚种(A.salmonicidassp.salmonicida)、无色亚种(A.salmonicidassp.achromogenes)、杀日本鲑亚种(A.salmonicidassp.masoucida)、史密斯亚种(A.salmonicidassp.smithia)和溶果胶亚种(A.salmonicidassp.pectinolytica)这5个亚种[1],其中杀鲑亚种是鲑鳟鱼类养殖过程中的重点防控病原。但近年来研究发现,杀日本鲑亚种也会造成鲑鳟鱼类大面积死亡[2]。杀鲑气单胞菌不但会感染鲑鳟鱼类,还会引起非鲑鳟鱼类感染,主要表现为皮肤感染(皮肤溃疡),如鲤(Cyprinuscarpio)上皮和真皮出现溃疡[3],仿刺参(Apostichopusjaponicus)表皮出现溃疡[4]等。对16S rDNA序列的遗传研究发现,不同亚种之间的基因组序列高度相似,且有研究表明,杀鲑气单胞菌可以由淡水转移到海水,反之亦然[5]。
为对比不同来源的杀鲑气单胞菌之间毒力基因的差异,笔者选择3种来源的4株杀鲑气单胞菌进行比较基因组学研究,包括1株分离自辽宁营口凡纳滨对虾(Litopenaeusvannamei)养殖水体的杀鲑气单胞菌YK-48[6],1株自辽宁鞍山患病金鱼(Carassiusauratus)病灶处分离的杀鲑气单胞菌AS.17[7],以及2株自山东烟台大西洋鲑(Salmosalar)肝脏分离的杀鲑气单胞菌S68和S121[8]。首先对YK-48进行了全基因组测序和表征,随后将其与其他3株已测序的杀鲑气单胞菌进行基因组学比较,并通过系统发育、耐药基因和毒力基因的分析,将NCBI数据库中的致病性气单胞菌与分离菌株进行比较,以探明其在进化上的关系,旨在为杀鲑气单胞菌毒力基因和流行特征研究提供参考,并为其防控积累参考数据。
1 材料与方法
1.1 菌株分离
杀鲑气单胞菌菌株YK-48于2019年分离自辽宁营口大辽河入海口的凡纳滨对虾养殖水体[6],AS.17(登录号:SAMN10245534)于2017年分离自病死金鱼[7],S68(登录号:SAMN07276873)和S121(登录号:SAMN07276469)[8]于2015年分离自烟台大西洋鲑养殖场。除YK-48外,其他菌株均造成了养殖动物的大规模病害。分离株置于25%的甘油-LB肉汤中,-80 ℃保存备用。
1.2 细菌形态、菌落特征与理化特性检查
取纯化后菌株移接于LB琼脂斜面,28 ℃培养24 h,随后制备成涂片标本,通过革兰氏染色法镜检观察细菌形态特征;取纯化后菌株,分别接种于LB琼脂、哥伦比亚血琼脂平板及致病性嗜水气单胞菌鉴别培养基(青岛海博公司),28 ℃培养24 h,观察生长状况及菌落形态特征;取纯化后菌株,参照《常见细菌系统鉴定手册》[9]及《人及动物病原细菌学》[10]对菌株的葡萄糖、氧化酶、脲酶等理化特性进行测定。
1.3 药物敏感性测定
取培养 48 h 后的菌株,以无菌生理盐水制成菌悬液,使用K-B法对菌株进行20种抗菌药物敏感性测定,取50 μL菌悬液涂布于HM平板上,将抗生素纸片(杭州滨合微生物试剂公司)贴于培养基表面,每个平板上5种抗生素,倒置培养24 h后记录纸片周围抑菌圈直径,以抑菌圈直径大小作为敏感与耐药的判定指标[11]。
1.4 全基因组测序
取纯化菌株接种于LB琼脂培养基,28 ℃培养12 h,使用细菌基因组DNA小量纯化试剂盒(大连宝生物工程技术有限公司),按照NO.9763说明书进行菌株全基因组DNA提取,作为PCR模版。通过琼脂糖凝胶电泳和光密度值测定鉴定DNA质量。经DNA电泳检测、Qubit 2.0总量检测合格后,将DNA样品用Covarisg-TUBE打断成构建文库所需大小的目的片段,使用DNA黏合酶将发卡型接头连接在DNA片段两端,使用AMpurePB磁珠对DNA片段进行纯化选择,构建SMRTBell文库。随后将样品送往京通生物科技有限公司,使用PacBioRSII平台进行测序。将Pacbio获得的下机数据使用HGAP4[12],CANU (V1.6)[13]软件进行拼装,得到scaffold序列。最后使用Pilon (version 1.22)[14]软件对结果进行校正,最终拼接得到完整序列。测序数据已上传至GenBank,登录号:SAMN10245535。
1.5 基因组系统发育分析
总共分析38株杀鲑气单胞菌,其中包括从NCBI数据库中获得的25株公共基因组和1株本试验测序菌株。以A449基因组作参考基因组,分析单核苷酸多态性(SNP)。首先使用Center for genomic epidemiology (https://www.genomicepidemiology.org/)进行单核苷酸多态性分析。具体的操作步骤为:使用Burrows-Wheeler的BWA比对工具将其他菌株的基因组与参考基因组进行比对得到基因图谱,再使用SAMtools进一步过滤掉低质量序列(质量得分<30或覆盖<10片段)。序列经过滤后,从34个基因组中总共鉴定出4912个单核苷酸多态性位点,其中位于重复区域的单核苷酸多态性位点被去除。使用RAxML (版本7.2.8),以最大似然法构建系统进化树。
1.6 毒力基因的注释与分析
将基因组DNA和NCBI数据库中的基因组数据上传至毒力因子数据库(VFDB),通过 VFDB中的 VFanalyzer进行毒力基因与供试菌全基因组的双序列比对,寻找其是否含有相关的毒力基因。
1.7 耐药基因分析
进行药物敏感性测试后,结合ResFinder (https:∥cge.cbs.dtu.dk/services/ResFinder/)查找杀鲑气单胞菌的耐药基因,查看其是否含有相关耐药基因。
1.8 细菌黏附性的测定
细菌黏附试验参考文献[15-16]。先将人喉表皮样癌细胞(Hep-2细胞)培养于含10%胎牛血清的DMEM培养液的24孔细胞培养板中传代。将传代好的Hep-2细胞以每孔8×104个细胞铺于24孔组织培养板中并生长24 h。使用无菌10 mmol/L磷酸缓冲盐溶液洗涤除去未附着的单层细胞,然后加入400 μL无酚红的MEM。
制备成牛血清的寡营养培养基(Serum-SAPI):6.25 mmol/L NH4NO3,1.84 mmol/L KH2PO4,3.35 mmol/L KCl,1.01 mmol/L MgSO4和2.77 mmol/L葡萄糖,加入30%体积的成牛血清(Biological industries,以色列),以模拟宿主体内环境,配制好后将pH调至7.5,并过滤除菌。杀鲑气单胞菌菌株在上述培养基中以30 ℃生长过夜,随后用磷酸缓冲盐溶液洗3次后,重悬菌体。用DMEM将细菌培养物稀释至600 nm光密度值为0.3,然后使用杀鲑气单胞菌菌株以10的感染复数(MOI)感染Hep-2细胞。将平板以600 r/min(离心半径15 cm)离心 10 min,并于5% CO2湿化培养箱中37 ℃孵育2 h。随后,用磷酸缓冲盐溶液洗涤细胞5次,加入0.02% Triton X-100裂解。通过连续稀释在LB琼脂平板上平板计数[16]。所有试验重复5次。
1.9 统计学分析
所有试验结果以平均值±标准差表示。使用SPSS 17.0对所有试验数据单因素方差分析,若差异显著,则进行Duncan′s多重检验,显著水平为0.05。
2 结 果
2.1 菌落形态及基本特征
菌株YK-48在NA平板上生长的菌落均呈圆形,淡黄色,直径约1 mm,无运动能力。对菌株进行的理化分析(36种)发现,YK-48对甲基红、D-葡萄糖产酸、麦芽糖、氧化酶、半乳糖、D-甘露醇、硝酸盐还原性、0% NaCl下生长、1% NaCl下生长、V-P反应、海藻糖和L-阿拉伯糖(共12种)呈阳性(表1)。将16S rDNA的结果在NCBI数据库中进行BLAST序列同源性检索,结果表明,YK-48与杀鲑气单胞菌A449的同源性为97.52%,结合16S rDNA BLAST分析和生理生化试验结果,可以确定病原菌为杀鲑气单胞菌。为进一步确定亚种类型,对杀鲑气单胞菌YK-48进行全基因组测序。

表1 分离菌株的生理生化特性Tab.1 Physiological and biochemical characteristics of the isolates
2.2 基因组基本特征
全基因序列分析,YK-48的基因组序列总长度为 4 751 295 bp,GC含量为60.6%,基因数量为4431个,RNA数量为144个,并对基因组序列,基因预测及非编码RNA的预测信息进行整理(图1)。对YK-48进行注释,发现其含有4276条预测蛋白,占总蛋白数的90.39%。YK-48的可编码序列(CDS)根据相邻蛋白的聚簇(COG)可分为21个已知功能组,4个未检测出预测蛋白组和直系同源蛋白分组比对(eggNOG)数据库内无对比结果组1个,共26个组。功能分类结果见图2。
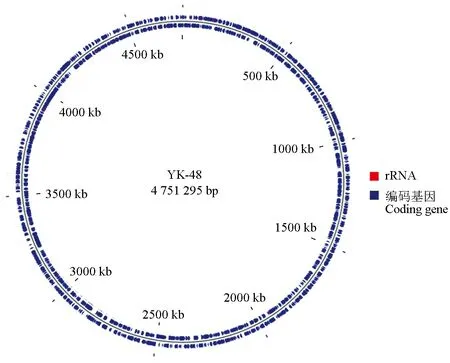
图1 杀鲑气单胞菌菌株 YK-48 基因组环状图谱Fig.1 Genome circular map of A. salmonicida strain YK-48从内到外,第1圈代表刻度;第2、3圈分别代表负链和正链可编码序列在基因组上的位置;可编码序列在基因组正向链中.From the inside to the outside, the first circle denotes the scale; the second circle and the third circle denote the CDS in the reverse and forward strand, respectively; the CDS is located in the forward strand on the genome.
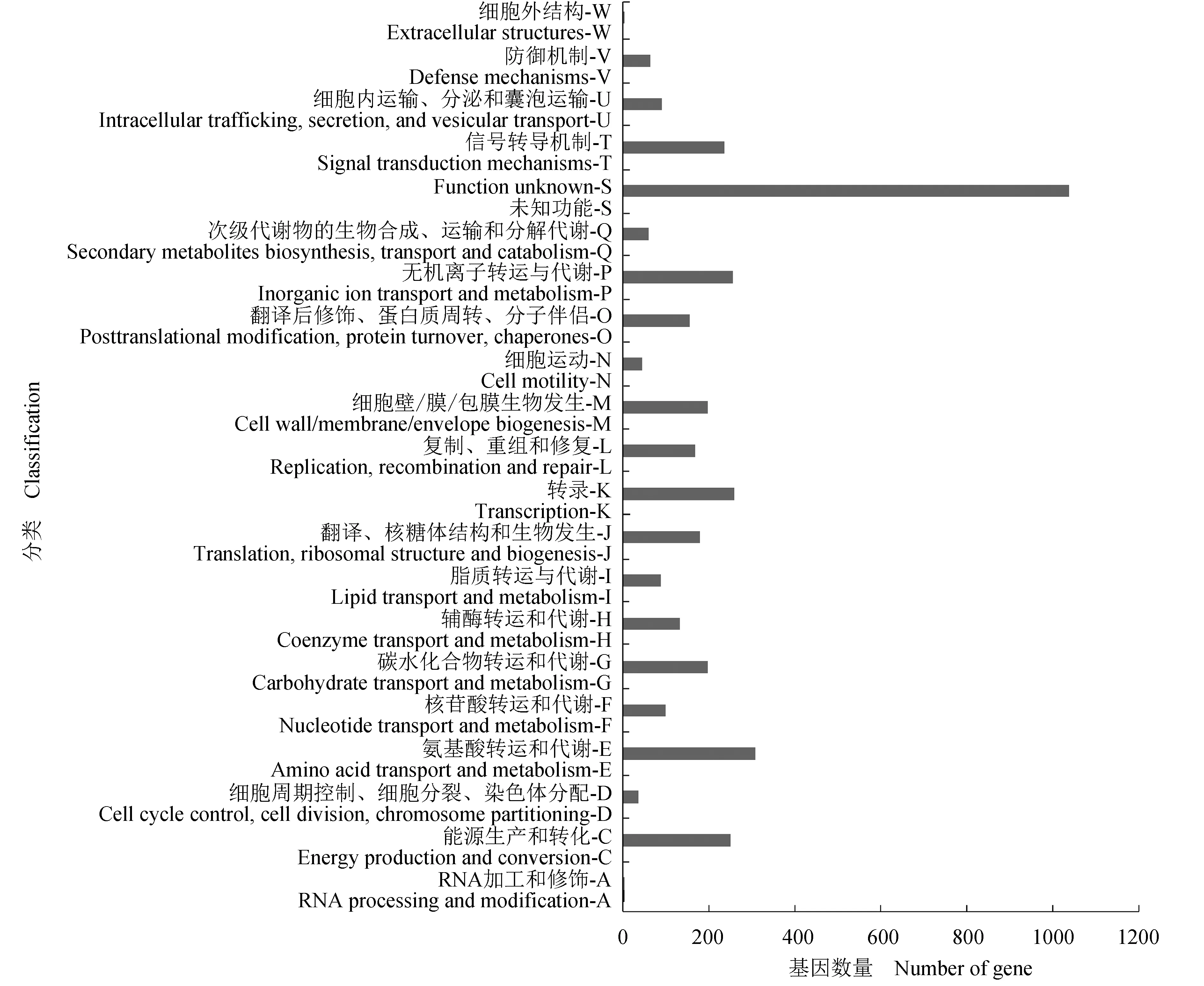
图2 菌株YK-48基因组中预测蛋白的相邻蛋白聚簇功能分类Fig.2 Classification of cluster of orthologous groups of proteins(COG) functions of bar protein predicted by strain YK-48 genome
2.3 系统发育分析
使用广义时间可逆核苷酸取代模型和速率异质性的γ模型下构建杀鲑气单胞菌的系统发育关系,生成一个最大似然树,自举值为100。系统发育显示,38个杀鲑气单胞菌基因组共分为5个簇(图3),每一个簇对应一个亚种。对于本试验中的4株杀鲑气单胞菌,S68和S121与其他日本鲑亚种聚为一类,而AS.17、YK-48和杀鲑气单胞菌杀鲑亚种A449菌株聚为一类,与其他3个亚种亲缘关系较远,具有相对较远的遗传距离。由于AS.17和YK-48只有3个单核苷酸多态性位点的差异,因此可认定AS.17和YK-48为相同亚型中的同一克隆群。

图3 杀鲑气单胞菌基因组的系统发育关系Fig.3 Phylogenetic relationship of A. salmonicida genomes图3为杀鲑气单胞菌基因组的最大可能性系统发育,比例尺表示每个可变位点的取代.Fig.3 is the maximum likelihood phylogeny of A. salmonicida genomes,and the scale bar denotes substitutions per variable site.
2.4 毒力基因分析
对38株杀鲑气单胞菌基因组进行VFdb注释,对38个大类毒力相关基因进行筛选后,选择27种出现差异的毒力因子进行比较,对S68、S121、YK-48和AS.17之间毒力基因进行差异分析。YK-48和AS.17含有27种毒力因子中的59.26%(16/27),S68和S121含有51.85%(14/27)。与S68和S121相比,YK-48和AS.17缺少与黏附功能相关的基因FLP IV型连接相关(flp1) 基因、鞭毛外侧(flgC)基因和T3SS分泌系统相关(acr1)基因,而含有多热稳定性O抗原(脂多糖)(orfM)基因、卷曲纤维(csgG)基因、毒力加强(rtxA)基因、抗吞噬作用相关的荚膜多糖(rmlA)基因和免疫逃逸相关荚膜基因(图4)。
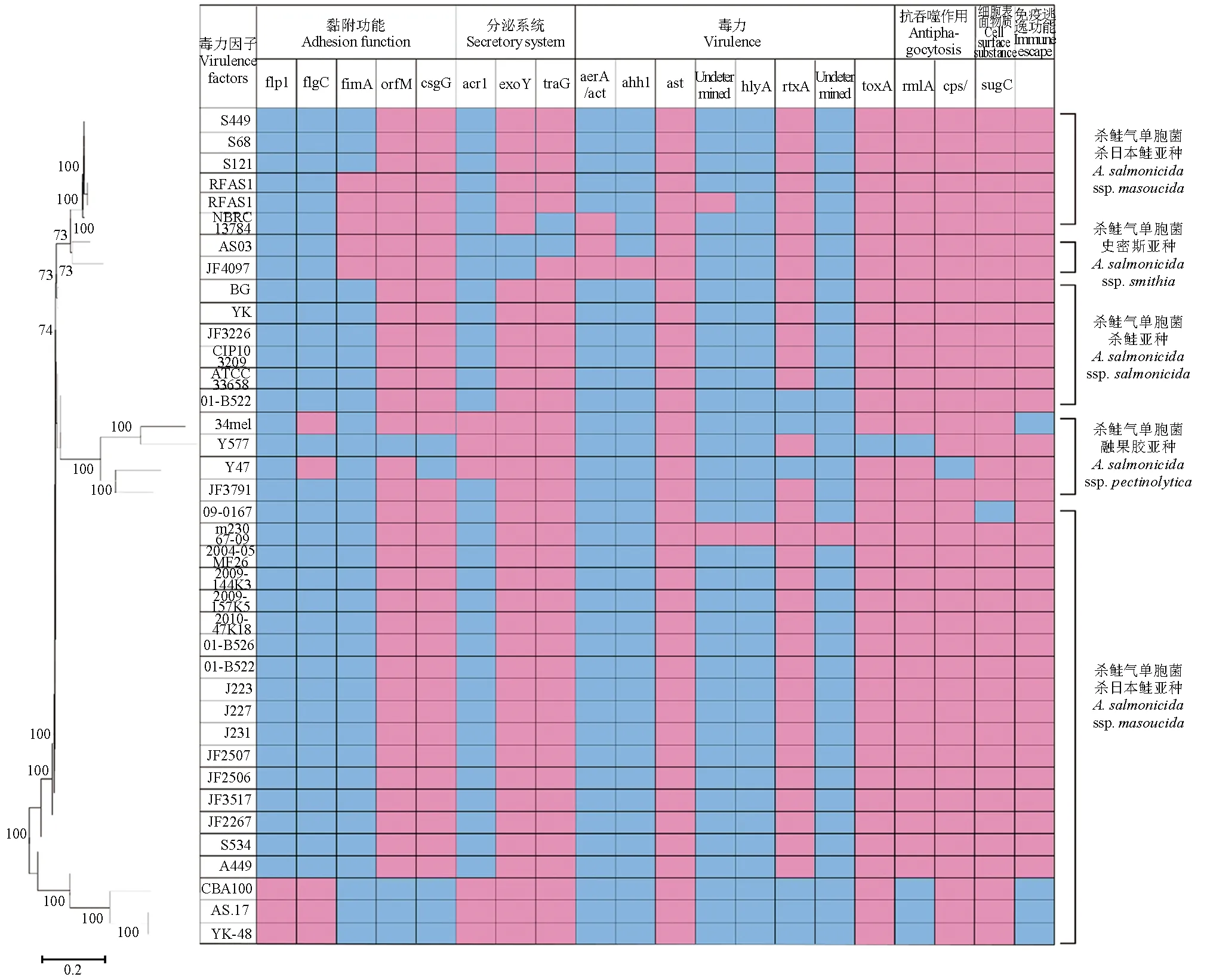
图4 杀鲑气单胞菌基因组毒力基因分析Fig.4 Virulence gene profile of A. salmonicida strains红色代表基因缺失,蓝色代表基因存在;下同.The missing gene is shown in red color, and the present genes are indicated by blue color; et sequentia.
在细胞黏附试验中,将S121的细胞黏附力定义为100%,以此为基准表征其他3株菌的黏附力。结果表明,YK-48和AS.17的黏附力显著低于S121和S68。因此,也进一步验证了YK-48和AS.17缺失黏附相关基因带来的表型变化。
2.5 耐药性和耐药基因分析
对YK-48进行药物敏感性测试表明,其对萘啶酸、洛美沙星、壮观霉素、氧氟沙星和环丙沙星高度敏感,对新霉素、红霉素、庆大霉素、妥布霉素、链霉素、复方磺胺甲恶唑和四环素中等敏感,对杆菌肽、万古霉素和青霉素耐药,由于YK-48对利福平低度敏感,因此认为其对利福平耐药(表2)。通过ResFinder对9大类抗生素的耐药基因进行分析,除去全部含有和全部不含有的基因发现,89.47%(34/38)的菌株含有β-内酰胺类抗生素耐药基因(共6种);23.68%(9/38)的菌株含有磺胺类抗生素耐药基因(共2种);

表2 YK-48对17种抗生素的药物敏感性Tab.2 Antimicrobial sensitivity of strain YK-48 to 17 kinds of antibiotics
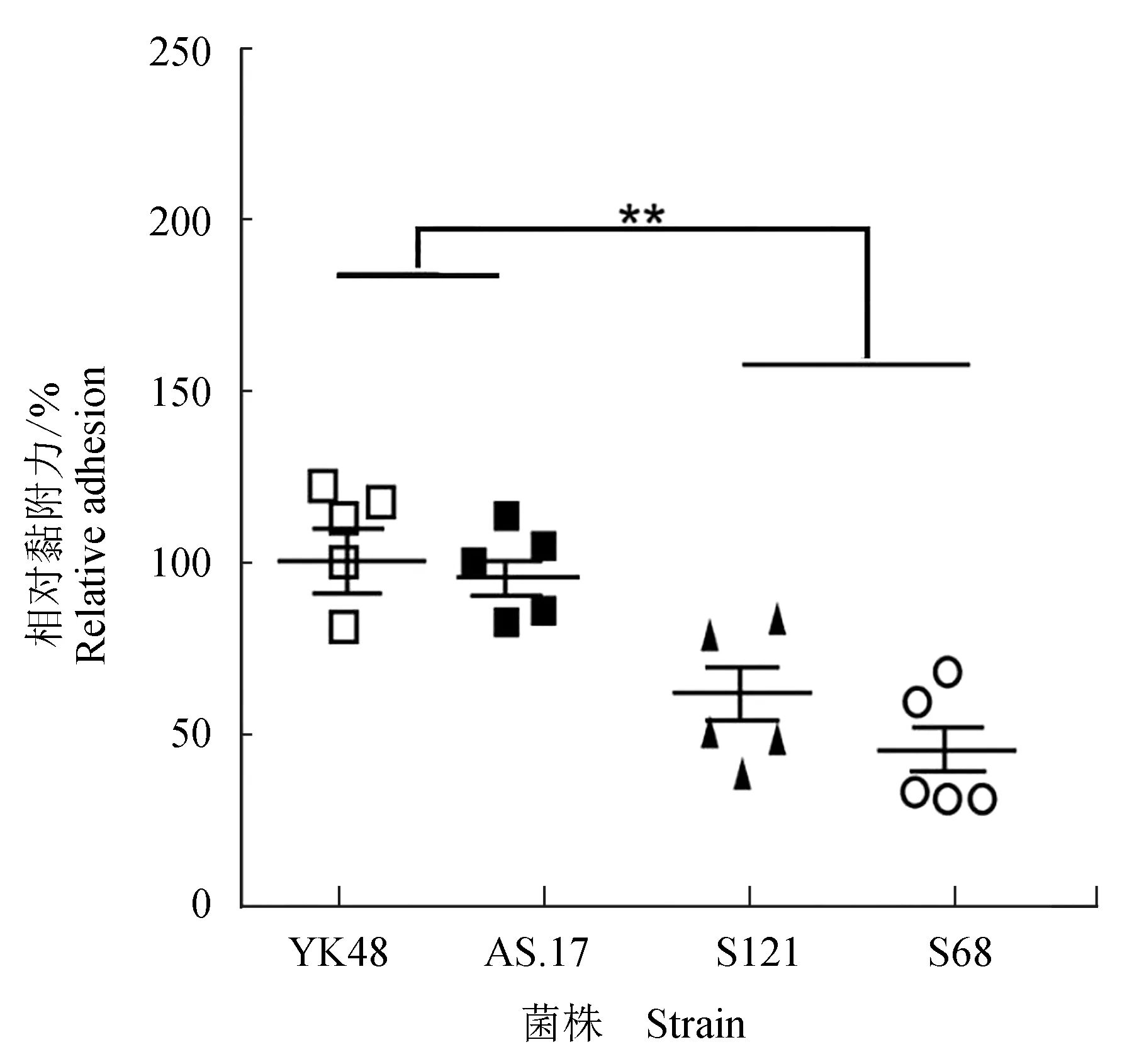
图5 S121、S68、YK-48和AS.17的细菌黏附性Fig.5 Bacterial adhesion of strains S121, S68, YK-48 and AS.17
18.42%(7/38)的菌株含有氨基糖苷类抗生素耐药基因(共8种);15.79%(6/38)的菌株含有大环内脂类抗生素耐药基因(共3种);21.05%(8/38)的菌株含有四环素类抗生素耐药基因(共5种)(图6)。
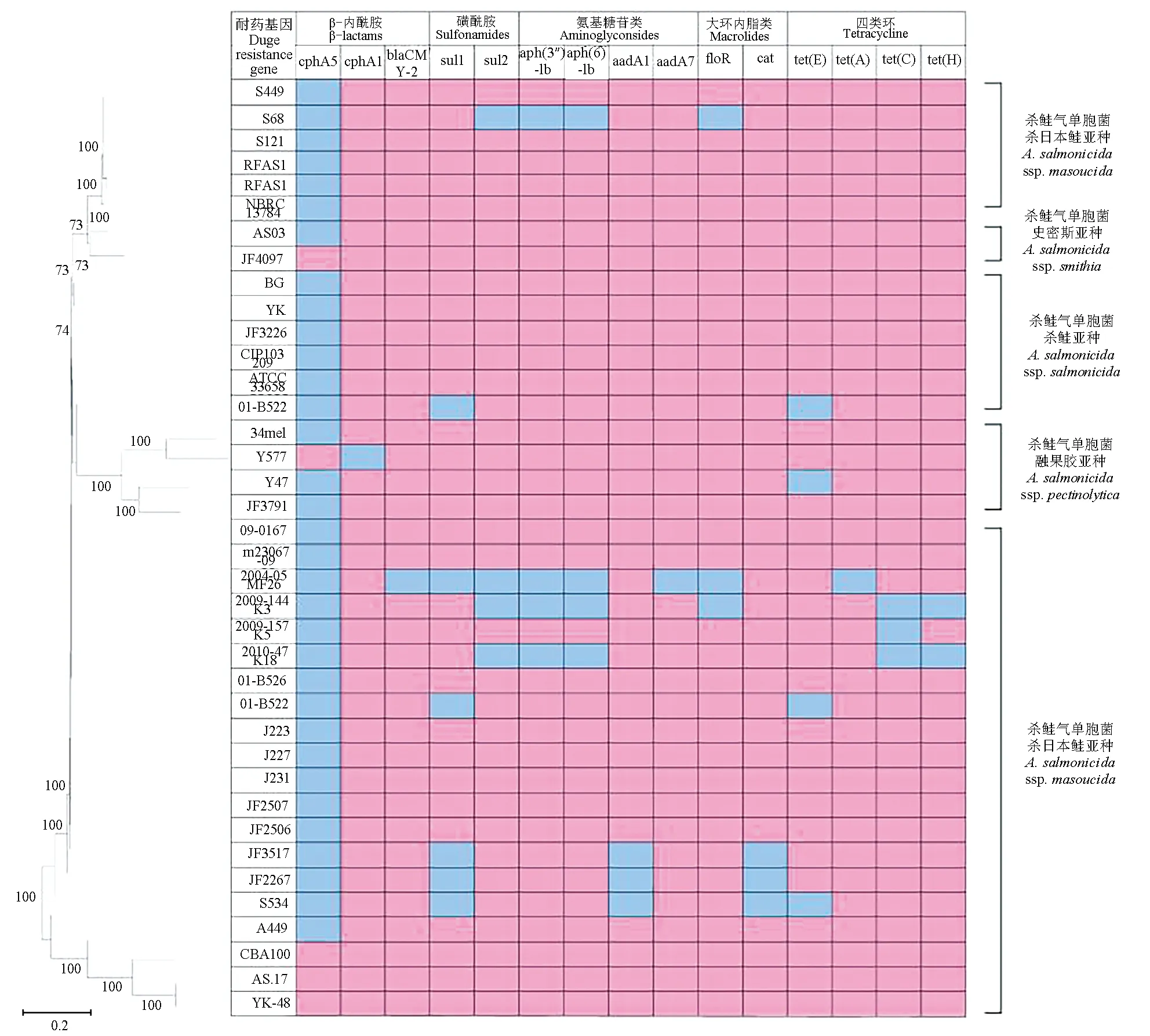
图6 杀鲑气单胞菌基因组的耐药基因分析Fig.6 Analysis of drug resistance genes of A. salmonicida strains
3 讨 论
杀鲑气单胞菌分布地域广泛,宿主众多,是多种水生动物的原发性疾病病原,每年由杀鲑气单胞菌造成的经济损失十分严重[17]。笔者对自患病金鱼和凡纳滨对虾养殖水体中分离出的杀鲑气单胞菌进行了常规的生物学性状检验,包括形态特征、生理生化特性等表型,结合基因组测序结果分析发现,AS.17和YK-48的基因组遗传特征极为相似。系统发育分析显示,AS.17和YK-48位于同一进化分支,由此推测他们有一定的同源性。养殖鱼类疾病暴发后,养殖尾水排放到环境中,未经处理的养殖尾水可能会流入养殖场附近的河水中,病原菌株很可能会顺着河水向下游传播,从而引起沿河养殖区域的流行性病害。YK-48与AS.17出现的地理位置相近,可能来自同一源头。因此,对AS.17和YK-48进行实时监控及有效地防治,控制病源外溢,是亟待解决的重大问题。
3.1 杀鲑气单胞菌的黏附能力可能会影响杀鲑气单胞菌的毒力
毒力因子往往是杀鲑气单胞菌致病的最主要因素。在AS.17和YK-48中均预测到122个毒力因子,但与自大西洋鲑中分离的2株菌株相比,均缺少黏附性、抗吞噬性以及免疫逃逸相关等毒力因子。有研究表明,由于毒力因子的溶血性和细胞毒性的存在,导致患疥疮病鱼类的胃肠中出现无食、少食、充满黏液、实质性组织点状出血,以及鳞片脱落和脏器外漏等症状[18-19]。YK-48和AS.17与其他菌株相比,缺少与黏附功能相关的基因flp1基因,这表明可能菌株YK-48和AS.17黏附功能较弱。
为了验证这一点,对4株菌株进行了黏附力试验。判断病原在宿主的黏附力需要在严格模拟宿主体内环境的条件下才能更好地体现,如极低的初始接种量(102cfu/mL)、CO2(5%)培养环境、寡营养的生长条件(SAPI培养基)以及成年牛血清的添加。为了尽可能还原杀鲑气单胞菌在宿主体内的黏附情况,使用了SAPI培养基,结果证实,缺失与黏附功能相关基因的YK-48和AS.17,在模拟宿主环境下黏附功能较弱。然而,Jin等[7]前期研究表明,AS.17也可造成观赏鱼的大规模病害,表明黏附功能可能不是造成致病性的决定性因素。由于观赏鱼和大西洋鲑均在高密度养殖条件下进行养殖,因此,养殖动物可能均受到胁迫,有可能黏附功能较弱的菌株也具备一定的致病性。
3.2 YK-48出现耐药基因的原因
对YK-48进行全基因组测序,在此基础上确定流行株的主要类型及特征。对测序结果进行分析发现,分离株在基因组结构、耐药基因等多方面几乎一致,推断YK-48很可能来源于上游观赏鱼养殖尾水排放。而与菌株AS.17和YK-48相比,来自烟台大西洋鲑分离的2株菌株含有氟苯尼考、恩诺沙星和四环素相关的耐药基因。这可能与养殖过程中抗生素的使用情况有关。前期调研发现,在观赏鱼和对虾养殖过程中,未使用抗生素[7];而在大西洋鲑养殖过程中,自2014年起氟苯尼考等抗生素连续用于杀鲑气单胞菌引起的病害防治,从而导致了相关耐药基因的出现[2]。
近年来,随着检测技术的发展,快速检测杀鲑气单胞菌的技术越来越多,如根据16S rRNA基因建立的多重PCR方法可以同时检测出包括杀鲑气单胞菌在内的3种常见鱼类致病菌[20];还有根据gyrB设计的高灵敏度的PCR检测技术等[21]。基因组测序成本在不断降低,通过全基因组测序对水产病原进行分型逐渐代替了其他分子生物学方法,成为水产病原流行病学鉴别方面的“终极”分型方法,随着测序技术的进步,已测序的水产病原越来越多。就细菌性病原而言,就包括了嗜水气单胞菌(A.hydrophila)、杀鲑气单胞菌、嗜冷黄杆菌(Flavobacteriumpsychrophilum)、鲑肾杆菌(Renibacteriumsalmoninarum)、哈维弧菌(Vibrioharveyi)、副溶血弧菌(V.parahaemolyticus)和鲁氏耶尔森菌(Yersiniaruckeri)等十余种[22]。通过对全基因组数据进行分析,比较不同菌株在全基因组水平单核苷酸多态性位点的差异,对其位点多样性进行分型,并采用一些生物信息学算法构建不同菌株之间的系统进化关系,已对多个水产病原在全球范围内的传播进行了精准分析。
3.3 全基因组的出现为杀鲑气单胞菌的研究提供有力支持
Brynildsrud等[23]对来自全球的68株引起鱼类肾脏坏死的鲑肾杆菌进行了全基因组测序,通过对其基因组单核苷酸多态性的分析,发现其存在2个主要进化谱系,其中谱系1主要分布在大西洋野生鱼类中;随着鱼类的迁徙和人类水产贸易的扩大,鲑肾杆菌随之由北美洲引入英国和挪威,揭示了鲑肾杆菌的跨境传播机制。Fu等[24]也采用基因组分型的方法对全球100株对虾相关副溶血性弧菌进行了系统性基因组流行病学分析,结果表明,目前中国、越南、泰国、马来西亚和墨西哥等地对虾中分离的副溶血性弧菌菌株分布于6个大类、11个不同的基因组克隆群中。研究结果证明了各国对虾分离的副溶血性弧菌不存在流行病学关联,相关疫病在各国独立发生。
此外,由于全基因组测序数据提供了完整的基因内容,因此可以直接挖掘毒力或抗性基因的数据以预测这些表型。某些移动遗传元件,如噬菌体、质粒或基因岛,通常携带增强的毒力或抗生素抗性的基因,可用来确定与关键表型特征相关的基因或单个单核苷酸多态性位点,如毒力、抗性或宿主适应基因,并且能够提供关于关键表型性状的预测信息。
4 结 论
笔者通过比较基因组学探究3种来源杀鲑气单胞菌之间的进化关系,将药敏试验与耐药基因结合,发现杀鲑气单胞菌YK-48对利福平、杆菌肽、万古霉素和青霉素耐药;对毒力基因进行分析,菌株AS.17和YK-48的毒力基因结果基本一致,与S68和S121相比,AS.17和YK-48特有抗吞噬作用基因和免疫调节相关表达的基因。通过细菌黏附试验,验证了菌株YK-48不含黏附相关基因。比较基因组学提供了关于关键表型性状的预测信息。
猜你喜欢
——和田盘羊
