团头鲂三倍体的微卫星遗传特征及生长性能分析
2022-03-20李宝玉郑国栋崔文涛邹曙明
李宝玉,郑国栋,崔文涛,陈 杰,邹曙明
( 上海海洋大学,农业农村部团头鲂遗传育种中心,农业农村部淡水水产种质资源重点实验室,水产科学国家级实验教学示范中心,上海 201306 )
三倍体鱼类通常存在减数分裂异常的现象,导致其性腺往往不能正常发育,因此利用其不育特性培育的三倍体品种可以避免养殖逃逸后在自然水域中过度繁殖造成的生态失衡,以及保护自然种群的种质资源,具有环境友好的特性。同时还可以保持品种自身优良性状,避免保种不当造成的种质衰退。理论上性腺发育异常使三倍体鱼类有可能将性腺发育所需能量转化到鱼体生长上,在性成熟时期比二倍体具有一定的生长优势[1]。实际上对于不同物种,三倍体化的影响并不相同。关于三倍体水产生物的育种,目前已经比较成熟,开展三倍体育种研究较早的物种如虹鳟(Oncorhynchusmykiss)、大西洋鲑(Salmosalar)、长牡蛎(Crassostreagigas)等已经在生产上得到推广应用[2-3]。对于三倍体鱼类的研究主要集中在诱导方法、生长、生理以及育性等方面,针对遗传结构的研究较少。Delomas[4]在溪红点鲑(Salvelinusfontinalis)、大鳞大马哈鱼(O.tshawytscha)不同倍性群体中分别利用扩增子测序进行基因分型,发现三倍体鱼类和正常二倍体在SNP位点上存在等位基因数目差异。
微卫星具有多态性好、杂合率高、共显性遗传等特点,广泛应用于水产动物育种研究,多用于比较群体之间的遗传多样性差异。如张倩倩等[5]利用18个微卫星标记分析了不同鳊鲂鱼类群体的遗传多样性并绘制了DNA指纹图谱;徐湛宁等[6]利用20个微卫星位点对2种雌核发育团头鲂(Megalobramaamblycephala)群体的纯合性进行了评价。目前,国内外对于利用微卫星标记探究某一物种三倍体和二倍体群体之间的遗传结构差异的研究较少,主要涉及在微卫星位点开发较为成熟的水产生物上,如刘慧等[7]利用微卫星分子标记对褐牙鲆(Paralichthysolivaceus)三倍体和二倍体的遗传结构进行了比较,结果表明三倍体诱导使褐牙鲆的遗传多样性有所下降;Hernández-Urcera等[8]利用5个家系的大菱鲆(Scophthalmusmaximus)三倍体和二倍体群体,开发出一个基于微卫星位点的倍性鉴定多重PCR体系,鉴定结果与流式细胞术鉴定结果相近,达到了较高的识别率;通过9个高度多态的微卫星位点,并根据位点的等位基因数目差异,Sanz等[9]在虹鳟上也取得了较好的倍性鉴定结果。团头鲂的微卫星位点开发较为丰富,但利用微卫星标记探究2种倍性遗传结构差异的研究尚未见报道。
团头鲂是一种草食性淡水鱼类,因其管理粗放、抗逆性强,被作为大宗淡水鱼类广泛养殖,2019年养殖产量762 858 t[10]。由于团头鲂性成熟周期长,增加了良种选育的难度,制约了团头鲂养殖业的发展。利用三倍体诱导技术诱导团头鲂三倍体,可以在短时间内实现良种选育,同时探究三倍体化对团头鲂的影响也有助于增进对鱼类三倍体的认识。邹曙明等[11]利用团头鲂四倍体与正常二倍体杂交获得了团头鲂倍间三倍体,此后张新辉[12]利用冷休克技术诱导获得了团头鲂三倍体,团头鲂三倍体的研究主要集中在诱导方法和基于倍性鉴定的血细胞形态研究。笔者以静水压处理诱导获得了团头鲂三倍体,选取多态性较高的微卫星位点初步探究团头鲂三倍体和二倍体之间遗传结构的差异,对团头鲂三倍体1龄至2龄的生长进行对比,以期为团头鲂三倍体遗传结构研究和培育团头鲂三倍体新品种提供基础资料。
1 材料与方法
1.1 试验材料
试验以团头鲂“浦江2号”为亲本,父母本均为2龄,性成熟且发育良好。16:00采用人绒毛膜促性腺激素与促黄体素释放激素A2混合注射进行催产,雄鱼注射剂量较雌鱼减半。将已经注射过催产药物的亲鱼暂养在直径2 m圆形的产卵池中,流水刺激;翌日清晨拉网起捕亲鱼,取精、卵进行人工干法授精。将受精卵脱黏后,均匀分成2等份,1份用静水压力机(受精后3 min,压强45 MPa,处理3 min)处理,另1份作为对照,受精卵放入孵化桶中孵化,待鱼苗卵黄囊消失,并能够平游时,将鱼苗转移至4.0 m×6.0 m×1.2 m水泥池进行培育。2种鱼在相同养殖条件下培育20 d至体质量约0.5 g、体长2~3 cm时,用1 mL无菌注射器穿刺尾柄处尾静脉取血约0.5 μL,用800 μL的4′,6-二脒基-2-苯基吲哚染液染色30~60 s后,用流式细胞仪(Partec CyFlow Ploidy Analyser,Germany)检测倍性。以亲本尾静脉血作为参照,将检测出的三倍体保留,静养恢复健康后,足1月龄时用于后续生长对比试验。
1.2 微卫星分析
1.2.1 基因组DNA的提取
每个群体随机挑选30尾鱼,剪取2种倍性团头鲂的胸鳍鳍条,置于95%乙醇中-80 ℃保存。用海洋动物组织基因组试剂盒(离心柱型,天根生化科技有限公司)提取DNA。完成后检测浓度,-20 ℃保存备用。
1.2.2 微卫星标记筛选和来源
筛选出20个团头鲂微卫星标记用于2个群体的遗传结构分析,均能扩增出稳定且清晰的条带,引物来源均参考文献[6,13-16]。所用引物序列由生工生物工程(上海)有限公司合成。微卫星位点及引物信息见表1。
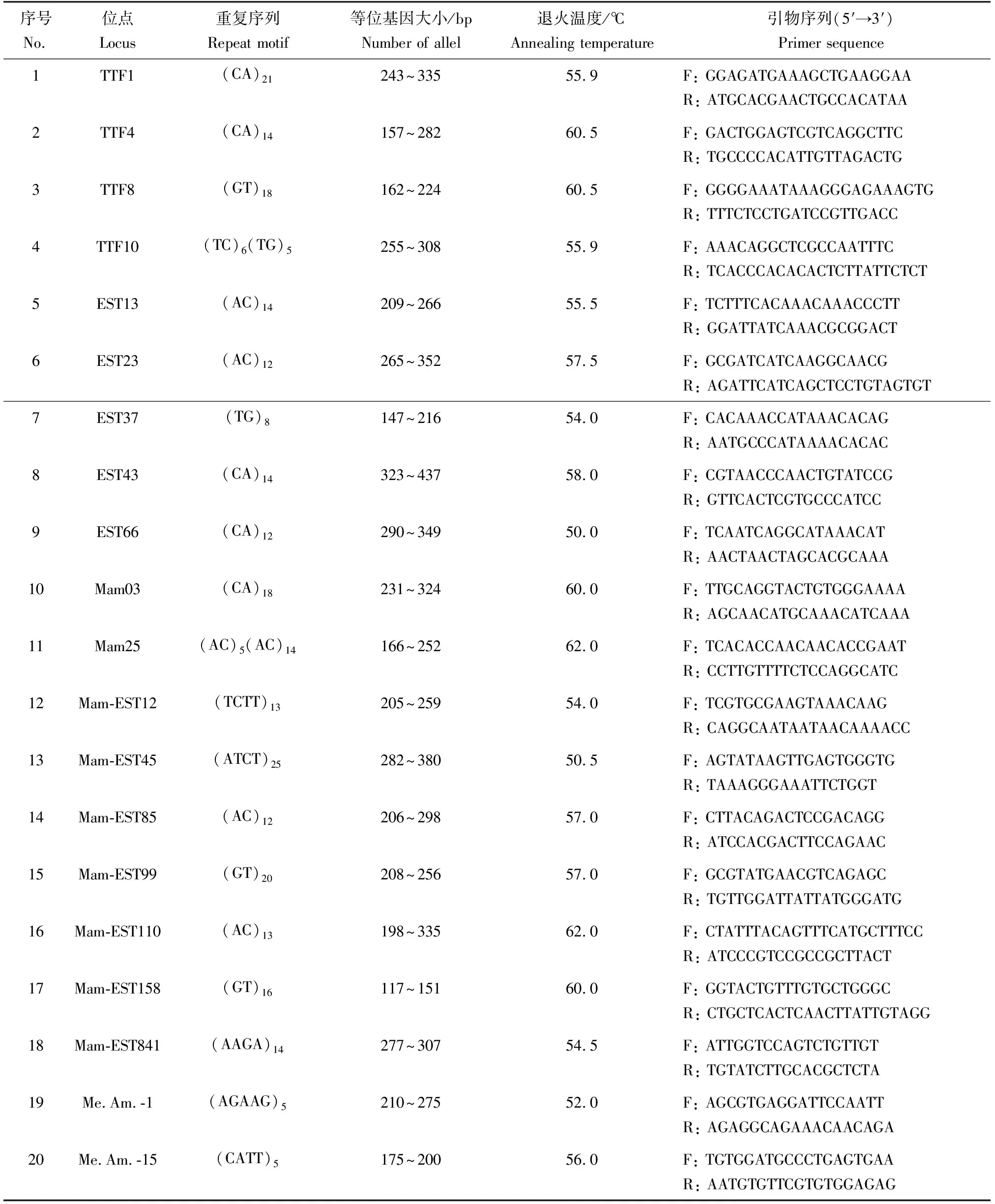
表1 团头鲂微卫星引物特征Tab.1 Characteristics of microsatellite primers of blunt snout bream M. amblycephala
1.2.3 PCR反应体系、扩增程序、产物检测与数据统计
反应总体系为10 μL:5 μL的2×Taq PCR MasterMix(Taq DNA Polymerase:0.1 U/μL; MgCl2:4 mmol/L;dNTPs:各0.4 mmol/L),上下游引物(10 μmol/L)及模板DNA(30~50 ng)各0.5 μL,3.5 μL ddH2O。反应程序:94 ℃ 预变性5 min;94 ℃ 30 s,50~65 ℃(按照表1对退火温度进行调整)30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。扩增完成后加样量1 μL,在8%的非变性聚丙烯酰胺凝胶上进行扩增片段的分型,银染后拍照。2种倍性群体一般显示为1~2条带,采用PopGene(Version 1.32)软件统计遗传多样性数据:等位基因数、有效等位基因数、观测杂合度、期望杂合度;根据Botstein等[17]公式计算哈迪—温伯格遗传偏离指数;位点的多态信息含量用软件PIC-CLC分析。
1.3 养殖试验和生长性能
随机选取体质量约0.5 g的健康团头鲂二倍体、三倍体各150尾,将二倍体、三倍体各50尾分为一组,放入1口0.067 hm2土塘中同塘养殖,二倍体剪去一侧腹鳍,三倍体不剪鳍,以便区分倍性,共放入3口塘。保证养殖条件相同的条件下,定期换水保证水质清新。日投喂量按照鱼体质量1%投喂,根据鱼体生长状况及时调整,日投喂3次,每次投喂同种商品饲料(天邦淡水鱼配合饲料,粗蛋白含量28.5%,粗脂肪含量3.0%)。试验开始时记录初始体质量,分别在2月龄、3月龄、12月龄及18月龄测量体质量,计算绝对质量增加率。结果使用SPSS 17.0进行分析,数据经方差同质性检验不齐性,采用非参数检验分析数据之间的差异。绝对质量增加率(RWAG)按下式计算:
RWAG=(m2-m1)/t×100%
式中,m2为终末体质量(g),m1为初始体质量(g),t为养殖天数(d)。
2 结果与分析
2.1 团头鲂三倍体的倍性检测结果
用流式细胞仪检测倍性,倍性分析结果见图1,图中峰对应的横坐标中值为细胞的相对DNA含量,二倍体为48~54,三倍体为72~81,三倍体血细胞的DNA含量约为二倍体的1.5倍。
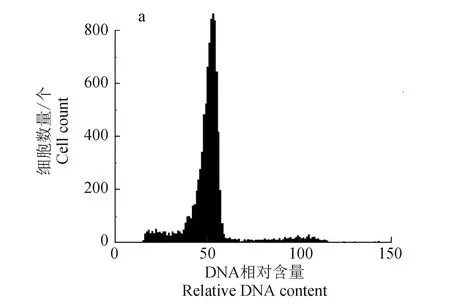
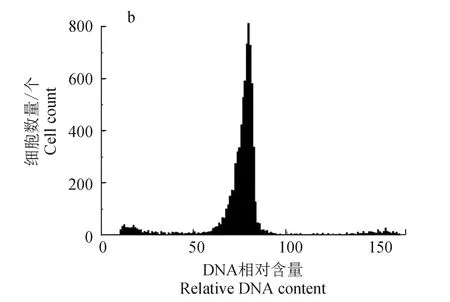
图1 团头鲂二倍体(a)和三倍体(b)细胞DNA相对含量Fig.1 Relative DNA content histograms in erythrocytes of normal diploid (a) and triploid blunt snout bream M. amblycephala (b)
2.2 2种倍性团头鲂群体的SSR扩增结果
使用20个微卫星标记在团头鲂2种倍性群体进行PCR扩增,均能够获得稳定、清晰的条带,在三倍体群体中的扩增效果见图2,扩增条带大小175~200 bp。在对扩增结果进行分析后获得各位点和群体的遗传多样性信息(表2)。在2个群体中获得了66个等位基因,在团头鲂二倍体中扩增获得了61个等位基因;在团头鲂三倍体中获得了55个等位基因。每个位点检测到的等位基因数为1~5个,2种倍性群体的平均等位基因数:二倍体3.05个,三倍体2.75个;平均有效等位基因数:二倍体2.3033个,三倍体2.1859个。二倍体的观测杂合度、期望杂合度、多态信息含量分别为0~1.0000、0~0.7065、0~0.7058;对应的平均值为0.7783、0.5412、0.4378。三倍体的观测杂合度、期望杂合度、多态信息含量分别为0.1667~1.0000、0.1554~0.7033、0.1410~0.6993;对应的平均值为0.7900、0.5061、0.4249。
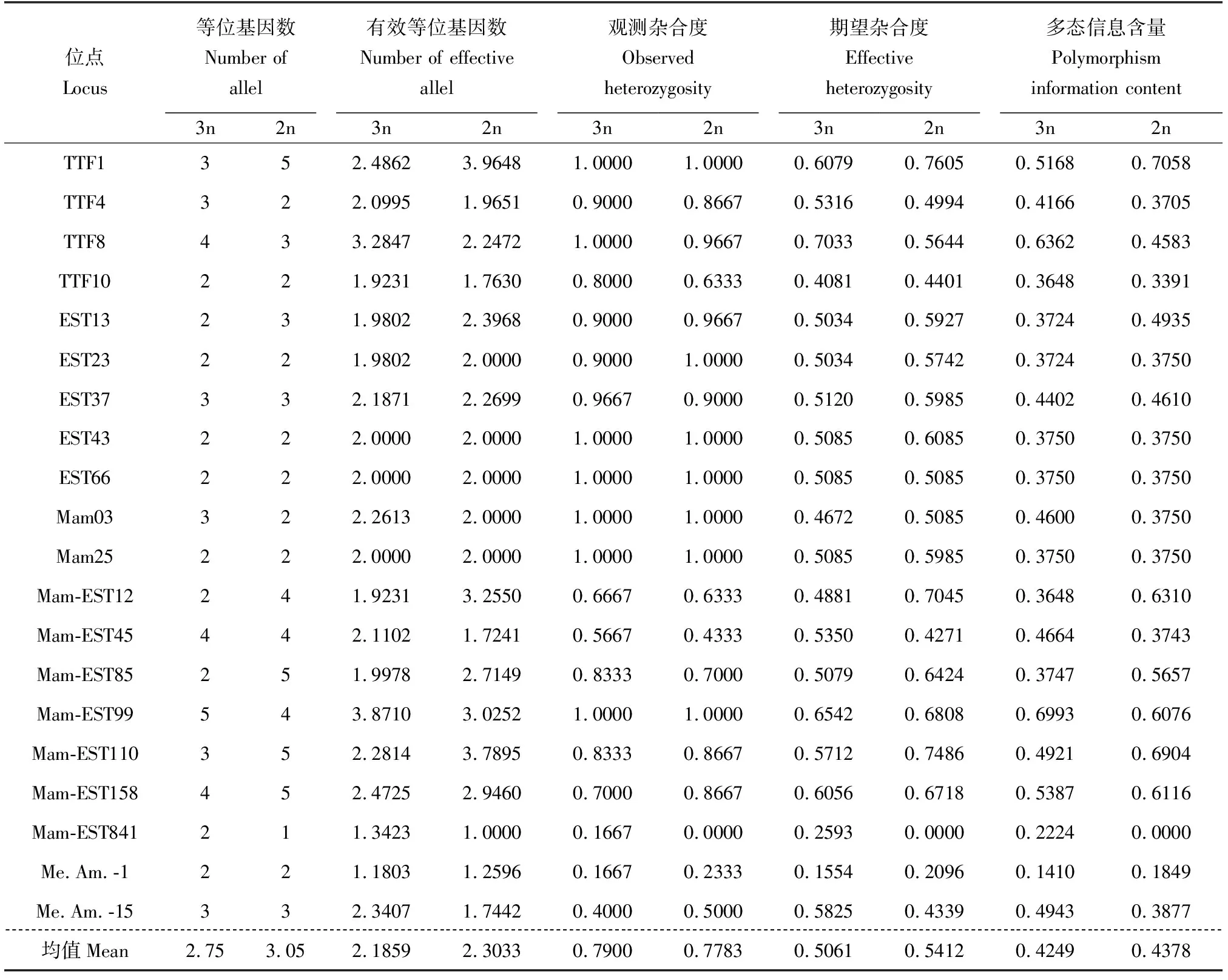
表2 2个群体的遗传多样性参数Tab.2 Genetic diversity parameters of two fish groups

图2 三倍体群体在Me.Am.-15标记中的PAGE分析Fig.2 PAGE diagrams of triploid group amplified by primer Me.Am.-15M.50 bp DNA marker; 1~30.团头鲂三倍体.M.50 bp DNA marker; 1—30.Triploid blunt snout bream M. amblycephala.
2.3 哈迪—温伯格平衡遗传偏离指数
对20个位点进行哈迪—温伯格平衡的卡方检验,显著性经Bonfferin校正后,多数位点偏离平衡,三倍体12个位点均极显著偏离平衡 ,二倍体14个位点偏离平衡(2个位点显著偏离平衡,12个位点极显著偏离平衡)。计算各位点的平衡偏离指数,多数位点出现了杂合子过剩现象(表3)。

表3 哈迪—温伯格平衡的卡方检验概率值(P)与遗传偏离指数Tab.3 Hardy-Weinberg equilibrium Chi-square test probability value (P) and genetic deviation index
2.4 特异性标记的筛选
为了对团头鲂三倍体和二倍体进行分子鉴定,自20个标记中筛选出可区分2个群体的2个特异性标记TTF1、Mam-EST110(图3)。TTF1在二倍体群体中的扩增条带为300~325 bp,三倍体群体中的条带为260~307 bp;Mam-EST110在二倍体群体中的扩增条带为210~298 bp,三倍体群体中的条带为273~315 bp。2个特异性标记在团头鲂三倍体和二倍体中的聚丙烯酰胺凝胶条带大小存在显著差异,可顺利鉴别三倍体和二倍体种群。

图3 2个试验鱼群体在2个特异性标记Mam-EST110(a)、TTF1(b)中的PAGE分析Fig.3 PAGE diagrams of 2 fish groups amplified by primers Mam-EST110(a) and TTF1(b)M.DNA markerⅠ; 1~5.团头鲂二倍体; 6~10.团头鲂三倍体.M.DNA markerⅠ; 1—5.diploid blunt snout bream M. amblycephala; 6—10.triploid blunt snout bream M. amblycephala.
2.5 生长对比
2个群体均在相同环境条件下饲养,在2月龄、3月龄、12月龄及18月龄养殖试验结束时测量试验鱼的体质量,结果见表4。2个群体初始体质量约0.5 g,2月龄团头鲂二倍体、三倍体平均体质量分别为(3.32±0.39)、(3.26±0.45) g;3月龄团头鲂二倍体、三倍体平均体质量分别为(15.71±1.24)、(14.35±0.95) g,二倍体体质量略大于三倍体,但差异不显著(P>0.05);12月龄的生长数据显示,团头鲂二倍体、三倍体平均体质量分别为(392.75±25.99)、(406.30±29.40) g,三倍体体质量略大于二倍体,差异未达到显著性水平(P>0.05);18月龄时二倍体体质量以及绝对质量增加率显著小于三倍体(P<0.05)。结果表明,12月龄之前的三倍体生长速度与二倍体相近,12月龄后三倍体生长速度较二倍体快,表现出明显的生长优势。

表4 试验鱼2个群体的生长性能Tab.4 The growth performance in two fish groups
3 讨 论
3.1 2种倍性团头鲂的遗传多样性分析
遗传多样性是生物进化过程中适应环境的结果,是群体中遗传多样性信息的总和,能够在进化过程中维持群体持久性、适应能力[18]。群体的遗传多样性主要表现在等位基因数目的丰富度、遗传杂合度大小和多态信息含量等方面;等位基因数目越多,杂合度越高,多态信息含量越高,群体的遗传多样性越丰富[19]。在同一位点处二倍体应有2个等位基因,三倍体鱼多出的一套染色体使相应位点存在3个等位基因,理论上三倍体的等位基因数应大于二倍体。然而本试验中,团头鲂三倍体群体的等位基因数、有效等位基因数稍小于团头鲂二倍体,出现了等位基因缺失的现象。褐牙鲆三倍体上也出现了等位基因缺失的现象,刘慧等[7]认为,这可能与三倍体的诱导方式有关,含有特定等位基因或基因型的个体对低温处理的条件敏感致死。由于静水压处理后的受精卵往往不能全部存活,团头鲂也可能存在对压力敏感基因或基因型的个体,在处理后死亡。研究表明,受处理条件影响,在经过诱导的鱼类中可能会出现染色体丢失的非整倍体或者染色体畸变的个体,导致来自亲本的等位基因缺失[20-21]。因此静水压处理团头鲂的受精卵阻止第二极体排出的同时,还可能造成受精卵卵核中部分遗传物质丢失,导致三倍体的等位基因数目减少,遗传多样性降低。
杂合度是评价种群遗传多样性的重要参数,包括观测杂合度、期望杂合度。团头鲂三倍体的观测杂合度为0.7900,大于二倍体的观测杂合度,观测杂合度出现了与其他遗传多样性指标差异趋势不一致的现象,相似的现象也出现在褐牙鲆三倍体上[7]。其原因一是观测杂合度比较容易受到样本量的影响,这是由其计算方式决定的,观测杂合度为群体内杂合个体数量与观察个体数量的比值,而其他的遗传多样性指标都是以等位基因频率为基础计算的;二是初级卵母细胞在减数第一次分裂时同源染色体的非姐妹染色单体之间由于交叉互换发生基因重组,导致同一条染色体上原本互为复制关系的姐妹染色单体可能携带不同的等位基因,压力处理使次级卵母细胞保留第二极体,致使三倍体杂合的几率增大。因而在统计时出现了三倍体群体杂合个体数多于二倍体的现象,使得三倍体的观测杂合度大于二倍体,但差异不明显,可能与选取的微卫星标记数目少、微卫星标记多态性有限以及样本群体数量少有关。所以期望杂合度反映的遗传多样性信息可信度高于观测杂合度[18]。本试验中团头鲂二倍体的期望杂合度为0.5412,徐湛宁等[6]利用20个微卫星标记发现团头鲂正常二倍体群体的期望杂合度为0.6491,略高于本试验结果。可能是选取的微卫星位点不同以及本试验中使用的亲本为连续多代选育的群体,遗传多样性下降。三倍体群体的期望杂合度为0.5061,略低于二倍体群体的期望杂合度,遗传多样性水平较二倍体群体低,对褐牙鲆二倍体、三倍体群体的遗传结构研究出现了相同的现象。这可能是2种鱼的三倍体群体都出现了等位基因的缺失,而杂合度等微卫星统计指标是以等位基因频率为基础的,等位基因数目下降,导致期望杂合度减小[22],染色体数目的增加并未使期望杂合度增加。对银鲫(Carassiusauratusgibelio)以及普通鲫(C.auratusauratus)的研究表明,银鲫的期望杂合度小于普通鲫[23-24],与本试验结果相符。虽然2种鲫的起源存在争议,但也可能说明三倍体生物的杂合度以及其体现的遗传多样性水平不一定高。唐首杰等[25]发现,团头鲂三倍体的杂合度高于二倍体,与本试验结果相反,这可能与该群体是倍间杂交三倍体有关,在配子产生过程中存在较为频繁的连锁互换,传代过程中等位基因自由组合度增加以及选取的微卫星位点过少。杂合度通常为0.5~0.8,表明群体的遗传多样性水平较高[26],三倍体的期望杂合度为0.5061,表明三倍体团头鲂的杂合度比二倍体低,但遗传多样性仍处于较高的水平。
本试验中,使用20个微卫星位点进行遗传分析,根据Botstein等[17]对位点多态性的划分:多态信息含量为0~0.25为低度多态,0.25~0.5为中度多态,大于0.5为高度多态。多态信息含量用来衡量群体内对应位点的遗传变异程度,其值越大,说明可以提供的遗传信息越多。三倍体群体、二倍体群体中度多态位点分别有14个和12个,高度多态位点分别有4个和6个,选取的多数位点均可提供较多的遗传信息。二倍体群体的平均多态信息含量稍高于三倍体。在位点Mam-EST12、Mam-EST85、Mam-EST110上,二倍体群体的多态信息含量大于三倍体,三倍体群体在TTF8的多态信息含量大于二倍体。这说明位点的多态信息含量差异与群体有关,同时,采样的随机性以及群体的数量也会对位点的多态性分析结果产生影响[27]。
3.2 哈迪—温伯格平衡分析
利用20个微卫星标记检测2个群体的哈迪—温伯格平衡时,团头鲂二倍体及三倍体群体分别有14、12个位点出现了偏离哈迪—温伯格平衡的现象。样本群体小、近交、等位基因突变、无效等位基因、人工选择均可导致种群基因偏离哈迪—温伯格平衡[28-30]。在这些偏离平衡的位点中,均表现为杂合子过剩。本试验中2种倍性群体多数位点表现为杂合子过剩,可能是因为选取的亲本数量较少,产生奠基者效应,从而导致连锁不平衡[31],也可能是亲本杂合度较高,产生的子代杂合度高;三倍体群体杂合子过量还与其保留了来自母本的两套遗传物质有差异的染色体有关,多出的一套染色体增加了位点杂合的可能,降低了纯合个体的出现机率。
3.3 群体特异性分子标记的筛选
在大菱鲆[8]、长牡蛎[32]以及虹鳟[9]中均已开发出基于微卫星标记的多重PCR倍性鉴别体系,相对于流式细胞术、染色体计数以及血细胞形态比较等倍性鉴别方法具有成本低、操作简便以及对鱼体损伤小的优点。笔者通过随机挑选个体的方式,从20个多态性分子标记中,筛选获得了2个具有群体特异性的分子标记TTF1和Mam-EST110,分别可以在2种倍性群体中产生清晰的特异性条带,并鉴别2种倍性的团头鲂,为开发基于团头鲂的倍性鉴别体系提供参考。
3.4 团头鲂三倍体的生长性能分析
人工三倍体鱼类由于染色体组数为奇数,一般表现为减数分裂异常,表现出不育或败育,通常认为其因此具备生长的优势。研究表明,多种鱼类三倍体生长速度与二倍体鱼类相比,表现为阶段性特征,在早期幼鱼阶段生长速度相近,在性成熟后时期,生长速度相对二倍体鱼类提高[2]。染色体组数增加不仅影响性腺的发育,进而影响生长速度,还可能对幼鱼早期的生长产生影响,表现出高于或低于二倍体的生长速度。有研究表明,60日龄的三倍体鳜(Sinipercachuatsi)就表现出明显的生长优势[33];Byamungu等[34]发现,三倍体奥里亚罗非鱼(Oreochromisaureus)幼鱼阶段生长速度较二倍体慢,因此三倍体鱼类在生长上的表现因种而异。即便是同一物种,不同研究者得出的结论也不同,Hussain等[35]通过试验比较了尼罗罗非鱼(O.niloticus)三倍体和二倍体的生长指标,未发现显著性的群体差异;Soltan等[36]发现,三倍体尼罗罗非鱼在生长上优于二倍体,表现出明显的生长优势。这可能是鱼类三倍体对环境变化较为敏感,适应性较差,因而在不同的养殖条件下生长表现不同,从而造成不同研究者对同一物种的研究结论有分歧[37-39]。因此,对三倍体团头鲂生长的研究分为早期幼鱼阶段和性腺逐渐开始发育阶段,早期幼鱼阶段由于试验条件限制只测定了2、3月龄的体质量数据,12月龄团头鲂处于性腺逐渐开始发育阶段,测定一次体质量,最后18个月养殖试验结束测定一次体质量。2种倍性团头鲂群体在3月龄之前的平均体质量以及绝对质量增加率相近,二倍体略高,但差异不显著(P>0.05),早期团头鲂三倍体的生长速度低于二倍体,12月龄时三倍体未表现出较快的生长速度,这可能与饲养条件以及鱼类自身因素有关,12月龄三倍体的平均体质量略大于二倍体(P>0.05),但12月龄至18月龄三倍体的绝对质量增加率极显著大于二倍体。团头鲂三倍体的生长优势可能与1龄后性腺逐渐开始发育有关,三倍体由于减数分裂异常导致性腺发育异常,相对二倍体能将更多能量用于生长,三倍体的生长优势逐渐显现;三倍体在18月龄的平均体质量显著大于二倍体(P<0.05),随着性腺的发育,表现出明显的生长优势。综合18月龄的绝对质量增加率以及平均体质量,团头鲂三倍体的生长优势较为明显,具备一定的生产应用价值。
4 结 论
利用20个微卫星标记对2种倍性团头鲂的遗传结构进行了分析,群体之间虽然在遗传多样性信息上有差异,但未达到显著性的水平;可能与研究采用的微卫星位点多态性不高、无效等位基因的干扰有关。另外,聚丙烯酰胺凝胶难以区分分子量十分相近的DNA分子,这些都可能会造成基因型统计失误,导致等位基因的缺失,影响试验结果。笔者通过筛选获得了微卫星标记TTF1和Mam-EST110,可用于2种倍性团头鲂的鉴定。通过对团头鲂三倍体和二倍体的生长对比,三倍体在试验后期表现出较明显的生长优势,证明其具备生产应用价值。研究为团头鲂三倍体种质资源研究、育种以及倍性鉴定提供了基础资料。
