CAR-T治疗相关细胞因子释放综合症的研究进展
2022-03-19胡佳丽张添添张超陶莹陈卫建高文仓
胡佳丽 张添添 张超 陶莹 陈卫建 高文仓
嵌合抗原受体(chimeric antigen receptor,CAR)T细胞疗法是一种新兴的癌症治疗技术,在B 细胞恶性肿瘤中显示出良好疗效。通过基因转移技术将CAR转入自体T细胞,并进行体外扩增后输注入患者体内,直接结合其同源抗原,形成CAR-T细胞活化、增殖、免疫激活、炎性细胞因子释放及肿瘤细胞清除。CAR-T疗法在恶性血液病中取得了良好的疗效,治疗后最显著、最严重的毒副作用是细胞因子释放综合征(cytokine release syndrome,CRS)[1]。在接受癌症免疫治疗的患者中,CAR-T细胞疗法相关CRS的风险特别高[1]。在以CD19为靶点的CAR-T细胞试验中,CRS的发生率高达93%,3级及以上高危患者达13%[2]。CRS的病理生理具体机制尚不确切,主要包括超生理水平的免疫激活,目前仍缺乏有效应对CRS的临床手段。在即将到来的联合免疫治疗时代,为扩大免疫治疗的应用范围,对CRS的正确认知及处理变得至关重要。本文将主要对CRS的概念、高危预测、分级与治疗管理等研究进展进行综述,以期为临床治疗提供一定的参考。
1 CRS的概念
与细胞因子风暴不同,CRS是用来描述CAR-T输注后,T淋巴细胞在体内被免疫激活并快速增殖,引起炎性细胞因子的过度释放,而产生一系列临床症状,包括发热、缺氧、低血压和器官功能障碍等,甚至导致患者死亡[3-4]。CAR-T细胞治疗后参与CRS的细胞因子谱不仅包括效应细胞因子,如干扰素(interferon,IFN)-γ、白介素(Interleukin,IL)-2、可溶性IL-2Rα、IL-6、可溶性IL-6R、粒细胞巨噬细胞集落-刺激因子(granulocyte macrophage-colony stimulating factor,GM-CSF),还有由单核细胞和巨噬细胞分泌的细胞因子,如IL-1,IL-6,IL-8,IL-10,IL-12,以及肿瘤坏死因子(tumor necrosis factor,TNF)-α、IFN-α、单核细胞趋化蛋白(monocyte chemoattractant protein,MCP)-1等[5]。在接受癌症免疫治疗的患者中,CRS的发病率因免疫治疗药物的类型不同而有很大差异,但通常发生在CAR-T细胞输注后的2~20天,持续3周左右[6]。
2 CRS的高危预测
虽然大多数接受CAR-T细胞疗法的患者都经历了一定程度的CRS,但CRS的严重程度和临床反应之间似乎没有直接联系。一部分患者完全缓解,却没有明显的CRS迹象,而另一部分患者没有临床反应,但表现出严重的症状和实验室异常。目前研究主要倾向于将细胞因子谱或血清生化标志物的早期改变用于预测CRS的严重程度,从而指导抗细胞因子治疗。可能由于CRS的天然特征,血清细胞因子水平可作为生物标志物,其特征是明显的全身性炎症和炎性细胞因子升高[3]。已有研究证实,在CAR-T细胞输注后血清细胞因子水平与CRS的严重程度之间存在正相关性[7]。任何预示体内CAR-T扩张和激活的危险因素都可以预测CRS的严重程度。当患者的肿瘤负担较大时,该CRS的发生率和严重性也会增加,可能是因为这样会导致更高水平的T细胞活化。疾病负荷是CAR-T细胞治疗或双特异性T细胞活化剂治疗后严重CRS的最重要预测因子之一[8]。临床因素包括疾病负担、使用氟达拉滨/环磷酰胺预处理的淋巴枯竭、较高的CAR-T细胞剂量等[3,4,9,10]。其他患者因素包括先前存在的炎症状态(基线血清铁蛋白)、基线内皮激活(血小板减少),似乎能够预测更高级别的CRS[9-12]。严重CRS的高危因素归纳如下:(1)早期发病首次CAR-T治疗3日内;(2)高疾病负荷;(3)基于氟达拉滨的调节对淋巴耗竭的影响;(4)高输注CAR-T细胞剂量;(5)无选择性CD8+中央记忆T细胞的CAR-T细胞;(6)高基线血清铁蛋白(>1,500 μg/L;(7)严重血小板减少。
2019年,有研究者通过使用包括三种细胞因子的前向逻辑回归模型准确预测出病情发展为重症的CRS患者,尤其是在儿科患者中,基于评估输注72 h内IFN-γ、IL-13、MIP1-α浓度的建模分析非常准确,灵敏度为100%,特异度为96%,并在独立的队列中进行了验证[7]。与上述构建模型的思路的相反,FHCRC等[10]开发了一种更为简单、及时的分类树模型,包括发热和单细胞因子,用于早期识别4级以上CRS高危患者,通过在输注后36 h内对体温≥38.9 ℃患者的血清MCP-1进行检测,预测的灵敏度和特异度最佳,然而还待进一步研究证实,临床参数组合的建模可能会更广泛地使用,由于在大多数医院中尚不容易获得MCP-1,MIP1-α等细胞因子[3],这也是一个巨大的挑战。
3 CRS分级与治疗管理
3.1 分级标准 在2014年以前,人们使用通用术语标准(common terminology criteria for adverse events,CTCAE)系统来定义、实施分级诊疗。在实施免疫治疗后3周内,出现以下至少一种情况应考虑CRS:体温>38 ℃,室内空气状态下血氧饱和度<90%,收缩压<90 mmHg,出现器官毒性证据。器官毒性证据,主要是根据4.03版不良事件CTCAE进行分级的,即在抗体注射后几分钟至几个小时内出现CRS症状,并且可以通过简单的停止注射药物来解决或改善CRS,但不能够很好地反映CAR-T疗法后延迟出现的CRS。此外,CTCAE系统是通过停止药物使用来缓解CRS,但CAR-T细胞多为单次输注,且在体内存在级联扩增效应,停止输注并不是一个很有意义的手段。该量表是在CAR-T细胞临床试验出现之前开发的,旨在评估单克隆抗体而不是细胞疗法的急性输注毒性,因此不是对CAR-T细胞治疗引起的CRS进行分级的理想框架。
随着CAR-T细胞疗法的发展,已经多次尝试开发一致的CRS分级系统。理想情况下,统一和通用的分级系统将能够对CRS患者进行客观评估,完善对相关不良事件的解释,并有助于指导医生对患者采取适当的治疗策略[13]。2014年,LEE等[3]重新围绕缺氧、低血压和其他终末器官毒性定义了CRS的分级标准,由于是第一个将等级与治疗相关联的标准,被广泛应用于CAR-T细胞治疗组。而后Memorial Sloan Kettering癌症中心研究小组在依赖于实时获得患者血清细胞因子水平的前提下,确定了区分严重CRS和非严重CRS的客观因素,又更新了Lee分级标准。2018年,宾夕法尼亚大学研究组开发Penn分级标准,与Lee标准相比,Penn标准趋向于将CRS的等级定为较高。这是前期接受度较广的三个量表,临床医生需要对比多类修订分级制度至少评估两次,结合相关经验判断以确定患病等级。不同分级标准之间的差异妨碍了各个中心之间临床试验数据的比较。认识到已发表的分级方案存在差异,需要协调免疫效应细胞相关CRS的定义和分级系统,2019年美国移植和细胞治疗学会(ASTCT)根据体温、血压、血氧饱和度发布了简化版的共识指南[14],见表1。
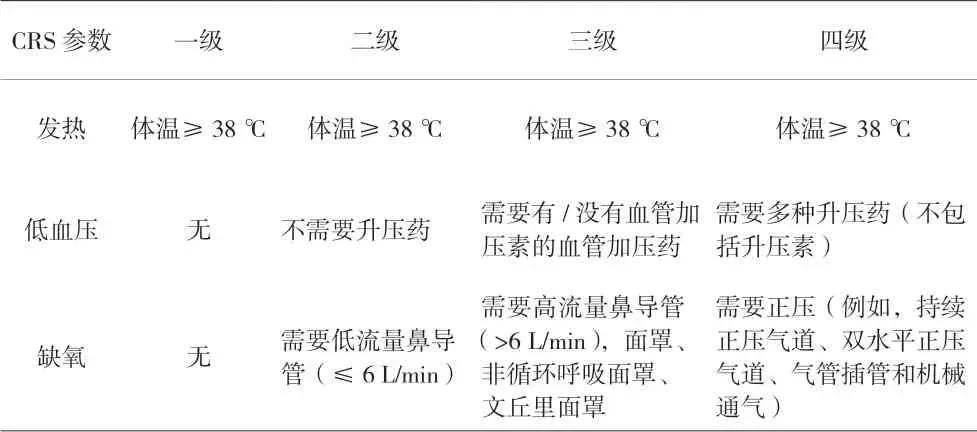
表1 2019年ASTCT共识指南
3.2 治疗 根据ASTCT评级系统,一级的发热患者主要以一般退热治疗、输液以维持体液平衡为主要治疗手段;二级出现低血压,但不需要升压药治疗,首先使用静脉补液和低流量鼻导管吸氧,若疗效不佳,可考虑尽早输注IL-6拮抗剂(妥珠单抗)治疗,以确保收缩压>90 mmHg,及时转入ICU治疗,若吸氧浓度<40%或出现2级器官毒性,也应考虑尽早输注IL-6拮抗剂治疗;二、三级之间的主要区别为是否使用血管升压药物;持续二级或高危三、四级状态,转入ICU实时生命监护,完善心功能监测等,药物予以IL-6拮抗剂和糖皮质激素以控制病情;四级需要使用多种血管升压药和正压通气等手段,在使用三级CRS的治疗基础上,建议加用甲泼尼龙1 g,1次/天,早期积极的管理,高等级CRS也存在可逆性[14-15]。
除对症、支持治疗手段外,特效治疗是CRS诊断后的一大挑战,在不破坏CAR-T细胞的抗肿瘤作用情况下,减轻炎性级联反应。通过检测发现严重CRS期间,内皮细胞活化的生物标记物浓度持续升高[16],内皮细胞激活可能存在逐步放大级联反应。高浓度的全身细胞因子如IFN-γ、IL-6、TNF-α,通过CAR-T细胞和非CAR的过度激活而释放T细胞诱导内皮细胞活化,然后活化的内皮细胞产生更多的IL-6[3]。高水平的IL-6可能会引发促炎性IL-6介导的信号传导级联反应[17]。有大量证据表明,同时具有抗炎和促炎特性的IL-6是CRS信号级联反应中的重要介质,但也可能参与启动抗肿瘤反应。IL-6能够诱导肝细胞产生C反应蛋白(C-reactive protein,CRP),CRP成为了免疫治疗后CRS的重要经历标志物,CRP的下降能够反映CRS的缓解。
2017年,FDA批准妥珠单抗用于治疗嵌合抗原受体T细胞诱导的严重或危及生命的CRS[18],妥珠单抗是一种与IL-6竞争结合其受体的单克隆抗体。在具有高白血病负担的人源化小鼠中,CAR-T细胞介导的抗癌治疗引起高烧和IL-6水平升高是CRS的标志。人单核细胞是CRS期间IL-1和IL-6的主要来源。因此,通过单核细胞消耗或使用妥珠单抗阻断IL-6受体可预防该综合征[19-20],预防性或早期使用妥珠单抗似乎对CRS有利。
最近的多项临床研究已经表明,血管内皮细胞的活化或功能障碍与严重的CRS相关[10,21],低血压、毛细血管渗漏和消耗性凝血病变均提示可能存在内皮功能障碍。内皮细胞活化成为一大相关因素[22],内皮稳定剂可能为治疗或预防CAR-T细胞相关性CRS开辟新的途径,所以有必要进行系统的研究以确定这些早期干预是否影响CAR-T细胞的抗肿瘤活性。
4 小结
免疫疗法频频取得成功,预示着肿瘤学免疫治疗领域将继续快速增长。随着CAR-T细胞疗法抗癌治疗的广泛应用,预计未来几年CRS的发病率将会迅速升高。进一步阐明CRS的临床分级与治疗管理和预测模型,将促使这种毒性反应的研究取得重大进展,能够更安全实施相关治疗,扩大CAR-T细胞疗法在实体瘤中的应用[23]。CRS中IL-6拮抗剂有效说明了,有针对性的免疫干预在癌症免疫治疗毒性管理中的潜力,内皮细胞活化从根本上扩展了临床医师对CRS的认识。发热、MCP-1等一些可及时、简单获取的预测性指标对CRS及高危患者的早期干预是有意义的,但需要进一步临床研究证实。随着对病理生理学认识的提高和毒性处理临床经验的增加,CRS的特异性缓解有望使肿瘤免疫治疗更安全、更有效。
