布氏田鼠母体青春期捕食风险应激对后代反捕食行为和HPA轴基础活动水平的影响
2022-03-19庞金月李陕刘园杨生妹武瑞勇魏万红
庞金月 李陕 刘园 杨生妹 武瑞勇* 魏万红,2*
(1 扬州大学生物科学与技术学院,扬州 225009)
(2 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州大学,扬州 225009)
捕食风险是影响猎物生态和进化的一种重要驱动力(Langerhans, 2007; Pettorelliet al., 2011),有效的反捕食行为对动物的生存至关重要。动物可以通过减少觅食时间、提高警觉水平和防御能力等来应对捕食风险(Hunter and Skinner, 1998;Verdolin, 2006),也可以通过改变栖息地的利用方式或远离捕食者来规避这种风险(McCauley and Rowe, 2010; Coteet al., 2013 )。在高捕食风险下,动物的心理和生理功能也会发生改变,比如焦虑行为增加,应激激素、心率和血压升高等(Ada‐mecet al., 2004; Masiniet al., 2005; Campeauet al., 2008; Zoladzet al., 2008),这些改变往往会引起动物繁殖成功率和整体机能的降低(Boonstraet al.,1998;Lima,1998)。
捕食风险还可以触发猎物“非遗传母体效应”的跨代传递,最终影响后代的表型和适合度。僧帽蚤(Daphnia cucullata) 的胚胎暴露于幽灵蚊(Chaoborus flavicans) 的化学信号后,子代产生更大的“头盔”以增加防御能力(Agrawalet al.,1999)。雌性三刺鱼(Gasterosteus aculeatus)暴露于捕食风险后,子代表现出集群行为增加(Giesinget al., 2011)。怀孕的胎生蜥蜴(Zootoca vivipara) 暴露于蛇的气味后,子代尾巴显著增长,体温选择性降低,活动明显增加(Bestionet al., 2014)。排卵前和排卵期的大山雀(Parus major) 暴露于雀鹰的模型和声音后,雏鸟个体较小但翅膀生长速度较快,表现出能逃避捕食者的选择性优势(Co‐slovsky and Richner,2011)。妊娠期C57BL/6小鼠暴露于捕食者气味可以增加子代成年后对该气味引起的应激相关防御反应的改变,比如逃避行为和血清皮质酮(corticosterone, CORT) 水平增加(St-Cyr and McGowan,2015;St-Cyret al.,2017)。妊娠中期的根田鼠(Alexandromys limnophilus)暴露于艾鼬(Mustela eversmannii)抑制了子代的运动和探究行为,可能对子代的适合度以及种群波动产生负向效应(吴雁等, 2006)。妊娠期的布氏田鼠(La‐sipodomys brandtii) 暴露于猫(Felis catus) 的尿液,产生较多体重较轻的雌性后代,而雄性后代成年后增加探究和觅食行为,并且降低了应激下的血浆CORT 水平(Guet al.,2018,2020)。这些产前母性效应可能反映了一种反捕食防御的发育编程弹性机制(a flexible mechanism of developmental pro‐gramming)(Loveet al.,2013)。
动物的青春期应激作为一种环境因素,也具有跨代传递效应(Grogeret al.,2016)。研究发现青春期的雌性大鼠暴露于慢性温和应激会影响F1 和F2代的焦虑样行为和恐惧反应(Shachar-Dadonet al.,2009;Zaidan and Gaisler-Salomon,2015),并伴随着CORT 水平以及前额叶皮质中促肾上腺皮质激素释放因子(corticotropin releasing factor,CRF)1 型受体mRNA 表达和靶向miRNA 的改变(Zaidanet al.,2013, 2021; Harkeret al., 2015; Bocket al., 2016)。青春期雌性SD 大鼠暴露于吗啡,会引起后代隔离诱发的求救呼叫的减少(Bodiet al.,2016)。青春期大鼠经历社会隔离,其后代应激轴(下丘脑―垂体―肾上腺轴, hypothalamic−pituitary−adrenal axis,HPA 轴)的基础活动水平增加、下丘脑CRF和垂体CRF1 型受体丰度降低、海马糖皮质激素受体表达增加,成年的雄性后代也表现出中枢和血浆神经活性类固醇3α, 5α-四氢孕酮的增加(Pisuet al.,2013)。这些研究表明,青春期应激的影响不只局限于接受应激的一代,也可能更广泛地影响表观基因组,从而影响F1 代甚至F2 代。但是,青春期暴露于捕食风险应激是否也具有跨代传递效应,后代的反捕食行为和应激激素水平如何改变尚无相关报道。
布氏田鼠是分布于我国内蒙古草原和俄罗斯贝加尔湖东南部地区的一种典型草原啮齿动物。由于其啃食植物,具有挖仓储草习性,严重破坏了草原植被和畜牧作物,被认为是草原害鼠(Zhanget al., 2003)。布氏田鼠是狐狸(Vulpes)、艾鼬、兔狲(Otocolobus manul)、猎隼(Falco cher‐rug)、高地秃鹰(Buteo hemilasius)和草原鹰(Aqui‐la nipalensis) 等食肉动物的重要食物来源(Samjaaet al., 2000)。研究发现青春期和成年期的布氏田鼠暴露于猫和黄鼬(Mustela sibirica) 的尿液和粪便时,表现出强烈的恐惧和防御反应(Hegabet al., 2014b),并随着暴露次数的增多而表现出适应(Hegabet al., 2014a;彭延等,2021),但是妊娠期重复暴露于猫尿影响布氏田鼠的繁殖产量、后代质量和行为表型(Guet al., 2018, 2020)。产后重复暴露于猫尿,也会抑制雌性布氏田鼠的母性行为,并增加后代的运动能力(Wuet al.,2020)。最近的研究发现布氏田鼠在青春期时重复暴露于猫尿增加了同伴之间的亲密行为,以及产后对其幼仔的育幼行为,并且这种经历影响后代性比和质量(Wuet al.,2021),那么这种经历是否会影响后代的反捕食行为尚不清楚。
本研究以青春期雌性布氏田鼠作为亲代实验动物,在室内条件下重复暴露于猫尿,来测定其子代在青春期和成年期对该气味的响应以及基础的应激激素水平。旨在探讨母体青春期捕食风险应激的跨代传递效应,为进一步丰富捕食者与猎物之间的协同进化理论和布氏田鼠的种群动态监测提供一定的参考。
1 研究方法
1.1 实验动物
实验动物为捕捉于内蒙古锡林郭勒草原,在扬州大学室内繁殖的布氏田鼠。幼体在出生后与其双亲共同生活到产后21 d 时断奶分笼,将其单个饲养在22 cm×15 cm×18 cm 的饲养笼中,以木屑作为垫料,供给充足的水和标准鼠饲料(扬州仪征动物生物科技有限公司)。饲养房的光照周期为12 L∶12 D,室温为22℃±3℃。所有实验过程均按照《中国实验动物饲养管理和使用指南》进行,并由扬州大学动物福利伦理委员会审核。
1.2 气味源的制备
布氏田鼠对猫的粪便和尿液表现出强烈的恐惧和防御反应(Hegabet al., 2014b),因此本研究以猫尿作为捕食者气味源,以兔尿作为非捕食者气味源,以蒸馏水作为对照气味源。猫气味源来自于从扬州大学文汇路校区捕捉的1 只成年雄猫(Felis silvestris catus),兔气味源来自于从扬州市农贸市场购买的1 只成年雄兔(Oryctolagus cunicu‐lus)。为了避免气味的干扰,分别将猫和兔饲养于不同的房间,饲养笼的大小为120 cm×40 cm×30 cm,每天分别给予足够的猫粮、兔饲料和水,温度和光照周期同布氏田鼠的饲养环境。尿液从放置在饲养笼下面的干净托盘(放置48 h) 中收集,过滤掉粪便或皮毛,在使用前储存在−20℃冰箱。在开始实验前,将尿液解冻并稀释5倍,以确保有足够的气味来源。
1.3 实验处理
实验处理参照Wu 等(2021) 的方法进行。选择体重、发情期基本一致的28 日龄的青春期雌性布氏田鼠36 只作为亲代,将其分为3 组,每组12只个体,分别暴露于猫尿(cat odor, CO)、兔尿(rabbit odor, RO) 和蒸馏水(distilled water, DW)气味源,每只动物每天暴露1 次,每次60 min,连续18 d (图1);所有的暴露过程都在08: 00—12: 00 进行。具体过程如下:将28 日龄的亲代雌性田鼠转运到气味暴露房间的暴露箱(75 cm ×40 cm × 30 cm) 中,使其适应暴露箱60 min 后,将动物放回原饲养笼,连续适应2 d。30 日龄时开始亲代应激实验,将大约10 g 标准鼠饲料和一个浸泡1 mL 稀释尿液或蒸馏水的棉花球(直径5 cm)放入暴露箱中,随后放入实验鼠,时长60 min,连续18 d;每次实验结束后用70%酒精溶液擦拭暴露箱以消除气味干扰。亲代应激暴露结束后在饲养笼中正常饲养至90 日龄,选取陌生正常雄鼠进行交配。子代在出生21 日龄时断奶分窝,每只子代个体单独饲养在22 cm × 15 cm × 18 cm的饲养笼中。从每组亲代气味源应激的后代中,选择大小基本相同的子代个体进行行为和激素水平测定。分为两批,其中一批在子代28 日龄时测定,另一批在子代90 日龄时测定,每批中每种处理的子代选择24只,雌、雄各12只。
1.4 子代反捕食行为观察
按照测试时应激反应增强的顺序,将每只子代暴露于3 种气味源,其中暴露于蒸馏水作为行为反应的基础水平,兔气味为非捕食者气味反应,猫气味为反捕食响应。实验步骤在以上的基础上进行了修改(图1)。选取的青春期子代在28 日龄和29 日龄时单独放在行为观察箱中(同亲代的气味暴露箱)适应,随后在30 日龄时暴露于蒸馏水,33 日龄时暴露于兔尿气味源,36 日龄时暴露于猫尿气味源。每次暴露15 min 并用摄像机记录行为,实验结束后用70%酒精溶液擦拭行为观察箱。选取的成年期子代在90 日龄暴露于蒸馏水,93 日龄暴露于兔尿气味源,96 日龄暴露于猫尿气味源。使用Boris 软件分析下列行为持续时间:隐藏,指田鼠头部和身体完全躲在隐藏室中;嗅闻,指嗅闻气味源;警戒性直立,指田鼠后腿站立,前肢抬起不需要任何东西支撑,四处张望;探头,指田鼠的头部和肩部探出隐藏室,身体的大部分仍藏在隐藏室;自饰,指田鼠用四肢梳理毛发;僵住,指除呼吸外完全静止;其他行为。

图1 实验设计流程图. 在时间轴上标出了实验操作,数字代表出生后日龄;DW:母体青春期暴露于蒸馏水组;RO:母体青春期暴露于兔气味组;CO:母体青春期暴露于猫气味组Fig. 1 Schematic illustration of the experimental procedure. The experimental manipulations are labeled on the timeline,the numbers indicates the postnatal day. DW:distilled water group;RO:rabbit odor group;CO:cat odor group
1.5 Elisa检测血清应激激素水平
青春期和成年期的子代在行为测试完成后快速断头采血,并将血浆样品储存在−20℃冰箱。用田鼠特异性的酶联免疫吸附测定(Enzyme linked immunosorbent assay, Elisa) 试 剂 盒(JL21590 和JL21595,上海江莱生物科技有限公司),按照说明检测血浆中促肾上腺皮质激素(adrenocorticotropic hormone,ACTH) 和CORT 浓度。每个样品的浓度根据标准曲线计算所得,样品重复2次,重复值之间的差异小于5%。
1.6 下丘脑促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)表达水平的检测
采集布氏田鼠血液后,快速取出脑并置于冷冻的培养皿上,冠状切片后从1 mm 厚的切片中取出下丘脑组织。用添加蛋白酶抑制剂的RI‐PA 提取总蛋白,随后用10% SDS-PAGE 凝胶电泳分离变性的蛋白提取物,并转移到PVDF 膜上。随后用兔多克隆抗CRH (1∶1000, 10944-1-AP, Proteintech) 和抗β-actin (1∶5000, bs-0061R,北京博奥森生物技术有限公司) 的一抗孵育,4°C过夜。清洗后,膜用山羊抗兔IgG 二抗孵育(1∶5000, bs-0295G-HRP, 博奥森)。最后,使用增强的ECL 试剂盒和Tanon 5200 化学发光成像系统观察蛋白条带。用Image J 软件进行定量分析。
1.7 数据统计分析
用SPSS 22.0 软件进行数据统计分析。首先用单样本Kolmogorov−Smirnov 检验所有数据是否符合正态分布,随后使用双因素方差分析(two−way ANOVA) 比较母体青春期处理对子代的行为、血浆应激激素和下丘脑CRH 表达水平的影响及性别间的差异。如果方差分析有处理主效应或交互作用,用Turkey HSD 进行事后多重比较检验。所有数据以平均值± 标准误(mean ± SE) 表示,P<0.05表示具有显著性差异。
2 结果
2.1 子代青春期的行为反应
双因素方差分析表明,母体的青春期处理显著影响其子代在青春期暴露于蒸馏水时的警戒性直立行为(F2,66= 3.244,P= 0.05)。与DW 组的子代相比,RO 组的子代在青春期暴露于蒸馏水时表现较多的警戒性直立行为(P=0.041,图2)。子代在青春期暴露于蒸馏水时,雌性后代比雄性后代表现较多的隐藏(F1,66= 6.189,P= 0.017)、僵住(F1,66=17.605,P<0.001)和探头(F1,66=5.504,P=0.024)行为,较少的自饰行为(F1,38=9.983,P=0.003)。
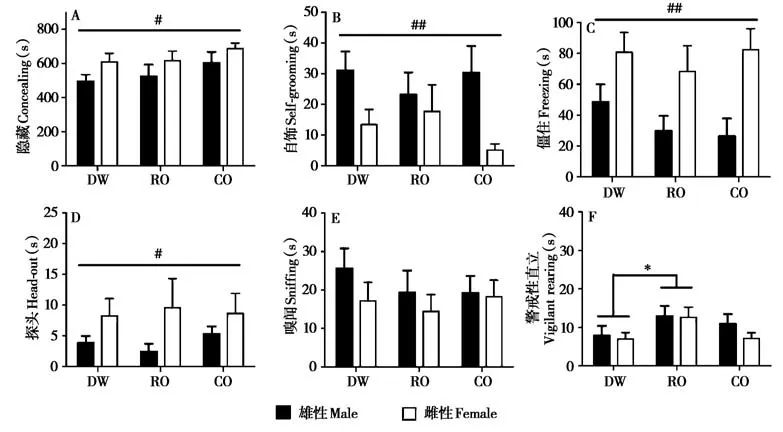
图2 母体青春期不同气味源处理的子代在青春期暴露于蒸馏水的行为反应. A:隐藏的持续时间;B:自饰的持续时间;C:僵住的持续时间;D:探头的持续时间;E:嗅闻的持续时间;F:警戒性直立的持续时间. DW:母体青春期暴露于蒸馏水组;RO:母体青春期暴露于兔气味组;CO:母体青春期暴露于猫气味组. *P<0.05,不同处理组之间的差异. #P<0.05,##P<0.01,不同性别之间的差异Fig. 2 The behavioral performances to acute distilled water exposure in adolescent offspring whose mother exposed to different odor resources dur‐ing adolescence. A:duration of concealing;B:duration of self-grooming;C:duration of freezing;D:duration of head-out;E:duration of sniffing;F:duration of vigilant rearing. DW: distilled water group; RO: rabbit odor group; CO: cat odor group. *P < 0.05, significant difference among the three exposure groups. #P<0.05,##P<0.01,significant difference between males and females
母体青春期处理对子代在青春期暴露于兔气味时的行为反应没有影响(图3),但是雄性子代比雌性子代表现较多的探头(F1,66= 4.940,P=0.03) 和嗅闻(F1,66= 7.353,P= 0.009) 行为。

图3 母体青春期不同气味源处理的子代在青春期暴露于兔气味的行为反应. A:隐藏的持续时间;B:自饰的持续时间;C:僵住的持续时间;D:探头的持续时间;E:嗅闻的持续时间;F:警戒性直立的持续时间. DW:母体青春期暴露于蒸馏水组;RO:母体青春期暴露于兔气味组;CO:母体青春期暴露于猫气味组. #P<0.05,##P<0.01,不同性别之间的差异Fig. 3 The behavioral performances to acute rabbit odor exposure in adolescent offspring whose mother exposed to different odor resources during adolescence. A:duration of concealing;B:duration of self-grooming;C:duration of freezing;D:duration of head-out;E:duration of sniffing;F:du‐ration of vigilant rearing. DW:distilled water group;RO:rabbit odor group;CO:cat odor group. #P<0.05,##P<0.01,significant difference be‐tween males and females
母体青春期处理显著影响子代在青春期暴露于猫气味时的隐藏(F2,66= 9.661,P< 0.001)、自饰(F2,66= 16.742,P< 0.001)、探头(F2,66=16.916,P< 0.001)、嗅闻(F2,66= 18.693,P<0.001) 和警戒性直立(F2,66= 6.279,P= 0.003)行为,隐藏(F1,66= 4.261,P= 0.043)、自饰(F1,66= 4.781,P= 0.032) 和僵住(F1,66= 11.313,P< 0.001) 行为表现出性别的差异, 探头(F2,66= 3.502,P= 0.036) 和直立(F2,66= 4.943,P= 0.001) 行为受母体青春期处理与子代性别交互作用的影响。与DW 组(雄:P= 0.008; 雌:P= 0.003) 和RO 组(雄:P= 0.04; 雌:P= 0.042)的子代相比,CO 组的子代在青春期暴露于猫气味时的隐藏行为显著增多。此外,CO 组和RO组子代的自饰 (CO:P< 0.001; RO: 雄P=0.001)、探 头(CO: 雄P= 0.023, 雌P< 0.001;RO: 雄P= 0.003, 雌P= 0.004) 和嗅闻行为(CO:P< 0.001; RO:P= 0.001) 显著低于DW 组的子代。RO 组雌性子代的直立行为显著低于DW 组的雌性子代(P= 0.001),而探头(雌P= 0.013)和嗅闻(P= 0.013) 行为显著高于CO 组的子代(图4)。

图4 母体青春期不同气味源处理的子代在青春期暴露于猫气味的行为反应. A:隐藏的持续时间;B:自饰的持续时间;C:僵住的持续时间;D:探头的持续时间;E:嗅闻的持续时间;F:警戒性直立的持续时间. DW:母体青春期暴露于蒸馏水组;RO:母体青春期暴露于兔气味组;CO:母体青春期暴露于猫气味组. *P<0.05,**P<0.01,不同处理组之间的差异.#P<0.05,不同性别之间的差异Fig. 4 The behavioral performances to acute cat odor exposure in adolescent offspring whose mother exposed to different odor resources during ad‐olescence. A:duration of concealing;B:duration of self-grooming;C:duration of freezing;D:duration of head-out;E:duration of sniffing;F:dura‐tion of vigilant rearing. DW:distilled water group;RO:rabbit odor group;CO:cat odor group. *P<0.05,**P<0.01,significant difference among the three exposure groups. #P<0.05,significant difference between males and females
2.2 子代成年期的行为反应
双因素方差分析表明,母体青春期处理对子代在成年后暴露于蒸馏水时的行为反应没有影响,但是成年雄性子代比雌性子代表现较多的警戒性直立行为(F1,66= 14.497,P< 0.001)(图5)。
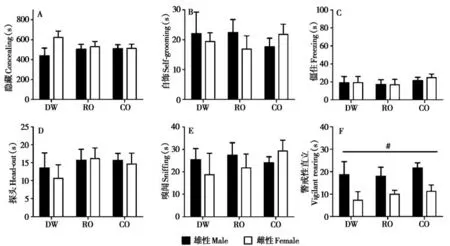
图5 母体青春期不同气味源处理的子代在成年后暴露于蒸馏水的行为反应. A:隐藏的持续时间;B:自饰的持续时间;C:僵住的持续时间;D:探头的持续时间;E:嗅闻的持续时间;F:警戒性直立的持续时间. DW:母体青春期暴露于蒸馏水组;RO:母体青春期暴露于兔气味组;CO:母体青春期暴露于猫气味组. #P<0.05,不同性别之间的差异Fig. 5 The behavioral performances to acute distilled water exposure in adult offspring whose mother exposed to different odor resources during ado‐lescence. A:duration of concealing;B:duration of self-grooming;C:duration of freezing;D:duration of head-out;E:duration of sniffing;F:duration of vigilant rearing. DW:distilled water group;RO:rabbit odor group;CO:cat odor group. #P<0.05,significant difference between males and females
母体青春期处理只影响子代在成年后暴露于兔气味时的探头行为(F2,66=5.049,P=0.009)。与DW 组子代相比,CO 组的子代在成年暴露于兔气味时表现较少的探头行为(P=0.002,图6)。此外,成年雌性子代比雄性子代表现出较多的嗅闻行为(F1,66=6.949,P=0.01)。
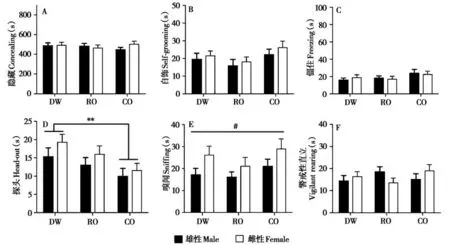
图6 母体青春期不同气味源处理的子代在成年后暴露于兔气味的行为反应. A:隐藏的持续时间;B:自饰的持续时间;C:僵住的持续时间;D:探头的持续时间;E:嗅闻的持续时间;F:警戒性直立的持续时间. DW:母体青春期暴露于蒸馏水组;RO:母体青春期暴露于兔气味组;CO:母体青春期暴露于猫气味组. **P<0.01,不同处理组之间的差异. #P<0.05,不同性别的差异Fig. 6 The behavioral performances to acute rabbit odor exposure in adult offspring whose mother exposed to different odor resources during ado‐lescence. A: duration of concealing; B: duration of self-grooming; C: duration of freezing; D: duration of head-out; E: duration of sniffing; F: dura‐tion of vigilant rearing. DW: distilled water group; RO: rabbit odor group; CO: cat odor group. **P < 0.01, significant difference among the three exposure groups. #P<0.05,significant difference between males and females
母体青春期处理显著影响子代在成年后暴露于猫气味时的警戒性直立行为(F2,66= 3. 533,P=0. 035),子代性别影响隐藏(F1,66= 65. 634,P<0. 001)、自饰(F1,66= 5. 495,P= 0. 032) 和探头(F1,66= 4. 467,P= 0. 038) 行为,而自饰行为也受母体青春期处理和子代性别交互作用的影响(F2,66=5. 965,P= 0. 004)。与DW 组(P= 0. 027) 和RO组(P=0. 021)子代相比,CO组的子代在成年后暴露于猫气味时警戒性直立行为显著增加,雄性子代的自饰行为也显著降低(vs. DW:P= 0. 005;vs.RO:P= 0. 003)。在暴露于猫气味时,成年雌性子代的隐藏行为显著高于雄性,而探头行为显著低于雄性。在CO组的成年子代中,雌性暴露于猫气味时的自饰行为显著高于雄性(P<0. 001)(图7)。
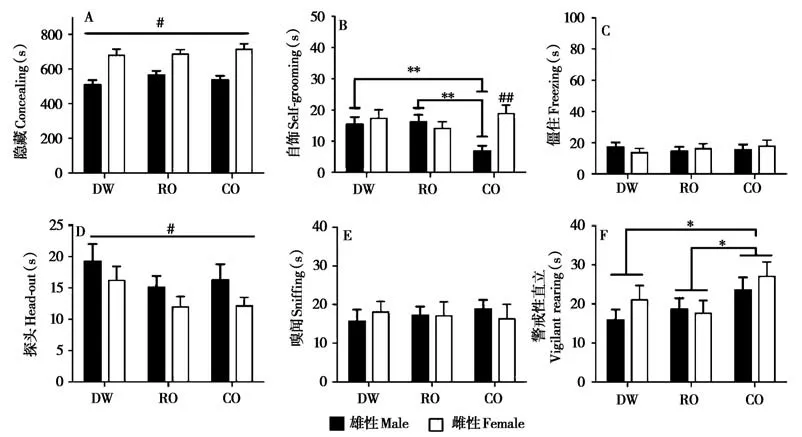
图7 母体青春期不同气味源处理的子代在成年后暴露于猫气味的行为反应. A:隐藏的持续时间;B:自饰的持续时间;C:僵住的持续时间;D:探头的持续时间;E:嗅闻的持续时间;F:警戒性直立的持续时间.DW:母体青春期暴露于蒸馏水组;RO:母体青春期暴露于兔气味组;CO:母体青春期暴露于猫气味组. *P<0.05,**P<0.01,不同处理组之间的差异. #P<0.05,##P<0.01,不同性别的差异Fig. 7 The behavioral performances to acute cat odor exposure in adult offspring whose mother exposed to different odor resources during adoles‐cence. A: duration of concealing; B: duration of self-grooming; C: duration of freezing; D: duration of head-out; E: duration of sniffing; F: duration of vigilant rearing. DW:distilled water group;RO:rabbit odor group;CO:cat odor group. *P<0.05,**P<0.01,significant difference among the three exposure groups. #P<0.05,##P<0.01,significant difference between males and females
2.3 子代HPA轴的基础活动水平
Elisa 和Western Blot 的检测结果表明,母体青春期处理显著影响子代在青春期时的血浆ACTH (F2,66= 3.346,P= 0.041) 和 CORT(F2,66= 7.859,P= 0.001) 水平,而对下丘脑CRH 的表达没有影响。CO 组的子代在青春期时(雌:P= 0.013; 雄:P= 0.037),血浆中CORT的浓度显著高于DW 组的子代;RO 组的子代在青春期时只有雄性的血浆ACTH (P= 0.052) 和CORT (P= 0.042) 浓度显著高于DW 组的雄性子代(图8A ~ C)。子代在青春期时的血浆ACTH (F1,66= 32.555,P< 0.001) 和 CORT(F1,66= 20.651,P< 0.001) 水平也受性别的影响,雌性比雄性具有较高的血浆ACTH (DW 组,P< 0.001; RO 组,P= 0.008; CO 组,P= 0.016 )和CORT (DW 组,P< 0.001; CO 组,P= 0.002)浓度。
母体青春期处理也显著影响子代在成年后的血浆ACTH (F2,66= 7.752,P= 0.001) 和CORT(F2,66= 3.399,P= 0.039) 水平,而对下丘脑CRH表达没有影响。Elisa的检测结果表明RO组的子代在成年后血浆ACTH的浓度显著高于DW组的成年子代(P=0.001),而CORT 浓度低于CO 组的成年子代(P=0.03)(图8D~F)。

图8 母体青春期不同气味源处理的子代在青春期和成年后的血浆ACTH 和CORT 浓度,以及下丘脑CRH 的表达水平. A:子代在青春期时的血浆CORT 浓度;B:子代在青春期时的血浆ACTH 浓度;C:子代在青春期时的下丘脑CRH 相对表达量;D:子代在成年后的血浆CORT 浓度;E:子代在成年后的血浆ACTH 浓度;F:子代在成年后的下丘脑CRH 相对表达量. * P< 0.05,不同处理组之间的差异.#P<0.05,不同性别之间的差异Fig. 8 The concentration of plasma ACTH and CORT, as well as hypothalamic CRH expression in offspring during adolescence and after adult‐hood,respectively. A:plasma CORT concentration in offspring during adolescence;B:plasma ACTH concentration in offspring during adolescence;C:relative expression of hypothalamic CRH in offspring during adolescence;D:plasma CORT concentration in offspring after adulthood;E:plasma ACTH concentration in offspring after adulthood; F: relative expression of hypothalamic CRH in offspring after adulthood. *P < 0.05, significant difference among the three exposure groups. #P<0.05,significant difference between males and females
3 讨论
为了证实母体青春期捕食风险的“跨代传递”效应,本研究检测了青春期的雌性布氏田鼠在重复暴露于猫气味后,其子代在青春期和成年期的反捕食响应和应激激素水平。结果发现母体青春期的捕食风险应激可能影响后代的防御策略,子代在青春期暴露于相同的捕食风险气味源时采用隐藏的消极回避策略,而子代在成年后采用警戒性直立的主动防御策略。这些可能与应激激素的基础水平相关,因为本研究还发现子代在青春期时的血浆皮质酮水平升高,而成年时没有变化。这些结果表明母体青春期暴露于捕食风险可以促进后代反捕食行为的表达,表现出“跨代传递”效应,后代的不同发育阶段通过采用不同的反捕食策略,提高其在被捕食风险下的适应性生存能力。
本研究中,母体青春期重复暴露于猫气味的子代在青春期时遭遇同样的捕食风险气味源时隐藏行为增多,嗅闻和探头行为减少。通常情况下,猎物会寻找安全的位置减少遭遇捕食者或被捕食者攻击的风险(Sievertet al.,2020)。本研究隐藏箱与自然状态下的洞道相似,代表了这一安全的位置,因此隐藏行为是主要的行为反应,约占70%。隐藏行为增多,说明母体青春期暴露于猫气味的子代在青春期时对捕食者气味更为敏感,采用隐匿的策略来提高存活的可能。探头行为指啮齿动物将头从洞道里探出来收集周围环境信息的行为,一般被认为是一种风险评估行为(Dielenberget al.,2001;Hegabet al.,2014b)。正常的逻辑是,猎物在嗅闻到捕食者气味后会撤退到安全位置,然后探头进行风险评估。隐藏行为的增多,嗅闻和探头行为的减少则说明这些子代在青春期时主要采用消极回避的防御策略来提高个体适合度。
此外,本研究还发现子代在青春期暴露于猫尿时的自饰行为减少。自饰行为是一种复杂的本能行为,在应对应激的行为适应中起重要作用。研究表明焦虑模型的啮齿动物表现出自饰行为减少,互饰行为增多(Kalueffet al., 2016),自饰行为的减少可能反映了较高的焦虑水平(Spruijtet al., 1992; Wuet al., 2013)。因此我们推测子代在青春期暴露于猫尿时,应激水平增加,表现出较高的焦虑,伴随着自饰行为的降低。本研究中母体青春期重复暴露于猫气味的子代在青春期时的血浆CORT水平明显高于对照组子代,支持这一推测,说明这些子代在青春期时的应激水平较高。
警戒性直立是鼠类用后腿站立,并环视周围环境发现潜在威胁的行为。这也是一种典型的防御反应,旨在帮助猎物收集较远的威胁源信息,与探头行为类似,也是一种风险评估行为(Dielen‐berget al., 2001; Bowenet al., 2012)。本研究发现母体青春期暴露于猫气味的子代在成年后暴露于兔气味时探头行为减少,而暴露于猫气味时探头行为没有改变,但警戒性直立行为增加,说明这些子代在成年后可能对捕食风险更为敏感。探头和警戒性直立行为的目的都是为了收集周围环境信息,当需要收集较远的环境信息时,与捕食者没有直接身体接触的情况下,警戒性直立行为可能会比探头行为更为频繁。有学者认为警戒性直立行为的增加和探究行为的减少是对危险产生的一种长期适应性的改变(Fendt and Fanselow, 1999;Dielenberget al., 2001; Misslin, 2003; Kindermannet al., 2009)。因此我们推测母体青春期暴露于捕食风险会促进子代在成年后对这种风险应激的适应。与对照组子代相比,母体青春期暴露于猫气味的子代在成年后CORT水平没有明显变化,也证实了这种适应性。在这种情况下,猎物往往选择主动的防御策略,比如提高警戒水平。
母体青春期暴露于捕食风险后,子代在青春期时采用消极回避的防御策略,而在成年后采用警戒性的主动防御策略,这些结果都证明母体青春期的这种捕食风险经历提高了后代的反捕食行为水平,从而可能提高个体适合度。很多研究已经证实了捕食风险在孕期和产后的“跨代母体传递效应”,比如大山雀翅膀长度的增加(Coslovsky and Richner, 2011),三刺鱼更紧密的集群行为(Giesinget al., 2011) 和蟋蟀静止时间的增加(Storm and Lima,2010),都支持本研究结果。这些研究说明,母体在任何阶段遭遇应激都可能对后代产生持久的影响。母体效应引起子代表型的变化,可能是母体对子代出生后频繁遭遇的生态应激源的一种预防和准备,当母体环境与子代环境相匹配时,可以提高子代对环境的适应性(Monaghanet al.,2009)。
综上所述,本研究证实母体青春期捕食风险的“跨代传递”效应,这种经历以阶段性的效应提高后代的反捕食防御水平,子代青春期倾向于被动防御,成年后采用主动防御,这可能与基础的应激激素水平相关。表明母体青春期的经历对于后代行为和生理表型的重塑也非常重要,对于理解不同阶段的“母体跨代传递”效应对后代行为表型的影响具有重要意义。
