意大利蜜蜂Ci蛋白的生物信息学分析
2022-03-18于点点郭丽娜
王 珏,于点点,郭 媛,郭丽娜
(1山西农业大学动物科学学院,山西 太谷 030801;2山西农业大学园艺学院,山西 太谷 030801)
0 引言
【研究意义】Hedgehog(Hh)信号通路在不同物种间具有一定的保守性,从昆虫到人类均普遍存在,其主要功能是调节体节形成、胚胎发育及成体组织稳态(王露林等,2021)。Hh信号通路活性的丧失会导致多种人类出生缺陷,包括前脑无裂畸形、多指畸形、颅面缺损和骨骼畸形(Huangfu and Anderson,2006)。在无脊椎动物中,转录因子(Cubitus interruptus,Ci)修饰是Hh信号通路转录激活前最后一个被识别的步骤。Ci可形成一个截断的阻遏因子(CiR/Ci75)或基于Hh作为激活因子(CiA/Ci155)调控靶基因表达(Little et al.,2020)。在脊椎动物中,与Ci同源的胶质母细胞瘤(Glioblastomas,Glis)在Hh信号通路调控中发挥着类似且更复杂的作用(Koh et al.,2021)。Hh信号通路在胚胎发育及组织稳态期间参与一系列复杂的过程(Xiong et al.,2015)。因此,了解意大利蜜蜂Ci蛋白基本信息,明确其结构特点及生物学功能,可为揭示Ci蛋白在意大利蜜蜂Hh信号通路中的作用机理和功能提供理论依据。【前人研究进展】Hh信号通路转导是通过转录因子Ci/Gli来实现(Shi et al.,2014)。Ci包含5个典型的锌指蛋白结构域,具有高度保守性(Jiang,2022)。Ci也是Hh信号通路中唯一的转录因子,由1397个氨基酸残基组成,可被切割成75 kD大小的转录抑制因子——CiR,且能同时激活转录靶点(Robbins et al.,2012)。Hh信号通路中其他成分蛋白的主要功能是调节Ci的分布及其活性,包括:(1)fu,一种特定的丝氨酸—苏氨酸蛋白激酶(Maloverjan and Piirsoo,2012);(2)fu抑制剂[Su(fu)],与fu和Costal-2(Cos-2)发生物理作用(Oh et al.,2015);(3)类运动蛋白Cos-2,与微管的高亲和性结合被Hh信号通路转导逆转(Kalderon,2004);(4)蛋白激酶A(PKA),其功能发挥需要抑制Hh 信号(Kotani,2012);(5)CREB-结合蛋白(dCBP),一种被认为能直接与Ci结合的转录辅助激活因子(Chen et al.,2000);(6)Slimb,一种含WD40的F-box蛋白,其功能是切割全长Ci(Smelkinson and Kalderon,2006);(7)微管蛋白(Cohen,2003)。已有研究表明,在果蝇中Hh信号通路通过Ci发出信号控制幼虫胚胎表皮细胞命运,细胞间相互作用产生分泌的信号分子成为Hh信号通路表达的一部分,分泌信号分子通常协同作用,进而调节细胞命运(Angelats et al.,2002)。因此,推测Ci蛋白在蜜蜂胚胎发育过程中发挥着控制幼虫表皮细胞发育的作用。【本研究切入点】Hh信号通路广泛参与脊椎动物及无脊椎动物的发育过程,但至今尚无针对意大利蜜蜂Ci蛋白结构及功能的研究报道。【拟解决的关键问题】以意大利蜜蜂Ci蛋白为研究对象,利用在线生物信息学工具进行预测分析并阐述其功能,为揭示Ci蛋白在意大利蜜蜂Hh信号通路中的功能和作用打下基础。
1 材料与方法
1.1 试验材料
使用NCBI-Smart BLAST检索Ci蛋白的同源氨基酸序列,包括黑腹果蝇、斑马鱼、小鼠、人类及意大利蜜蜂Ci蛋白序列,均从NCBI数据库(http://www.ncbi.nlm.nih.gov)获取。
1.2 试验方法
使用在线生物信学分析软件(表1)对意大利蜜蜂Ci信息数据库进行结构和功能预测分析,包括ProtParam、SignalP-5.0、SoftBerry等。

表1 在线生物信息学分析软件Table 1 Online software of bioinformatic and phylogenetic analysis
2 结果与分析
2.1 意大利蜜蜂Ci蛋白理化性质分析结果
利用ProtParam对意大利蜜蜂Ci蛋白进行理化性质分析,结果显示:意大利蜜蜂Ci蛋白XP_624136.4亚型的开放阅读框(ORF)为4338 bp,编码1445个氨基酸残基,编码蛋白分子量为15.50 kD,理论等电点(pI)为8.39;包含20种常见的氨基酸,其中脯氨酸(Pro)含量最高(占11.2%)、色氨酸(Trp)含量最低(占0.5%);蛋白分子结构为C6586H10266N2056O2123S86,脂溶指数为49.51,总平均亲水性为-0.806(属于亲水性蛋白),不稳定系数为65.85(蛋白稳定参数<40为稳定蛋白质)。意大利蜜蜂Ci蛋白XP_006558245.2亚型的ORF为3873 bp,编码1290个氨基酸残基,编码蛋白分子量为13.99 kD,pI为8.48;包含20种常见的氨基酸,其中丝氨酸(Ser)含量最高(占11.4%)、Trp含量最低(占0.5%);蛋白分子结构为C5909H9293N1849O1932S85,脂溶指数为50.26,总平均亲水性为-0.849(属于亲水性蛋白),不稳定系数为66.77。由于意大利蜜蜂Ci蛋白2个亚型的不稳定系数均大于40,故推测意大利蜜蜂Ci为不稳定蛋白。
2.2 意大利蜜蜂Ci蛋白信号肽及亚细胞定位预测结果
利用SignalP-5.0对意大利蜜蜂Ci蛋白进行信号肽预测,结果显示,Ci蛋白XP_624136.4亚型和XP_006558245.2亚型的第1~20位氨基酸残基间无信号肽(图1),也无跨膜结构(图2),不属于膜蛋白。以在线网站http://linux1.softberry.com/all.htm蛋白数据库为基础,对意大利蜜蜂Ci蛋白进行亚细胞定位预测,发现Ci蛋白XP_624136.4亚型主要定位于细胞核(占91.3%),在囊细胞质中有少量分布(占8.7%);Ci蛋白XP_006558245.2亚型主要定位于细胞核(占87.0%),8.7%位于囊细胞质中,在线粒体中也有少量分布(占4.3%),表明意大利蜜蜂Ci参与维持蛋白完整性。
图1 意大利蜜蜂Ci蛋白XP_624136.4亚型(左)和XP_006558245.2亚型(右)信号肽预测结果Fig.1 Signal peptide prediction of XP_624136.4 subtype(left)and XP_006558245.2 subtype(right)of Ci proteins in A.mellifera

图2 意大利蜜蜂Ci蛋白XP_624136.4亚型(左)和XP_006558245.2亚型(右)跨膜结构预测结果Fig.2 Transmembrane structure prediction of XP_624136.4 subtype(left)and XP_006558245.2 subtype(right)of Ci proteins in A.mellifera
2.3 意大利蜜蜂Ci蛋白糖基化位点、磷酸化位点和苏木素化位点预测结果
分别利用NetOGlyc 3.1和NetPhos 3.1对意大利蜜蜂Ci蛋白的O-糖基化位点、N-糖基化位点和磷酸化位点进行预测,结果发现:Ci蛋白XP_624136.4亚型3Thr(0.519)和248Thr(0.542)的2个O-糖基化位点均高于阈值0.50,说明其存在2个O-糖基化位点(图3);Ci蛋白XP_006558245.2亚型12Thr、39Thr、189Thr、205Thr、228Thr、244Thr、246Thr、251Thr、252Thr、256Thr、469Thr、640Thr、669Thr、682Thr、692Thr、707Thr、714Thr、841Thr、851Thr、863Thr、893Thr、929Thr、1070Thr、1113Thr、1246Thr和1273Thr的26个O-糖基化位点均高于阈值0.50,即存在26个O-糖基化位点(图3)。Ci蛋白XP_624136.4亚型预测到127Thr(0.741)、171Thr(0.618)、255Thr(0.642)、402Thr(0.604)、550Thr(0.664)、790Thr(0.543)、871Thr(0.504)、1133Thr(0.593)和1402Thr(0.615)共9个N-糖基化位点(图4),XP_006558245.2亚型预测到16Thr(0.638)、100Thr(0.659)、247Thr(0.618)、395Thr(0.679)、635Thr(0.557)、716Thr(0.515)、978Thr(0.614)和1247Thr(0.618)共8 个N-糖基化位点(图4)。

图3 意大利蜜蜂Ci蛋白XP_624136.4亚型(左)和XP_006558245.2亚型(右)O-糖基化位点预测结果Fig.3 O-glycosylation site prediction of XP_624136.4 subtype(left)and XP_006558245.2 subtype(right)of Ci proteins in A.mellifera

图4 意大利蜜蜂Ci蛋白XP_624136.4亚型(左)和XP_006558245.2亚型(右)N-糖基化位点预测结果Fig.4 N-glycosylation site prediction of XP_624136.4 subtype(left)and XP_006558245.2 subtype(right)of Ci proteins in A.mellifera
意大利蜜蜂Ci蛋白XP_624136.4亚型存在174个磷酸化位点,其中,磷酸丝氨酸位点127个(88Ser、89Ser、90Ser、110Ser、130Ser、138Ser、142Ser、166Ser、169Ser、173Ser、197Ser、203Ser、209Ser、210Ser、214Ser、218Ser、223Ser、229Ser、230Ser、231Ser、234Ser、241Ser、246Ser、249Ser、252Ser、257Ser、259Ser、260Ser、261Ser、263Ser、265Ser、274Ser、330Ser、333Ser、343Ser、362Ser、365Ser、370Ser、372Ser、376Ser、384Ser、385Ser、389Ser、417Ser、419Ser、464Ser、473Ser、510Ser、521Ser、536Ser、543Ser、554Ser、574Ser、575Ser、604Ser、613Ser、615Ser、617Ser、626Ser、628Ser、629Ser、631Ser、634Ser、636Ser、640Ser、643Ser、650Ser、703Ser、714Ser、733Ser、736Ser、766Ser、771Ser、773Ser、783Ser、789Ser、791Ser、794Ser、799Ser、802Ser、807Ser、810Ser、811Ser、814Ser、817Ser、828Ser、834Ser、838Ser、841Ser、842Ser、845Ser、848Ser、861Ser、863Ser、873Ser、901Ser、913Ser、922Ser、973Ser、980Ser、1011Ser、1026Ser、1033Ser、1034Ser、1041Ser、1060Ser、1068Ser、1071Ser、1076Ser、1085Ser、1176Ser、1192Ser、1221Ser、1235Ser、1239Ser、1292Ser、1296Ser、1360Ser、1362Ser、1366Ser、1378Ser、1393Ser、1406Ser、1411Ser、1430Ser、1432Ser和1433Ser),磷酸苏氨酸位点32个(145Thr、167Thr、194Thr、344Thr、348Thr、373Thr、374Thr、383Thr、388Thr、390Thr、399Thr、400Thr、405Thr、406Thr、407Thr、432Thr、445Thr、493Thr、517Thr、552Tyr、567Thr、624Thr、667Thr、740Thr、770Tyr、795Tyr、824Tyr、837Thr、846Thr、847Thr、869Thr和909Tyr),磷 酸 色 氨酸位点15个(8Tyr、233Tyr、559Tyr、570Tyr、589Tyr、797Tyr、1020Tyr、1028Tyr、1043Tyr、1121Tyr、1331Tyr、1343Tyr、1379Tyr、1385Tyr和1440Tyr)(图5)。Ci 蛋 白XP_006558245.2 亚 型 存 在156个磷酸化位点,其中,磷酸丝氨酸位点120个(11Ser、14Ser、18Ser、42Ser、48Ser、54Ser、55Ser、59Ser、63Ser、68Ser、74Ser、75Ser、76Ser、79Ser、86Ser、91Ser、94Ser、97Ser、102Ser、104Se、105Ser、106Ser、108Ser、110Ser、119Ser、175Ser、178Ser、188Ser、207Ser、210Ser、215Ser、217Ser、221Ser、229Ser、230Ser、234Ser、262Ser、264Ser、309Ser、318Ser、355Ser、366Ser、381Ser、388Ser、399Ser、419Ser、420Ser、449Ser、458Ser、460Ser、462Ser、471Ser、473Ser、474Ser、476Ser、479Ser、481Ser、485Ser、488Ser、495Ser、548Ser、559Ser、578Ser、581Ser、611Ser、616Ser、618Ser、628Ser、634Ser、636Ser、639Ser、644Ser、647Ser、652Ser、655Ser、656Ser、659Ser、662Ser、673Ser、679Ser、683Ser、686Ser、687Ser、690Ser、693Ser、706Ser、708Ser、718Ser、746Ser、758Ser、767Ser、818Ser、825Ser、856Ser、871Ser、878Ser、879Ser、886Ser、905Ser、913Ser、916Ser、921Ser、930Ser、1021Ser、1037Ser、1066Ser、1080Ser、1084Ser、1137Ser、1141Ser、1205Ser、1207Ser、1211Ser、1223Ser、1238Ser、1251Ser、1256Ser、1275Ser、1277Ser和1278Ser),磷酸苏氨酸位点29个(12Thr、193Thr、219Thr、228Thr、245Thr、250Thr、252Thr、277Thr、290Thr、362Thr、412Thr、512Thr、585Thr、615Thr、640Thr、669Thr、682Thr、691Thr、692Thr、714Thr、841Thr、929Thr、953Thr、1004Thr、1041Thr、1056Thr、1071Thr、1113Thr和1252Thr),磷酸色氨酸位点7个(404Tyr、642Tyr、966Tyr、1176Tyr、1224Tyr、1230Tyr和1285Tyr)(图5)。
图5 意大利蜜蜂Ci蛋白XP_624136.4亚型(左)和XP_006558245.2亚型(右)磷酸化位点预测结果Fig.5 Phosphorylation site prediction of XP_624136.4 subtype(left)and XP_006558245.2 subtype(right)of Ci proteins in A.mellifera
意大利蜜蜂Ci蛋白XP_624136.4亚型存在5个易发生苏木素化的修饰位点(Score>0.5),分别是642K(0.93)、398K(0.93)、770K(0.91)、1388K(0.84)和364K(0.61)(图6);XP_006558245.2亚型也存在5个易发生苏木素化的修饰位点,分别是484K(0.93)、241K(0.93)、613K(0.91)、1231K(0.84)和206K(0.61)(图7)。

图6 意大利蜜蜂Ci蛋白XP_624136.4亚型苏木素化位点预测结果Fig.6 Sumolation site prediction of XP_624136.4 subtype of Ci proteins in A.mellifera

图7 意大利蜜蜂Ci蛋白XP_006558245.2亚型苏木素化位点预测结果Fig.7 Sumolation site prediction of XP_006558245.2 subtype of Ci proteins in A.mellifera
2.4 意大利蜜蜂Ci蛋白高级结构预测结果
蛋白多肽链在各种二级结构的基础上进一步盘曲或折叠形成具有一定规律的三维空间结构,蛋白三级结构的稳定性主要靠次级键,包括氢键、疏水键、盐键及范德华力等(罗钧文,2022)。采用GOR4预测意大利蜜蜂Ci蛋白二级结构,结果(图8)显示,XP_624136.4亚型二级结构中α-螺旋占13.49%(195个氨基酸残基)、延伸链占15.22%(220个氨基酸残基)、无规则卷曲占71.28%(1030个氨基酸残基);XP_006558245.2亚型二级结构中α-螺旋占11.47%(148个氨基酸残基)、延伸链占15.58%(201个氨基酸残基)、无规则卷曲占72.95%(941个氨基酸残基)。

图8 意大利蜜蜂Ci蛋白XP_624136.4亚型(上)和XP_006558245.2亚型(下)二级结构预测结果Fig.8 Secondary structure prediction of XP_624136.4 subtype(up)and XP_006558245.2 subtype(down)of Ci proteins in A.mellifera
通过NCBI的CD-Search软件,输入Ci氨基酸序列即获得该蛋白的模体预测结果。意大利蜜蜂Ci蛋白2个亚型均拥有5个典型的C2H2型锌指蛋白结构域(图9),只是所处位点不同,说明该蛋白属于SPF1家族。通过SWISS-MODEL预测意大利蜜蜂Ci蛋白三级结构,结果表明,GMQE为0.07,QMEAN为0.67,蛋白氨基酸序列与2Gli.1.C模板序列具有高度相似性,相似性为81.94%,说明该模型具有相对合理的结构,且2个亚型选取的合适模型相同。意大利蜜蜂Ci蛋白三级结构中无规则卷曲分布较多(图10),此类结构对生物学功能的发挥具有重要作用。

图9 意大利蜜蜂Ci蛋白XP_624136.4亚型(上)和XP_006558245.2亚型(下)模体结构预测结果Fig.9 Motif structure prediction XP_624136.4 subtype(up)and XP_006558245.2 subtype(down)of Ci proteins in A.mellifera
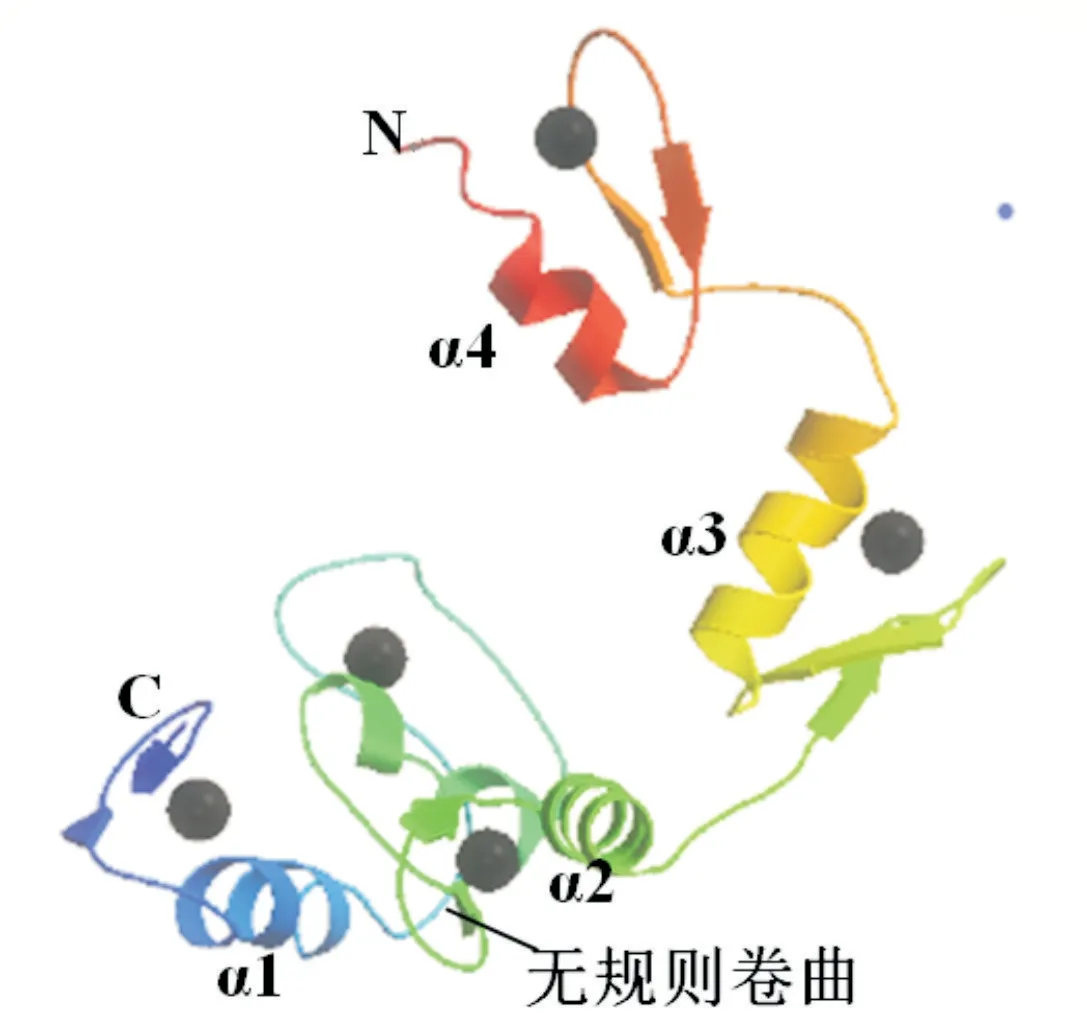
图10 意大利蜜蜂Ci蛋白三级结构预测结果Fig.10 Tertiary structure prediction of Ci proteins in A. mellifera
基于意大利蜜蜂Ci蛋白三级结构构象和同源蛋白相似性波形图,进一步对预测模型的可靠性进行验证,采用The Structure Analysis and Verification Server对预测模型进行拉曼图分析,结果发现意大利蜜蜂Ci蛋白2个亚型均显示预测的蛋白残基二面角位于黄色核心区域(图11)。该区域构象是立体化学允许区,可稳定存在,说明该模型的构象符合立体化学规则。

图11 意大利蜜蜂Ci蛋白XP_624136.4亚型(左)和XP_006558245.2亚型(右)三级结构模型拉曼图Fig.11 Ramachandran map of tertiary structure predication of XP_624136.4 subtype(left)and XP_006558245.2 subtype(right)of Ci proteins in A.mellifera
2.5 意大利蜜蜂Ci蛋白结构域与物种同源性分析结果
通过SMART对意大利蜜蜂Ci蛋白保守结构域进行预测,结果发现意大利蜜蜂Ci蛋白具有5个典型的C2H2型锌指蛋白结构域(图12)。XP_624136.4亚型的C2H2型锌指蛋白结构域分别位于第432~457位、第465~492位、第498~522位、第528~553位和第559~584位氨基酸残基处,能与DNA结合而激活靶蛋白转录;还有13个低复杂性区域,分别位于第17~86位、第88~132位、第214~231位、第251~272位、第284~333位、第396~411位、第593~613位、第626~640位、第704~712位、第836~851位、第913~922位、第1256~1272 位 和 第1310~1321 位 氨 基 酸 残 基 处。XP_006558245.2亚型的C2H2型锌指蛋白结构域分别位于第277~302位、第310~337位、第343~367位、第373~398位和第404~429位氨基酸残基处;还有11个低复杂性区域,分别位于第59~76位、第96~117位、第129~178位、第241~256位、第438~458位、第471~485位、第549~557位、第681~696位、第758~767位、第1101~1117位和第1155~1166位氨基酸残基处。
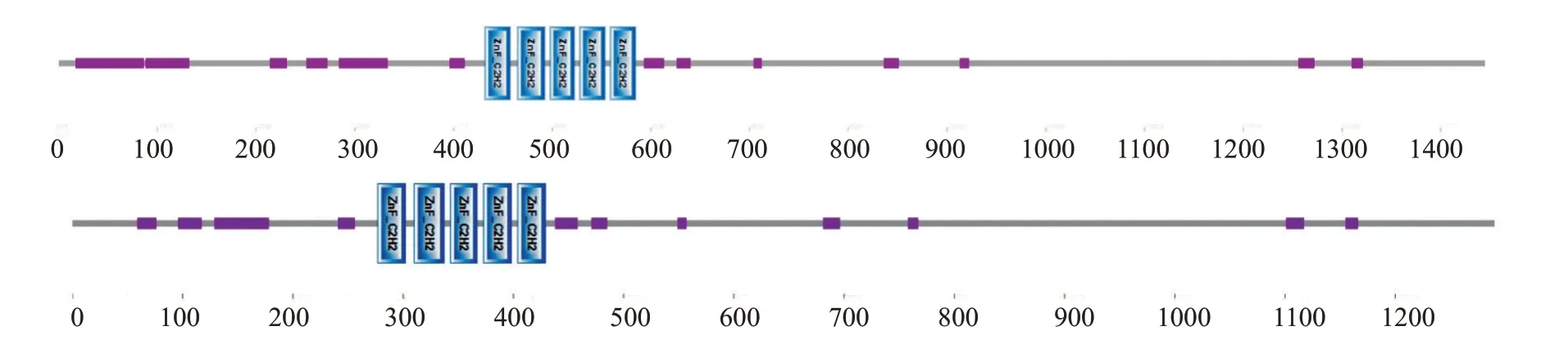
图12 意大利蜜蜂Ci蛋白XP_624136.4亚型(上)和XP_006558245.2亚型(下)保守结构域预测结果Fig.12 Conserved domain prediction of XP_624136.4 subtype(up)and XP_006558245.2 subtype(down)of Ci proteins in A.mellifera
使用NCBI的BLAST 检索Ci蛋白同源氨基酸序列,结果显示,意大利蜜蜂Ci蛋白XP_624136.4亚型与黑腹果蝇A型和B型及小鼠、人类、斑马鱼具有较高的氨基酸序列相似性,对应的相似性分别为59%、57%、51%、47%和31%(图13);XP_006558245.2亚型与黑腹果蝇A型和B型的氨基酸序列相似度均为64%,与小鼠、人类、斑马鱼的氨基酸序列相似性分别为58%、52%和34%(图14)。同时以DNAMAN对意大利蜜蜂Ci蛋白2个亚型氨基酸序列进行对比,并使用MEGA 11.0构建系统发育进化树,结果显示在昆虫中意大利蜜蜂Ci蛋白的2条氨基酸序列均与黑腹果蝇A型的亲缘关系较近(图15),即意大利蜜蜂Ci蛋白在昆虫到哺乳动物间的保守性较高,与多重序列比对结果一致。

图13 意大利蜜蜂Ci蛋白XP_624136.4亚型与其他物种Ci氨基酸序列的比对分析结果Fig.13 Alignment of amino acid sequences of XP_624136.4 subtype of Ci proteins in A.mellifera sequence with Ci amino acid sequences in other species

图14 意大利蜜蜂Ci蛋白XP_006558245.2亚型与其他物种Ci氨基酸序列的比对分析结果Fig.14 Alignment of amino acid sequences of XP_006558245.2 subtype of Ci proteins in A.mellifera sequence with Ci amino acid sequences in other species
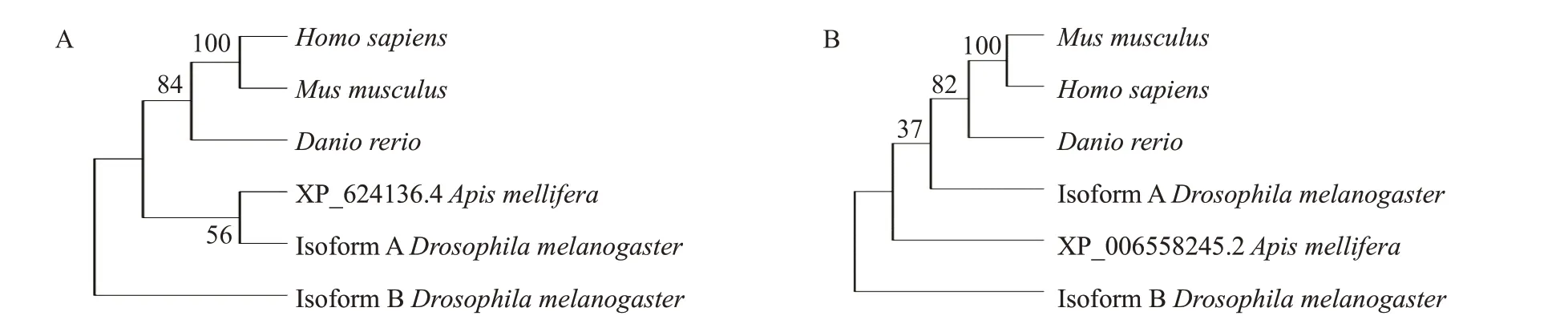
图15 基于Ci蛋白氨基酸序列相似性构建的系统发育进化树Fig.15 Phylogenetic tree based on Ci protein amino acid sequence similarity
2.6 意大利蜜蜂Ci蛋白的互作蛋白预测结果
通过String数据库预测分析与意大利蜜蜂Ci蛋白发生相互作用的蛋白,结果发现意大利蜜蜂Ci蛋白2个亚型的序列构象相同,均与kinesin-B、Ptc、Poz、Su(fu)、slmb、smo、Csnk1a1、cul-3和fu等驱动蛋白样蛋白(Kines in family member)形成相互作用网络(图16)。

图16 意大利蜜蜂Ci蛋白的互作蛋白网络Fig.16 Interacting protein network of Ci proteins in A. mellifera
3 讨论
Hh信号通路对脊椎动物和无脊椎动物的发育至关重要(Liu,2019),但目前鲜见针对Hh信号通路中Ci蛋白的相关研究报道。本研究通过探析意大利蜜蜂Ci蛋白的基本生物学信息,发现意大利蜜蜂Ci蛋白属于不稳定的两性蛋白(总平均亲水性在-0.5~0.5时为两性蛋白),无信号肽,无跨膜结构,具有5个典型的C2H2型锌指蛋白结构域,能与DNA结合而激活靶蛋白转录,与Hh信号通路中Suppressor of Fused与Gli/Ci蛋白复合物的结构及功能研究结果(张燕,2014)一致;亚细胞定位预测发现,意大利蜜蜂Ci蛋白XP_624136.4亚型定位在细胞核及囊细胞质中,XP_006558245.2亚型定位于细胞核、囊细胞质和线粒体中,与Wang和Holmgren(2000)报道的果蝇Ci蛋白仅定位于细胞核的研究结论有所不同,说明意大利蜜蜂Ci参与维持细胞正常形态,具有运输及结合的作用。Hh蛋白通过与Patched受体结合,激活Smoothened蛋白(smo),并最终改变Gli/Ci家族蛋白的转录活性(Zhou and Kalderon,2010),即Hh信号输出的决定因素是Gli/Ci转录因子活性(Pan et al.,2017)。
蛋白翻译后修饰通过功能基团或蛋白的共价添加、调节亚基蛋白水解切割或整个蛋白降解来增加蛋白组功能多样性,包括磷酸化、糖基化、泛素化、亚硝基化、甲基化、乙酰化、脂质化和蛋白水解,几乎影响正常细胞生物学及发病机制的所有过程(Jiang,2022)。蛋白磷酸化是调节和控制蛋白活力与功能最基本、最普遍、最重要的作用机制(Lee et al.,2019),同时调节多种细胞过程,如基因表达、代谢、细胞周期调节、分化及凋亡(Cohen,2002)。蛋白糖基化是翻译后最常见、最复杂的修饰之一,不仅极大地促进生物体蛋白组的扩展,超出基因组编码范围,还对蛋白的功能、稳定性、亚细胞定位等有重要影响(Eichler,2019)。苏木素化能调节细胞过程,如核运输、转录、染色体分离和DNA修复等(Gareau and Lima,2010),其发挥的具体作用包括改变底物与DNA、RNA或其他蛋白的相互作用,改变蛋白构象或酶活性,以及调节其他修饰(Flotho and Melchior,2013)。本研究结果表明,意大利蜜蜂Ci蛋白XP_624136.4亚型存在2个O-糖基化位点、174个磷酸化位点及5个苏木素化位点,XP_006558245.2亚型存在26个O-糖基化位点、156个磷酸化位点及5个苏木素化位点。虽然意大利蜜蜂Ci蛋白为不稳定蛋白,但磷酸化、糖基化和苏木素化促使Ci蛋白变得稳定,在细胞发育、细胞间信号传递及神经细胞功能调节等生物学功能中发挥重要的调节作用。
基于Ci蛋白氨基酸序列相似性构建的系统发育进化树显示,从昆虫到哺乳动物Ci蛋白序列高度保守。意大利蜜蜂Ci蛋白二级结构中无规则卷曲、延伸链分布较多,α-螺旋分布较少,其三级结构中长链卷曲较多;同时意大利蜜蜂Ci蛋白与kinesin-B、Ptc、Poz、Su(fu)、slmb、smo、Csnk1a1、cul-3和fu等驱动蛋白样蛋白形成相互作用网络。已有研究表明,介导Ci 转录的Hh 蛋白可结合到十二通道跨膜受体Patched蛋白(Ptc)上,从而解除Ptc介导的smo抑制七通道跨膜蛋白(Han et al.,2019);激活的smo又反向进行一系列复杂过程,包括抑制Ci抑制因子的加工及翻译后修饰,促进全长Ci在细胞质中积累与激活(Lum and Beachy,2004;Jiang and Hui,2008),最终全长Ci激活因子移位进入细胞核并刺激Hh靶蛋白表达,这些靶蛋白在细胞命运的进一步规范中发挥作用。Gli/Ci蛋白家族由多个结构域组成,含有不同的蛋白基序及其行使功能的相关修饰位点;而Ci/Gli转录因子的稳定性调控是调节Hh信号活性的重要途径(周紫章,2015)。由此可见,意大利蜜蜂Ci蛋白在生长发育、跨膜运输、突触传递、信号转导和蛋白生成过程中发挥重要作用。
4 结论
意大利蜜蜂Ci蛋白属于不稳定的两性蛋白,主要定位于细胞核中,少量分布在囊细胞质或线粒体中,具有5个典型的C2H2型锌指蛋白结构域,蛋白序列高度保守,在意大利蜜蜂Hh信号通路中主要承担转录功能,对意大利蜜蜂的生长发育、跨膜运输、突触传递、信号转导及蛋白生成等起重要调控作用。
