注射用头孢尼西钠残留溶剂质量分析
2022-03-18李佩李雪洪建文田洁
李佩 李雪 洪建文 田洁
(1 广东省药品检验所,广州 510663;2 国家药品监督管理局药品评价中心,北京 100022)
头孢尼西钠(cefonicid sodium),为第二代广谱、长效的头孢类抗生素,通过抑制细菌细胞壁合成产生抗菌活性,对革兰阳性和阴性菌以及一些厌氧菌均有抗菌作用,对大多数β-内酰胺酶稳定。临床上适用于下列敏感菌引起的感染:下呼吸道感染、尿路感染、败血症、皮肤软组织感染、骨和关节感染,也可用于手术预防感染[1-2]。
本实验室承担了2019年注射用头孢尼西钠国家评价性抽验[3-4],抽样共涉及13家生产企业80批次样品,通过对制剂的梳理,发现制剂质量受原料质量的影响较大,使用同一原料的不同制剂生产企业,其产品残留溶剂的种类和量呈现同一趋势,研究采用气相色谱的方法[5-6]对原料及制剂中的残留溶剂进行研究分析,提示企业应根据其生产工艺来建立个性化的质量控制要点,以保证产品的质量。
1 仪器与试药
气相色谱仪(Agilent 6890、Thermo Trace1300),检测器(氢火焰离子化检测器),色谱工作站(Empower、变色龙软件),电子天平(Sartorius CP225D,十万分之一),毛细管色谱柱(DB-1毛细管柱,30 m×0.53 mm,1.0 μm,SN:US4886831H、SUPELCO WAX-10毛细管柱,30 m×0.53 mm,1.0 μm,SN:64181-01A),样品(2019年国家评价性抽验样品以及企业提供的6批原料样品)。
2 方法与结果
2.1 残留溶剂的种类和量
照《中国药典》2020年版二部头孢尼西钠残留溶剂检测方法对样品进行检测[7],分析不同生产企业的注射用头孢尼西钠残留溶剂的差异。
2.1.1 色谱条件
以DB-1,30 m×0.53 mm,1.0 μm(SN:US4886831H)为色谱柱,程序升温,起始温度为45℃,保持5 min,再以10 ℃/min的速率升温至180℃;载气为氮气,流速为3 mL/min;FID进样口温度为150℃;检测器温度为200℃;顶空平衡温度为90℃,平衡时间为20 min。
2.1.2 溶液的制备及测定
对照品溶液精密称取甲醇、乙醇、乙腈、丙酮、乙酸乙酯、四氢呋喃和二氯甲烷各适量,加水定量稀释制成每1 mL中分别含甲醇0.6 mg、乙醇1.0 mg、乙腈0.082 mg、丙酮1.0 mg、乙酸乙酯1.0 mg、四氢呋喃0.144 mg和二氯甲烷0.12 mg的溶液,精密量取5 mL,置顶空瓶中,密封。
供试品溶液精密称取样品1.0 g,置顶空瓶中,精密加水5 mL使溶解,密封。
将对照品溶液与供试品溶液,分别顶空进样,记录色谱图。
2.1.3 供试品中残留溶剂的检测结果
按“2.1.1”项下的色谱条件对国评抽样中的26批制剂以及企业提供的6批原料进行检测,检测出第二类溶剂甲醇和四氢呋喃,第三类溶剂乙醇和丙酮,未检出第一类溶剂乙腈和二氯甲烷。不同企业间甲醇和乙醇的残留水平较为接近,且均在限度范围内;丙酮的量厂家A、B、C高于其他厂家,其主要受原料来源的影响;四氢呋喃仅存在厂家D~M中,厂家A、B、C中不存在,主要也是受原料的影响。通过对不同制剂及原料残留溶剂的检测,发现制剂残留溶剂的种类和量主要受原料影响,两家原料企业均未检出第一类溶剂,第二类和第三类溶剂均在可控范围内,使用原料企业B的制剂在残留溶剂方面质量优于企业A。结果见表1~2和图1。

图1 残留溶剂典型色谱图Fig.1 Typical chromatogram of residual solvent
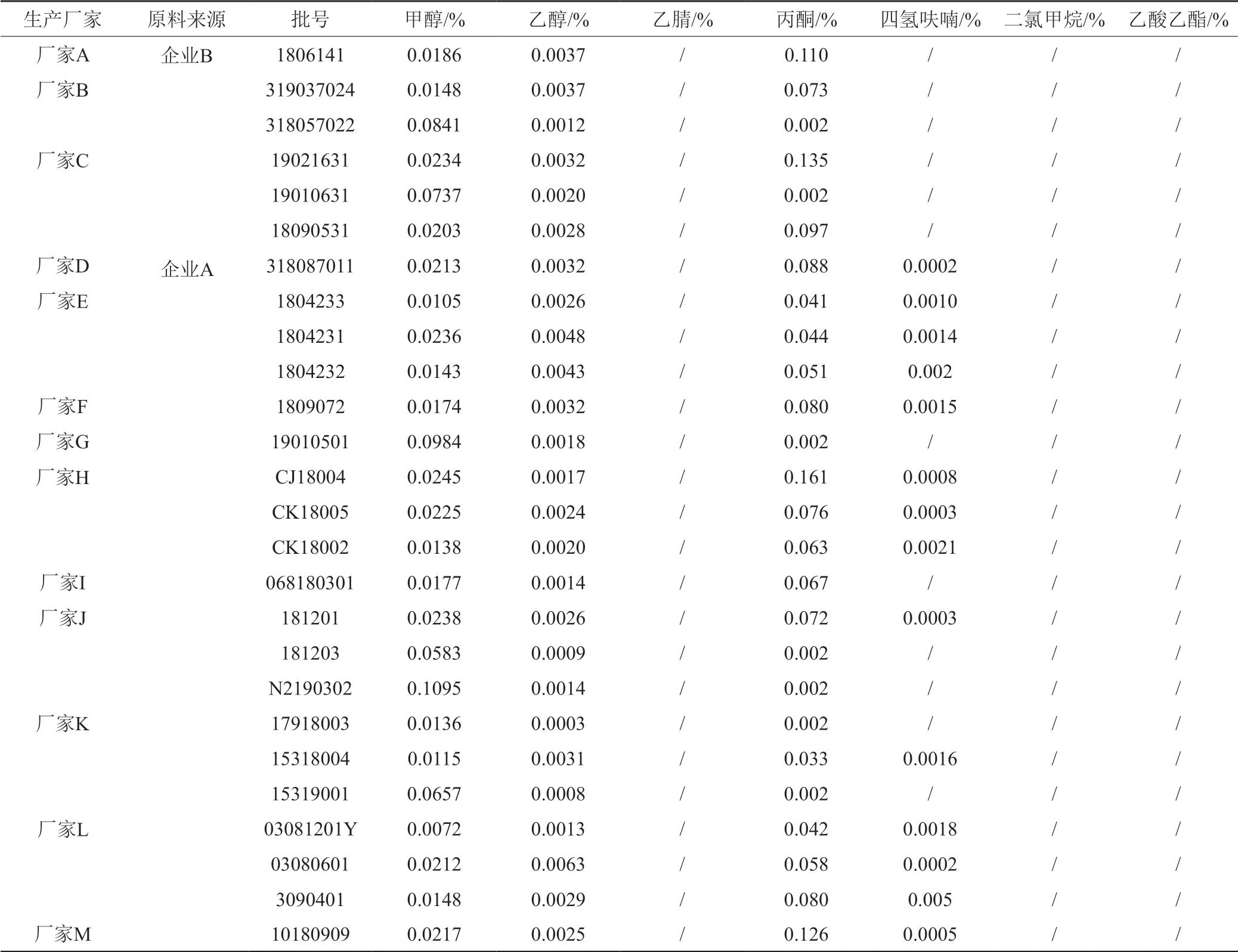
表1 供试品中残留溶剂测定结果Tab.1 The results of residual solvents in samples
2.1.4 需关注的溶剂
本次检测除药典规定的残留溶剂种类外,还发现3个溶剂峰。对3个溶剂进行研究,通过采用对照品定位、气相质谱联用等方法对溶剂进行定性。
溶剂峰1为异丙醇,属中国药典残留溶剂项下规定的第三类溶剂,应限制使用,推测原料合成工艺中使用了该溶剂,企业应对其进行控制,可采用中国药典现有残留溶剂方法进行检测控制。
溶剂峰2为异亚丙基丙酮,通过GC-MS联用技术,并使用异亚丙基丙酮对照品进行定性,其存在于原料企业B中,含量在0.001%~0.008%之间。典型色谱图见图2~3。
图2 异亚丙基丙酮对照品色谱图Fig.2 Chromatogram of isopropylidene acetone reference substance
由于在头孢尼西钠原料合成过程中未使用该物质,推测异亚丙基丙酮残留可能有以下两个原因:①原料合成过程中使用了回收再利用的丙酮,该丙酮中含有异亚丙基丙酮,从而导致其残留在原料中;②合成过程中使用的丙酮与起始物料反应产生了该物质。异亚丙基丙酮为不饱和酮具有遗传毒性致癌警示结构(QSAR评估——3类杂质:不饱和酮,含有与原料药有无关的警示结构,无致突变性数据),企业应确保将该溶剂控制在安全阈值以下。
溶剂峰3为2-乙基己酸,原料合成过程中的成盐剂2-乙基己酸钠是头孢尼西酸的成盐过程中提供钠离子的载体,反应过程中2-乙基己酸钠转化成2-乙基己酸,2-乙基己酸是一种有害物质,对皮肤、黏膜有刺激作用[8],因此需要对该溶剂的残留进行控制。
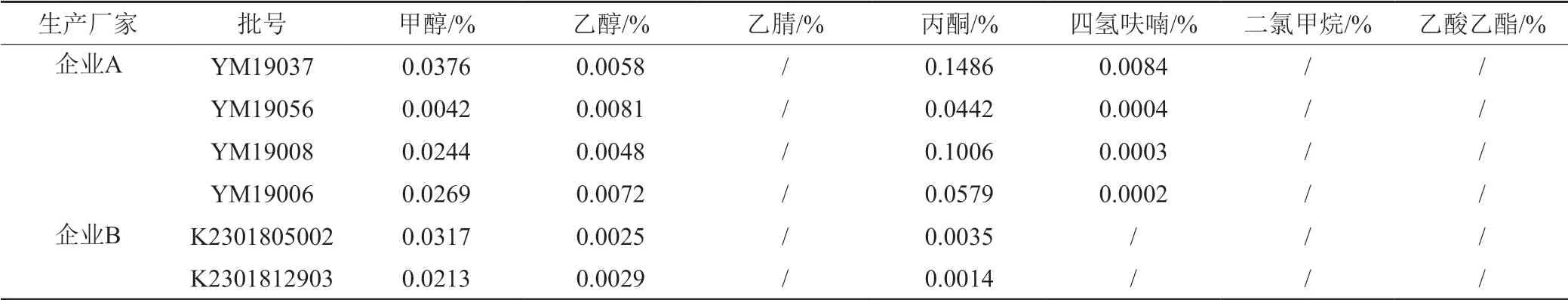
表2 原料中残留溶剂测定结果Tab.2 The results of residual solvents in API
2.2 2-乙基己酸检测方法的建立
为了更好地对2-乙基己酸的残留量进行控制,在《中国药典》2-乙基己酸的检测方法基础上,建立头孢尼西钠中2-乙基己酸检测方法,并进行了方法验证。
2.2.1 色谱条件
以SUPELCO WAX-10毛细管柱,30 m×0.53 mm,1.0 μm(SN:64181-01A)为色谱柱,载气为氮气,流速为7.0 mL/min,检测器为FID,检测器温度为300℃,柱温为150℃,进样口温度为200℃,进样体积为1 μL。
2.2.2 溶液的制备及测定
盐酸溶液:量取33 mL浓盐酸,置100 mL量瓶中,用水稀释至刻度,即得。
图3 供试品典型色谱图Fig.3 Typical chromatogram of sample
内标溶液:精密称取3-环己丙酸约250 mg,置250 mL量瓶中,用环己烷溶解并稀释至刻度,摇匀,即得。
对照品溶液:精密称取2-乙基己酸对照品75 mg,置50 mL量瓶中,用内标溶液溶解并稀释至刻度,摇匀;精密量取l mL,置离心管中,加33%盐酸溶液4.0 mL,剧烈振摇1 min,离心,取上层清液。
供试品溶液:精密称取供试品约0.3 g,置离心管中,加33%盐酸溶液4.0 mL使溶解,精密加入内标溶液l mL,剧烈振摇1 min,离心,取上层清液。
将对照品溶液与供试品溶液,精密量取1.0 μL,分别进样,记录色谱图。
2.2.3 线性关系考察
精密称取2-乙基己酸对照品适量,制成不同浓度的标准溶液,按“2.2.1”色谱条件分别进样,记录峰面积,以进样浓度为横坐标,峰面积为纵坐标,绘制标准曲线,结果表明2-乙基己酸在浓度0.0501~2.5050 mg/mL范围内线性关系良好,回归方程y=0.9401x+0.0039,相关系数r=0.9997。
2.2.4 准确度试验
内标溶液:精密称取3-环己丙酸约250 mg,置250 mL量瓶中,用环己烷溶解并稀释至刻度,摇匀,即得。
对照品储备液制备:精密称取2-乙基己酸75 mg,置25 mL量瓶中,加内标溶液稀释至刻度,摇匀,即得。
对照品溶液1、2、3:分别精密量取对照品储备液2、2.5和3 mL,分别置5 mL量瓶中,用内标溶液稀释至刻度,摇匀,即得。
取注射用头孢尼西钠(批号:068180301)约0.3 g,精密称定,称取9份,分别置10 mL离心管中,将9份溶液分别加入33%盐酸溶液4 mL,精密加入对照品溶液1、2、3各l mL,剧烈振摇1 min,离心,取上层清液,测定2-乙基己酸的量。结果见表3。
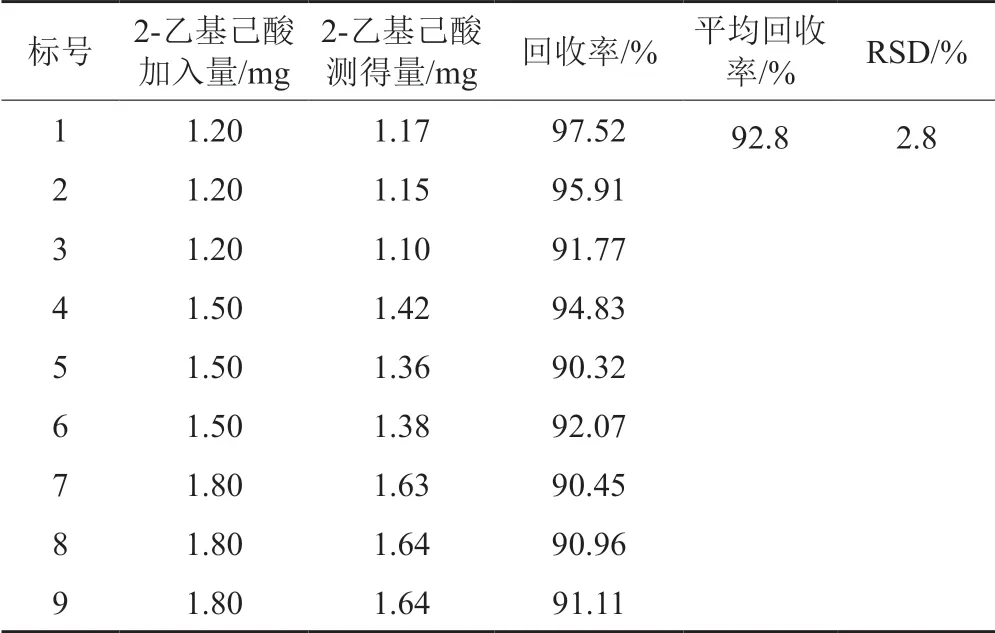
表3 2-乙基己酸准确度测定结果Tab.3 The accuracy results of 2-ethylhexanoic acid
2.2.5 重复性试验
照“2.2.2”项下方法配制成供试品溶液6份进行测定。结果表明,6份供试品中2-乙基己酸含量的RSD为1.6%,符合要求。重复性结果见表4。

表4 重复性实验结果Tab.4 The results of repeatability
2.2.6 检出限和定量限试验
精密称取2-乙基己酸对照品,用内标溶液逐级稀释,取各浓度试验用溶液依次注入气相色谱仪进行分析。调节仪器灵敏度,以信噪比3为检出限,最低检出浓度为2.4 μg/mL;信噪比10为定量限,最低定量浓度为4.8 μg/mL。
2.2.7 耐用性试验
按照“2.2.1”色谱条件,分别调节流速为5 mL/min、9 mL/min以及柱温为140℃、160℃,其他色谱条件保持不变,进行试验,考察2-乙基己酸以及3-环己丙酸的出峰时间、分离度及理论塔板数,结果表明不同条件下分离度及理论板数均符合要求,说明该方法耐用性良好。耐用性试验检测结果见表5。
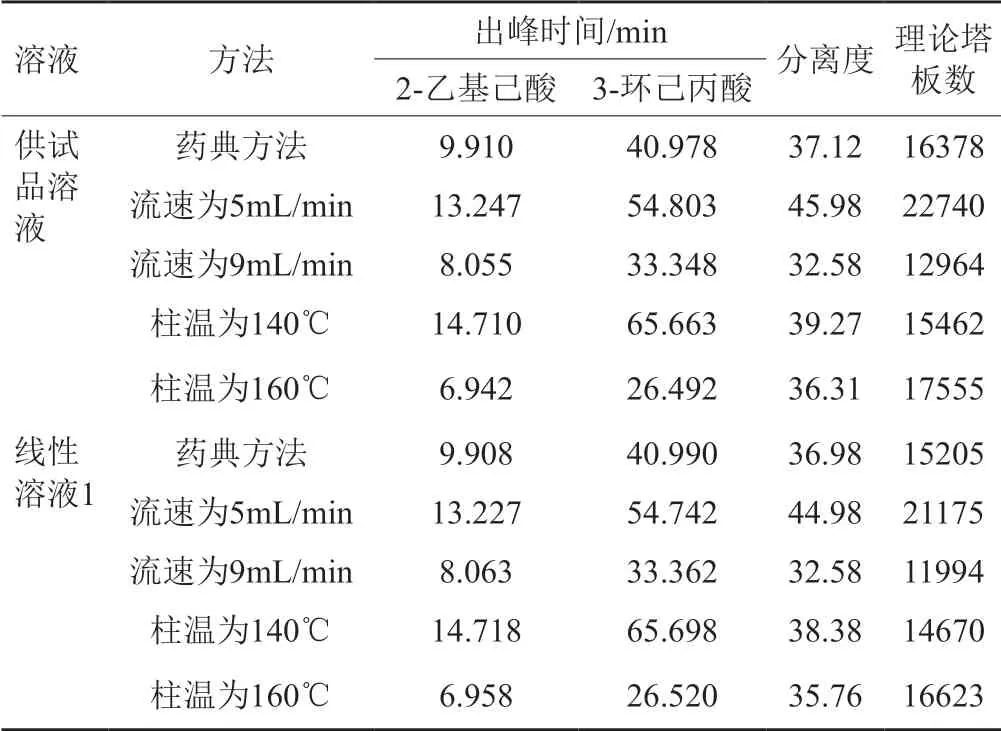
表5 耐用性试验检测结果Tab.5 The results of durability
2.2.8 供试品中2-乙基己酸的检测结果
本次验证中10家生产企业生产的63批次供试品,均采用上述方法进行检测,结果均在限度(0.3%)范围内,且批间稳定性较好。检测结果见表6。

表6 供试品中2-乙基己酸的检测结果Tab.6 The test results of 2-ethylhexanoic acid in samples
3 结论
按《中国药典》2020年版头孢尼西钠残留溶剂方法检测,国内产品残留溶剂控制得比较好,未检出一类溶剂,其他残留溶剂的量也控制在较低水平。
本次残留溶剂检测中发现3个需要关注的溶剂,现有标准未控制,但产品中实际存在,其中2个有一定的毒性,分别为2-乙基己酸和异亚丙基丙酮,需要关注和控制,研究建立了2-乙基己酸的检测方法对其进行控制。
通过对注射用头孢尼西钠残留溶剂的质量分析,进一步显示残留溶剂与原料合成工艺密切相关,也揭示工艺的变化和稳定性,作为药品安全性指标,《中国药典》2020年版中对残留溶剂控制的要求指出,企业应根据生产工艺的特点,制定相应的限度,使其符合产品规范、药品生产质量管理规范(GMP)或其他基本的质量要求,因此需要企业根据自身产品情况制定方法和限度要求,以保证药品的安全和质量。
