定量磁化率成像对比复发缓解型多发性硬化与视神经脊髓炎谱系疾病患者深部灰质铁含量
2022-03-18王小花李咏梅陈晓娅代林泉
王小花,李咏梅,陈晓娅,丁 爽,曾 春,代林泉,郑 桥
(重庆医科大学附属第一医院放射科,重庆 400016)
多发性硬化(multiple sclerosis,MS)和视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorder,NMOSD)均属中枢神经系统常见特发性炎性脱髓鞘疾病,前者多为复发缓解型(relapsing-remitting MS,RRMS),其临床表现、实验室检查及影像学表现均与NMOSD类似,但病理改变存在本质差异。既往多种磁敏感MRI研究[1-3]发现MS和NMOSD患者深部灰质存在铁含量异常,尤以MS为著,但结果存在较大差异,且纳入病例病程多较长(>10年);目前对于疾病早期灰质铁含量变化尚不清楚。定量磁化率成像(quantitative susceptibility mapping,QSM)可无创定量评价组织铁含量,且克服了磁敏感加权成像的相位卷褶伪影,定量更为准确。本研究采用QSM定量分析RRMS和NMOSD患者深部灰质铁含量差异及其与运动、认知障碍的相关性。
1 资料与方法
1.1 研究对象 纳入2019年8月—2020年11月35例于重庆医科大学附属第一医院诊断为RRMS的患者(RRMS组),男11例,女24例,年龄22~54岁,平均(33.7±8.4)岁,中位病程4.6(1.0,8.5)年,平均受教育年限(13.3±2.8)年;NMOSD患者30例(NMOSD组),男8例,女22例,年龄18~55岁,平均(35.6±10.4)岁,中位病程3.0(1.8,4.3)年,平均受教育年限(12.9±3.5)年。纳入标准:①年龄18~55岁;②病程<10年;③参照文献[4]标准诊断RRMS,参照文献[5]标准诊断NMOSD。排除标准:①罹患其他神经精神疾病;②颅脑手术及外伤史;③MR扫描禁忌证。同期招募30名年龄及性别相匹配的健康人作为对照组,男9名,女21名,年龄21~52岁,平均(36.5±7.7)岁,平均受教育年限(13.4±3.8)年。本研究经院伦理委员会审查通过(编号:2018QNXM004)。检查前受试者均签署知情同意书。
1.2 仪器与方法 采用Siemens Magnetom Skyra 3.0 T MR扫描仪,32通道标准头部线圈,行头部扫描,范围为颅顶至枕骨大孔,轴位扫描均以中间矢状面定位,中心线平行于前后连合线。参数:轴位3D-T1W,TR 2 300 ms,TE 2.26 ms,FOV 256 mm×256 mm,矩阵256×256,层厚1.0 mm;3D液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列,TR 5 000 ms,TE 388 ms,FOV 256 mm×256 mm,矩阵256×256,层厚1.0 mm;QSM,TR 36.0 ms,TE1 7.50 ms,△TE 7.5 ms,TE4 30.0 ms,FOV 220 mm×220 mm,矩阵256×256,层厚2.0 mm,FA 20°。
1.3 图像重建及数据处理 基于Matlab R2013b(Version 8.2.0.701)平台的STISuite(Version 3.03;http://people.eecs.berkeley.edu/chunlei.liu/software.html)软件重建QSM,包括场图拟合、相位解缠绕、背景场去除及磁化率反演各步骤。基于FSL(Version 5.0.10;https://fsl.fmrib.ox.ac.uk/fsl/fslwiki/)软件包将个体空间QSM配准至蒙特利尔神经学研究所(Montreal Neurological Institute,MNI)空间坐标[6];利用Matlab平台的SPM8(Version 6313;https://www.fil.ion.ucl.ac.uk/spm/software/spm8/)软件提取配准后QSM中各深部灰质核团的定量磁化率值(quantitative susceptibility value,QSV),以双侧尾状核、苍白球、壳核、丘脑、黑质、红核及齿状核为ROI(图1)。
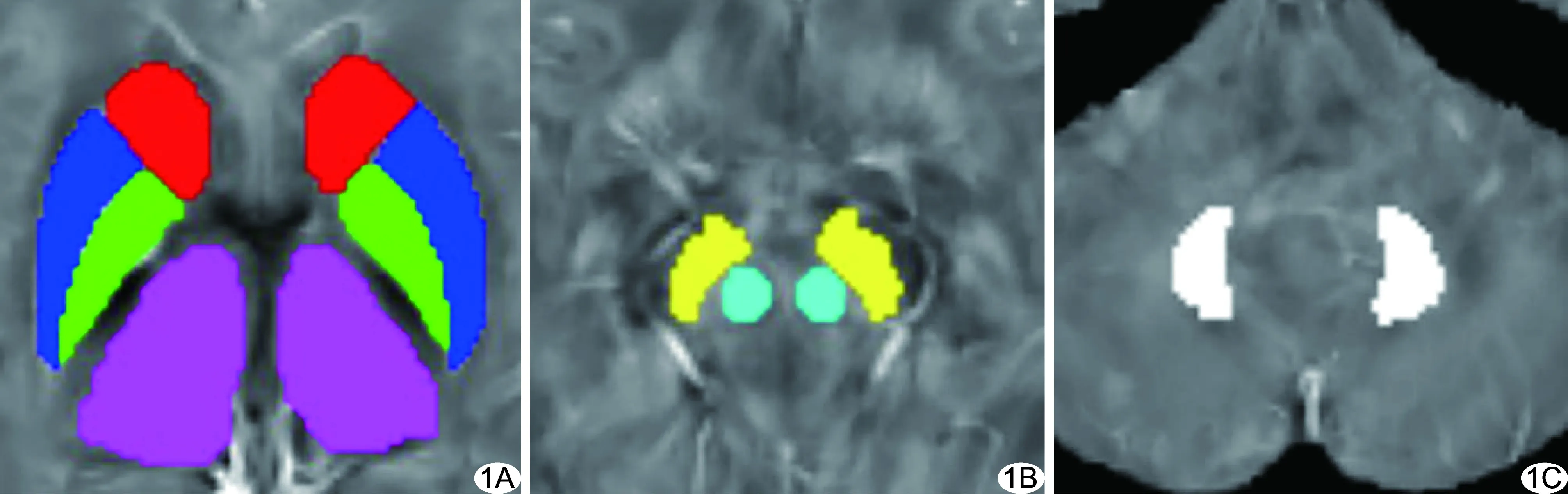
图1 RRMS患者,女,29岁,右眼视物模糊,自觉记忆力下降1周 A~C.配准后QSM图中对应ROI,包括尾状核头(红色)、苍白球(绿色)、壳核(深蓝色)、丘脑(粉色)、黑质(黄色)、红核(青色)及齿状核(白色)
1.4 功能评价 由1名具有5年以上工作经验的神经内科医师采用扩展残疾状态量表(expanded disability status scale,EDSS)评估受试者运动功能,以蒙特利尔认知评估(Montreal cognitive assessment,MoCA)快速筛查认知功能,以数字广度测验(digit span task,DST)和符号数字模式测验(symbol digit modalities test,SDMT)评价具体记忆工作和信息处理速度。
1.5 统计学分析 采用SPSS 22.0统计分析软件。以±s表示符合正态分布的计量资料,组间行单因素方差分析,之后行Bonferroni法校正检验;以中位数(上下四分位数)表示呈偏态分布的计量资料,组间行Mann-WhitneyU检验;采用χ2检验比较组间性别差异。采用Spearman秩相关分析及Pearson直线相关分析评价QSV异常与EDSS及认知评分的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料及功能评分 RRMS组、NMOSD组与对照组性别(χ2=0.18,P=0.91)、年龄(F=0.86,P=0.43)及受教育年限(F=0.23,P=0.79)差异均无统计学意义。RRMS组与NMOSD组病程差异无统计学意义(Z=0.59,P=0.55)。
RRMS组EDSS评分与NMOSD组差异无统计学意义(P>0.05)。3组MoCA、DST及SDMT评分差异均有统计学意义(P均<0.05);RRMS组的MoCA、DST评分均低于对照组(P均<0.05),NMOSD组的MoCA、SDMT评分均低于对照组(P均<0.05);RRMS组与NMOSD组各认知评分差异均无统计学意义(P均>0.05),见表1。

表1 RRMS患者、NMOSD患者与健康人的功能评分比较(分)
2.2 灰质核团QSV差异 3组丘脑及黑质QSV差异均有统计学意义(P均<0.05)。相比NMOSD组及对照组,RRMS组丘脑QSV显著降低、黑质QSV显著升高(P均<0.05),其余灰质核团差异均无统计学意义(P均>0.05)。NMOSD组与对照组各灰质核团QSV差异均无统计学意义(P均>0.05),见表2。

表2 RRMS患者、NMOSD患者与健康人各深部核团QSV比较(ppb)
2.3 相关性分析 RRMS组丘脑及黑质QSV与EDSS无显著相关(rs=-0.26,P=0.13;rs=-0.10,P=0.55),丘脑QSV与DST评分呈正相关(r=0.41,P=0.02);以年龄、受教育年限及病程为协变量,丘脑QSV仍与DST评分呈正相关(r=0.39,P=0.03)。其余核团QSV与各评分均无显著相关(P均>0.05)。
3 讨论
铁是细胞内许多辅酶的必需微量元素,为神经元发育、髓鞘合成及线粒体能量代谢等脑功能活动所必不可少;但过量的铁会促进自由基形成,导致氧化应激及神经变性。MS和NMOSD发病机制均涉及氧化应激[7],与铁稳态紊乱有关,但具体机制尚不清楚。既往研究[8]显示,MS患者白质病灶存在异常铁沉积,而NMOSD多不明显;MS病灶早期乏铁,但随病程发展逐渐出现异常铁沉积[9]。
本研究RRMS组丘脑QSV较NMOSD组及对照组显著降低,其他核团QSV多升高,尤以黑质为著,提示RRMS患者疾病早期即存在明显铁紊乱;而丘脑结构和功能复杂,呈现出特殊的变化模式,与既往报道[1,3,10]相符。BERGSLAND等[11]发现MS患者深部灰质铁含量与血清铁呈正相关,推测可能是病理损伤引起局部血-脑铁移位所致。BURGETOVA等[10]进一步比较MS各亚型,发现RRMS丘脑QSV低于原发进展型MS。ZIVADINOV等[3]认为继发进展型MS较RRMS丘脑QSV更低,且与长病程相关;其余核团QSV均无显著差异,凸显了丘脑QSV用于观察MS亚型的价值,但目前对于MS致丘脑铁浓度降低的具体机制尚不清楚。PONTILLO等[12]报道,MS患者丘脑铁浓度与局部体积减小相关;但ZIVADINOV等[3]发现,校正结构体积后,丘脑铁浓度减少与局部铁代谢异常有关;SCHWESER等[13]对比观察铁浓度与铁含量变化,认为MS患者深部灰质铁浓度异常与铁的主动消耗相关。丘脑是中枢主要中转中心,有研究[14]显示丘脑铁浓度异常与其连接的白质纤维束异常相关。但上述研究结论多由推测而来,需要进一步结合尸检及组织病理研究探究其具体机制。
本研究发现NMOSD组深部灰质QSV相比对照组无显著差异,铁含量虽呈减少趋势,但程度较低,与前期研究结果[2.15]相似。MS的炎性反应导致活化的巨噬细胞吞噬损伤富含铁的髓鞘、少突胶质细胞及衰老红细胞,引发明显铁代谢紊乱;NMOSD则为特异性抗体抗水通道蛋白4(aquaporin 4,AQP4)所致星形胶质细胞损伤,其通过调节小胶质及少突胶质细胞等活性引起的铁代谢紊乱程度较低,且其脑组织损伤主要与AQP4抗体分布有关,而深部灰质并非AQP4富集区。DORING等[16]观察12例神经脊髓炎患者,发现其红核QSV降低;PUDLAC等[1]则发现神经脊髓炎患者黑质QSV升高,而红核未见差异;结果存在差异,可能与纳入样本的年龄、病程及图像后处理方法不同等相关。目前对于NMOSD深部灰质铁含量异常的研究较少且尚无定论,对于铁代谢与NMOSD病理机制的相关性还需进一步观察。
约43%~70%的MS患者存在认知障碍[17],信息处理速度和记忆工作最常受累。本研究中RRMS组各认知评分较对照组明显降低,且丘脑QSV与DST评分呈正相关。丘脑核团中,组成基底外侧边缘环路的背内侧核及通过与前额叶皮质连接的丘脑前核已被证明与认知高度相关[18],相关改变可进一步证明丘脑QSV降低与认知下降有关。EDSS是最常用于评估MS和NMOSD患者残疾程度的指标,但本研究未观察到各灰质核团QSV与EDSS的相关性,与既往文献[3]报道存在差异,考虑与EDSS及疾病波动有关;且本研究仅纳入RRMS患者进行横向研究,未能分析不同类型MS铁浓度差异及各灰质核团铁浓度随时间变化的规律。
总之,QSM可定量检测RRMS和NMOSD患者深部灰质的铁含量。RRMS相对早期阶段深部灰质即可出现明显铁紊乱,且与患者认知障碍相关;而NMOSD患者灰质铁含量未见明显异常。
