华东沿海地区多中心40例胰腺肿瘤患者基因组图谱分析
2022-03-18赵志杰仲灏辰曲林林
王 晶, 谭 斌, 赵志杰, 仲灏辰, 曲林林
青岛大学附属医院 肝胆胰外科, 山东 青岛 266003
胰腺癌是最常见的恶性肿瘤之一,且预后差,由于其隐匿性,许多中晚期患者失去了手术机会。近年来,靶向药物和免疫检查点抑制剂在多种实体肿瘤中得到了有效应用,但在胰腺癌的治疗中却难以取得突破性进展,5年生存率不足9%[1]。随着基因检测技术和下一代测序技术在临床上的广泛应用,越来越多的肿瘤针对特定的驱动基因进行靶向治疗,一些罕见的基因突变可用于指导临床作出个体化治疗决策。为了解我国沿海地区胰腺癌基因突变图谱,本研究对胰腺癌患者进行了肿瘤相关基因全序列、突变基因序列和潜在药物靶点序列的比对。
1 资料与方法
1.1 研究对象 选取2017年1月—2019年6月青岛大学附属医院、青岛市立医院、烟台山医院、烟台中法友好医院收治的胰腺恶性肿瘤患者,并进行随访。纳入标准:经病理诊断为胰腺恶性肿瘤。排除标准:(1)未行手术治疗的患者;(2)临床资料缺失。
1.2 研究方法 采集肿瘤样本和血液对照样本,进行下一代测序。对纳入患者的肿瘤组织样本和血液样本进行基因组检测。从所有固定石蜡包埋样本中提取至少50 ng DNA。从全血分离的血细胞中提取DNA作为对照,用于鉴定胚系突变。应用Illumina测序仪检测肿瘤相关基因的全部编码外显子和在实体瘤中频繁重排的内含子,测序结果平均覆盖1000倍,基因组改变的评估包括单碱基替换、短插入/缺失和长插入/缺失、拷贝数变异和基因重排。
1.3 伦理学审查 本研究方案经由青岛大学附属医院伦理委员会审批,批号:QYFYWZLL26520,所纳入患者均签署知情同意书。
1.4 统计学方法 应用SPSS 26.0软件进行统计分析。计数资料组间比较采用χ2检验或Fisher精确检验。采用Kaplan-Meier法绘制生存曲线,组间比较采用log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共纳入40例胰腺肿瘤患者,其中男26例,女14例,中位年龄59岁(31~77岁)。40例患者中转移组织病理标本7例,原发肿瘤病理标本33例,其中胰腺导管腺癌(PDAC)34例(85.0%),胰腺实性假乳头状肿瘤(SPN)3例(7.5%),胰腺神经内分泌肿瘤(PNET)1例(2.5%),分型不清2例(5.0%)。Illumina测序仪共检测出450个肿瘤相关基因的全部编码外显子和64个在实体瘤中频繁重排的内含子。
2.2 全突变分析 采用下一代测序技术对40例胰腺癌患者的450个基因进行测序,并对其病理结果进行分析。随访40例患者的生存时间,比较不同基因突变生存时间的差异。前5位突变基因分别是KRAS(80.0%,32/40)、TP53(70.0%,28/40)、CDKN2A(32.5%,13/40)、SMAD4(17.5%,7/40)和AKT2(17.5%,7/40);在32例胰腺癌标本中检测到KRAS,其中单核苷酸变异30例,复制数量变异2例(附录1)。65%(26/40)的患者至少有1个潜在的药物靶点,包括ATM、BRCA1、BRCA2、BRAF、CDKN2A、CDK6、CTNNB1、ERBB3、ERBB4、FGFR1、FGFR3、FGFR4、NTRK3、PTEN、PIK3CA、VEGFA、YES1和PD-L1。
2.3 基于性别的突变分析 男性胰腺癌患者突变最高的基因为KRAS(76.92%,20/26)和TP53(69.23%,18/26),女性胰腺癌患者突变最高的基因亦为KRAS(78.57%,11/14)和TP53(71.43%,10/14);在靶向药物的突变基因中,ACVR2A、AMER1、ATM、GATA3、GLI1、KMT2C、RB1、TET3、TGFBR2突变仅见于男性患者,LRP2、ROCK1、VEGFA突变仅见于女性患者(图1)。
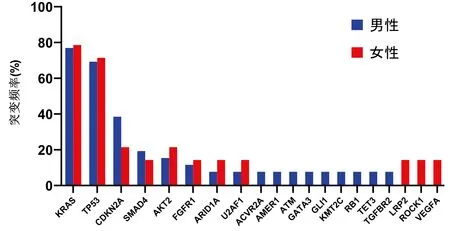
图1 男女胰腺癌患者最常见的突变基因
2.4 基于年龄的突变分析 将纳入患者分为5个年龄组:Ⅰ组31~40岁(10.0%,4/40),Ⅱ组41~50岁(12.5%,5/40),Ⅲ组51~60岁(30.0%,12/40),Ⅳ组61~70岁(30.0%,12/40),Ⅴ组71~80岁(17.5%,7/40)。结果显示,第Ⅰ组中突变频率最高的基因为TP53和KRAS,第Ⅱ组中突变频率最高的基因为KRAS和CDKN2A,第Ⅲ组中突变频率最高的基因为TP53和KRAS,第Ⅳ组中突变频率最高的基因为KRAS,第Ⅴ组中突变频率最高的基因为KRAS、TP53和FGFR1;对于TP53突变频率,Ⅱ组与Ⅲ组(P=0.02)比较、Ⅲ组与Ⅳ组(P=0.02)比较,差异均有统计学意义;对于FGFR1突变频率,Ⅲ组与Ⅴ组比较,差异有统计学意义(P=0.02)(图2)。
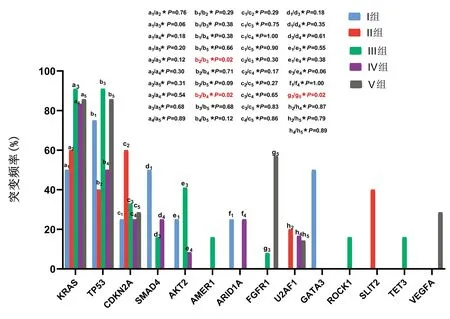
图2 不同年龄组中最常见的突变基因
2.5 基于侵犯类型的突变分析 胰腺癌伴神经侵犯20例患者中,前5位突变基因分别为KRAS(95%,19/20)、TP53(75%,15/20)、AKT2(30%,6/20)、CDKN2A(30%,6/20)和SMAD4(20%,4/20)。胰腺癌伴血管侵犯3例患者中,前2位突变基因分别为KRAS(100%,3/3)和TP53(66.67%,2/3)(图3)。
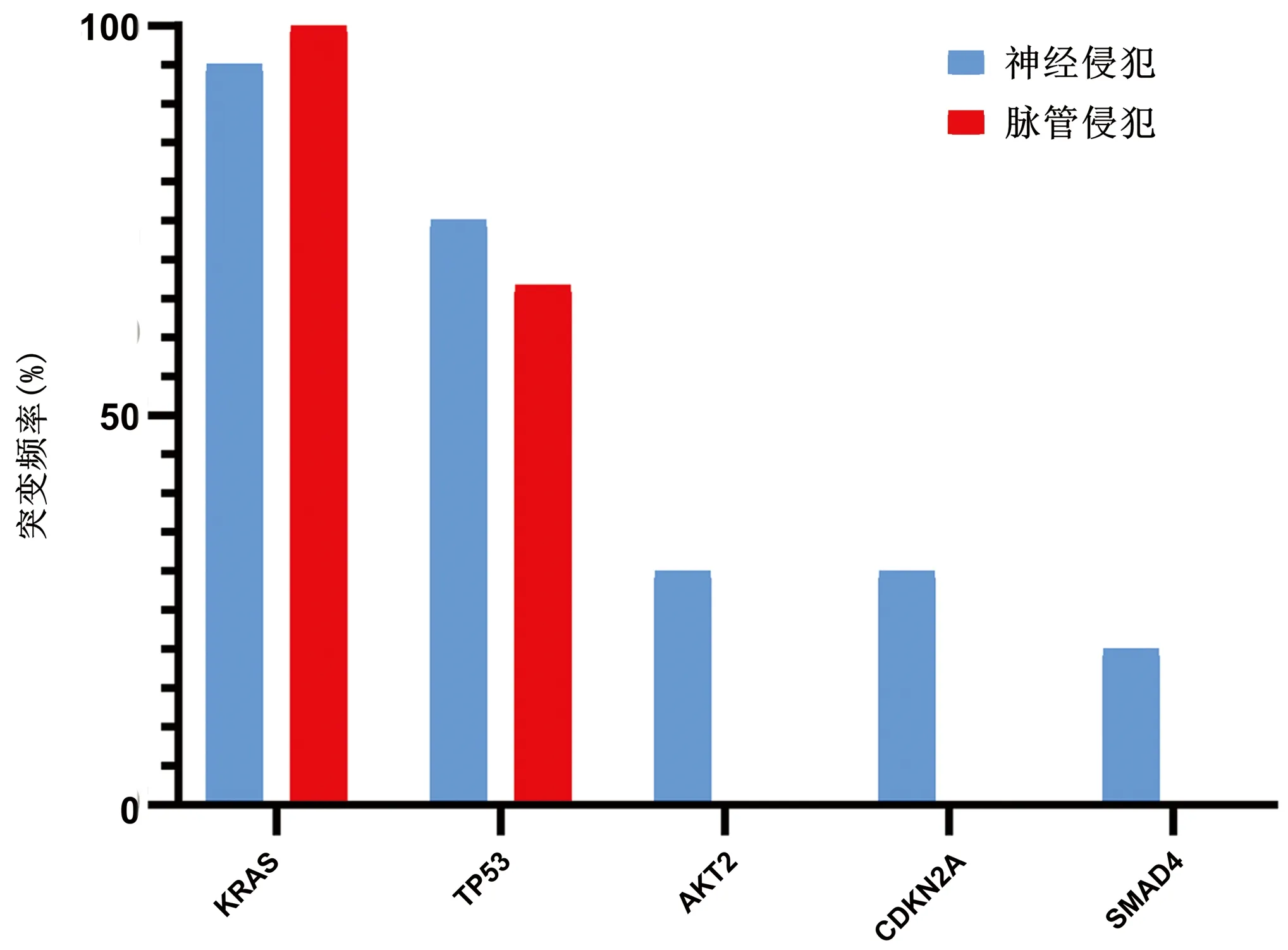
图3 神经和血管侵犯中最常见的突变基因
2.6 突变基因的生存曲线分析 在34例PDAC中,KRAS的突变率最高(100%)。在本研究中,SPN和PNET不存在TP53和KRAS突变;CTNNB1是SPN和PNET所特有的,PNET可与PDAC相鉴别(附录1)。肿瘤突变负荷(TMB)和细胞程序性死亡-配体1(PD-L1)是新兴的基因组生物标志物,可用于检测肿瘤基因组中基因突变的数量[2],故分析了与免疫治疗相关的预测指标TMB和PD-L1,结果显示,40例患者无TMB-H表达,仅有1例PD-L1表达呈40%。40例患者的中位总生存期为14.1个月(1.57~40.63个月),生存分析结果显示,有无KRAS、TP53、AKT2、CDKN2A、SMAD4和CTNNB1突变的患者生存时间差异均无统计学意义(P值均>0.05)(图4)。
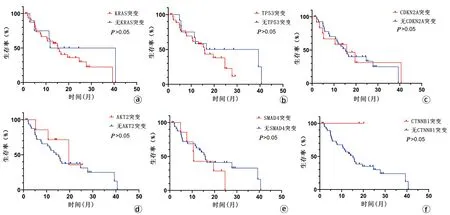
注:a,KRAS基因突变生存分析;b,TP53基因突变生存分析;c,CDKN2A基因突变生存分析;d,AKT2基因突变生存分析;e,SMAD4基因突变生存分析;f,CTNNB1基因突变生存分析。图4 胰腺癌突变基因生存分析
3 讨论
目前,手术切除已成为胰腺癌潜在的治疗方法,部分患者可接受根治性切除,但由于胰腺癌通常发现时已处于晚期,因此许多患者在经历了根治性手术后仍有肿瘤复发。故寻找胰腺癌早期诊断的新指标,为胰腺癌的防治探索可能的治疗靶点显得尤为重要。在我国,晚期胰腺癌患者的化疗很常见。在过去30年里,吉西他滨是胰腺癌治疗的黄金标准,总体生存率实现了适度的改善。以吉西他滨为主的联合化疗已成为晚期胰腺癌的一线治疗方案,并显示出较好的临床疗效和生存率。吉西他滨联合NAB-紫杉醇的中位生存期为8.5个月[3]。另外,三药联合化疗FOLFIRINOX方案仅10.2个月[4],中位生存期不足1年。先进的基因检测技术、分子靶向药物和免疫治疗为胰腺癌的精准治疗带来了一线曙光。本研究应用下一代测序技术对40例胰腺癌患者的基因突变图谱进行分析,探索胰腺癌可能的药物靶点,以及我国沿海地区胰腺癌基因突变的规律;分析和比较了不同胰腺癌(PDAC、SPN和PNET)的基因突变类型。结果发现,PDAC患者中KRAS突变率最高,SPN和PNET患者均未发现TP53和KRAS基因突变;在前5位突变基因中,可能的药物靶点是CDKN2A,其突变率为32.5%。CDKN2A功能的丧失可能导致周期蛋白依赖性激酶(CDK)2/4/6的激活。因此,CDK抑制剂可以作为CDKN2A基因突变肿瘤的治疗选择。研究[5]显示,胰腺癌细胞株在体外实验中对CDK抑制剂具有不同的反应;此外,该研究还对胰腺癌细胞耐药机制和CDK4/6抑制剂与选择性治疗剂联合使用的可能性进行了讨论。胰腺癌中CDKN2A基因突变的预测和预后尚不清楚。然而,有研究[6]表明,P16伴随着TP53和CDKN2A的丢失与淋巴浸润和术后广泛的转移有关。到目前为止,尚无CDKN2A和CDK4/6突变在胰腺癌中的临床试验。KRAS基因位于人类12号染色体的短臂上,全长约50 kb。KRAS通常被描述为“分子开关”,其编码蛋白通过构象变化等途径发挥不同的功能。当功能正常时,KRAS可以正常地调节细胞的生长过程;在功能异常时,可引起细胞内信号转导过程的紊乱,细胞过度增殖,最终导致肿瘤的发生。KRAS基因突变在胆管癌、结肠癌、直肠癌、胆囊癌、肺癌等多种恶性肿瘤组织中均有发现。已知KRAS突变存在于大多数胰腺癌中,突变率为90%~95%[7],而本研究中KRAS基因突变率为80%,低于其他研究结果。动物实验[8]发现,通过阻断KRAS下游信号通路的MEK抑制剂,联合吉西他滨可以抑制人胰腺癌裸鼠移植瘤的生长。大多数胰腺癌KRAS突变可通过吉西他滨联合NAB-紫杉醇化疗方案、基因检测技术、分子靶向药物和免疫治疗等相关治疗方法来解决,但这些治疗方法均未能证明对总体存活率有显著的临床益处[9]。
TP53基因位于人类17号染色体的短臂上,全长约15 kb,是一种典型的抑癌基因,其p53蛋白可以维持基因稳定,防止基因突变,被称为“基因守护者”。TP53基因可以通过参与多种生物学过程来抑制肿瘤的发生和发展,包括激活DNA修复过程,调节细胞周期以抑制细胞增殖,以及在DNA不可逆损伤后激活细胞凋亡。在结肠癌、肝癌、胆管癌、胆囊癌、肺癌、乳腺癌等多种恶性肿瘤中均检测到TP53基因突变,提示TP53基因突变与多种癌症的发生、发展密切相关。有研究[10]显示,胰腺癌中TP53基因突变已达到50%~75%,突变概率约为73%[11]。本研究中TP53基因突变率为70%。在KRAS基因启动激活突变后,TP53基因突变促使KRAS诱导的癌前病变迅速发展为胰腺癌[10]。目前尚无针对胰腺癌TP53基因突变的药物临床试验。本研究结果进一步证实了KRAS和TP53在胰腺癌中具有较高突变率,它们可能成为治疗胰腺肿瘤的潜在靶点。研究[12-13]显示,胰腺癌中SMAD4基因突变的概率为30%~64%,而本研究SMAD4基因突变率为17.5%,低于其他研究。SMAD4在胰腺癌中很常见,但其作用仍需研究。大量研究[14-17]表明,SMAD4基因突变与预后不良和复发有关。AKT2基因负责调控代谢、细胞增殖、存活、生长和血管生成等多种生物学过程,其作为细胞内PI3K/Akt通路的重要组成部分,通过一系列下游底物的丝氨酸和/或苏氨酸磷酸化来介导信号级联反应。AKT2可被血小板衍生生长因子激活,并调节肿瘤细胞的增殖、迁移、侵袭和转移。AKT2基因拷贝数增加可能导致蛋白过表达,抑制AKT2表达可降低胰腺癌细胞系的致瘤性[18-19]。研究[20-21]证明,AKT2与胰腺癌、前列腺癌和卵巢癌等多种肿瘤的恶性特征及化疗耐药性有关。也有报道[22-23]称,包括吉西他滨在内的基因毒性化疗药物可诱导AKT2基因的高表达,而AKT2基因的高表达可导致肿瘤细胞对放化疗不敏感。在本研究中,AKT2突变患者的生存时间和根治性切除及术后化疗效果并未令人满意。CTNNB1基因编码多功能蛋白β-catenin,构成细胞间的黏附连接(Ahers连接)。β-catenin在上皮细胞之间产生并相互连接,可以与APC蛋白结合,参与Wnt信号通路的调节。Wnt通路的激活在多种肿瘤中具有重要意义。肿瘤抑制基因的APC突变或β-catenin的β磷酸化位点突变可导致β-catenin在细胞内积聚并持续激活Tcf/Lef靶基因,导致Wnt信号通路的异常激活,从而导致细胞生长失控和恶性转化[24-26]。CTNNB1突变只出现在SPN和PNET中,PDAC中未发现CTNNB1突变。本研究数据也证实了这一点,但目前尚无针对CTNNB1突变的靶向药物。
本研究共40例胰腺肿瘤患者,其中20例伴有神经侵犯,突变基因前5位分别为KRAS、TP53、AKT2、CDKN2A和SMAD4;3例伴有血管侵犯,前2位突变基因为KRAS和TP53。KRAS和TP53的突变可能导致肿瘤神经侵犯和血管侵犯,但由于样本量较少,数据还需要进一步补充。本研究结果显示,65%的患者至少有1个潜在的药物靶点,包括ATM、BRCA1、BRCA2、BRAF、CDNK2A、CDK6、CTNNB1、ERBB3、ERBB4、FGFR1、FGFR3、FGFR4、NTRK3、PTEN、PIK3CA、VEGFA、YES1和PD-L1的表达。在靶向药物的突变基因中,BRAF、BRCA1、CDK6、EGFR、ERBB3、ERBB4和FGFR3突变仅在男性患者中发现,而VEGFA突变仅在女性患者中发现。因此,可以推测VEGFA可能是女性胰腺癌患者的一个潜在的生物标志物。在现有的靶点中,仅CDKN2A的突变率>30%,大多数胰腺恶性肿瘤靶点的突变率都不高。由于突变率较低,一些胰腺恶性肿瘤靶向药物难以获得有效验证,这也是胰腺恶性肿瘤突破性治疗困难的原因之一。免疫疗法已成为抗肿瘤治疗的新热点,尤其是PD-1和PD-L1抑制剂的问世,不仅在各种实体瘤治疗中取得了丰硕的成果,在胰腺癌的治疗方面也取得了一定的进展。本研究中40例患者均无TMB-H表达,仅1例PD-L1表达40%。据报道[27],胰腺癌中TMB-H(TMB≥20muts/Mb)约为0.5%,提示目前与PD-1和PD-L1抑制剂疗效相关的预测指标表达并不高。有研究[28]显示,单药PD-1和PD-L1抑制剂对胰腺癌的治疗效果较差,培溴利珠单抗联合NAB-紫杉醇和吉西他滨治疗胰腺癌的疗效高于单纯化疗。本研究对40例患者的生存时间进行了随访,并对不同突变基因进行了比较,但差异均无统计学意义(P值均>0.05),可能需要积累更多的病例以进一步分析。
综上,本研究通过对我国华东沿海地区40例胰腺癌患者的全基因序列分析,发现所有胰腺恶性肿瘤样本均存在基因突变,且多为多点突变和多种类型突变。同时,所有患者都有不同的突变基因和突变位点。总体而言,本研究数据可能有助于为我国沿海地区胰腺癌的诊断、预后和治疗策略,包括靶向及免疫治疗提供一定的帮助,期待未来有更多的相关研究使其在胰腺癌的诊治中发挥更大的作用。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:王晶、谭斌负责课题设计,资料分析,撰写论文;赵志杰、仲灏辰参与收集数据,修改论文;曲林林负责拟定写作思路,指导撰写文章并最后定稿。

附录1见二维码
