慢性HBV感染者HBsAg血清学清除后为什么还发生肝细胞癌?
2022-03-18庄辉
庄 辉
北京大学 医学部,北京 100191
1 HBsAg清除后发生肝细胞癌(HCC)的风险
多项研究[1-8]报道,慢性HBV感染者经抗病毒治疗或自身免疫获得HBsAg清除(伴或不伴抗-HBs阳转),即功能性治愈(临床治愈)后,仍可发生HCC。由于各报道研究对象不同、随访期限不一,报告的HCC发病率差异较大。有3项系统综述荟萃分析[9-11]表明,慢性HBV感染者HBsAg血清学清除后,其HCC发病率分别为2.29%(800/34 952)、1.86%(166/8904)和1.88%(826/43 924),显著低于HBsAg未清除者。
Kuang等[10]将28项研究纳入荟萃分析,8904例HBsAg血清学清除的慢性乙型肝炎患者中位随访时间19.6~336个月,累计HCC发病率为1.86%,HBsAg未清除者为6.56%(937/14 279),后者较前者高3.5倍(P<0.001)。慢性乙型肝炎患者HBsAg血清学清除后发生HCC主要因素为肝硬化、性别、清除时年龄和清除方式:有肝硬化患者的HCC发病率(9.51%,29/503)显著高于无肝硬化患者(1.66%,28/1689)(P<0.001);男性患者的HCC发病率(2.34%,106/4531)显著高于女性患者(0.64%,15/2358)(P<0.001);HBsAg血清学清除时年龄≥50岁患者的HCC发病率(2.34%,104/4448)显著高于<50岁患者(0.63%,14/2212)(P<0.001);抗病毒治疗清除患者的HCC发病率(5.1%,11/216)显著高于自发清除患者(1.2%,12/984)(P<0.001)。
Park等[5]分析1200例HBsAg血清学清除的回顾性队列,中位随访时间为4.8(0.5~17.8)年,有肝硬化患者的累计HCC发病率(8.5%,14/165)显著高于无肝硬化患者(0.9%,9/1035)(P<0.001);抗病毒治疗清除患者的HCC累计发病率(5.1%,11/216)显著高于自发清除患者(1.4%,12/984)(P<0.001)。此外,也有报道[4,10,12-15],慢性乙型肝炎患者HBsAg血清学清除后发生HCC风险与HCC家族史、C基因型HBV感染和基本核心启动子(BCP)突变有关。
2 HBsAg清除后为什么还发生HCC?
HBV致HCC的机制是:(1)直接致HCC,主要是通过HBV X蛋白(HBx)、表面抗原大蛋白(LHB)、表面抗原中蛋白(MHB)和HBV DNA整合引起;(2)间接致HCC,主要是宿主与HBV长期相互作用过程中产生对HBV免疫介导的细胞溶解,最终导致肝纤维化和肝硬化而间接致HCC(图1)[16]。本文仅讨论HBV DNA整合致HCC的机制。
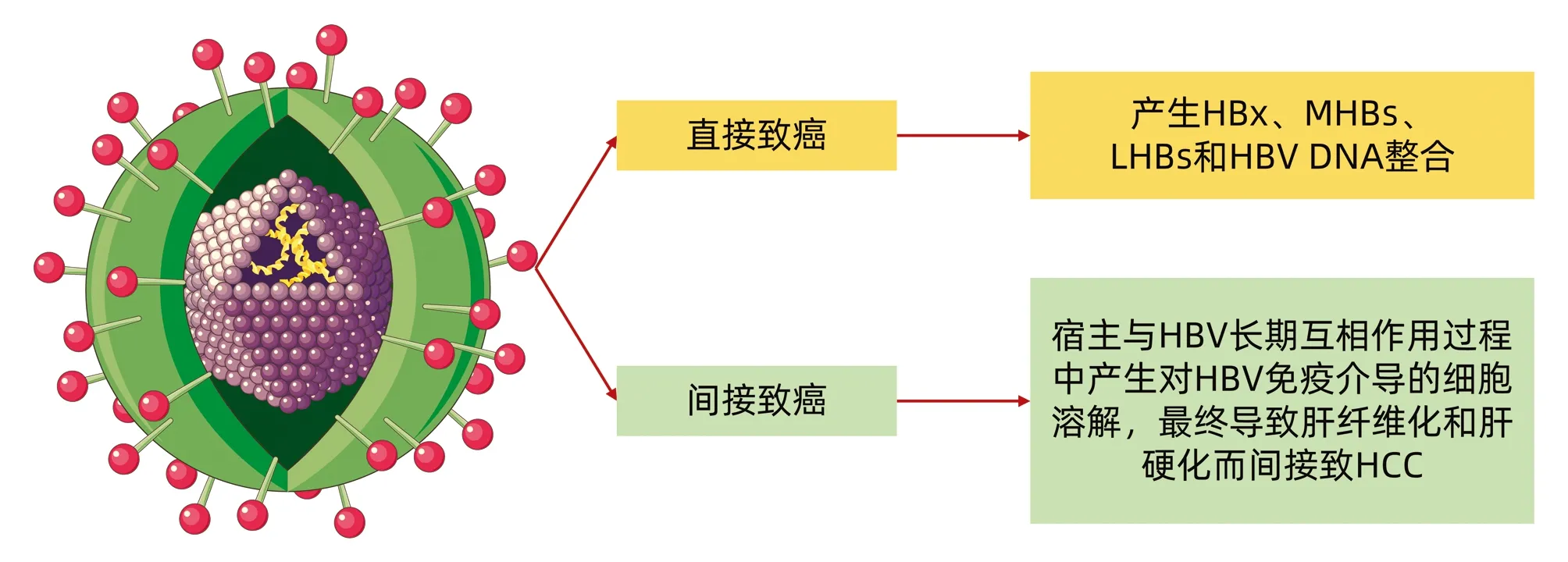
图1 HBV致HCC机制
有研究[17-18]报道,80%~90%以上的HBV相关HCC有HBV基因整合,HCC细胞含有单个和多个分散的HBV基因整合入人类基因组,从而导致不同的基因改变,包括缺失、移位、产生融合转录子和整体基因不稳定性。这些基因改变可导致有存活优势的非癌肝细胞克隆选择,从而导致细胞增生和细胞凋亡抑制失控的肿瘤克隆的产生和不断增多,最终引起HCC[17-18]。
Jang等[16]应用基于捕捉HBV基因探针和新一代测序技术,检测取自7例于HBsAg血清学清除后发生HCC的慢性HBV携带者的10份肝组织标本(其中7份为癌组织,3份为非癌组织),分析HBV DNA整合的基因位点和模式,发现7例患者中6例(85.7%)、10份标本中8份(80%)有HBV DNA整合;全部3份非癌组织(100%) 、7份癌组织中5份(71.4%) 检测到HBV DNA整合断点,非癌和癌组织平均整合断点数分别为4.00和2.43。虽然癌组织的HBV DNA整合断点总数少于非癌组织,但癌组织的HBV DNA整合位点多在基因区内,而在非癌区HBV DNA整合位点多分布于基因间区。按照受侵犯基因的功能分析,含HBV DNA整合的基因极大多数与癌症发生有关(图2)。该研究[16]发现,HBV DNA整合不是随机的,主要整合于癌相关基因,如CCDC91、GRM7、TRPC1、ST18、LING02、C5orf42、EIF4EBP1、TERT等。癌组织中HBV整合的特点为:(1)基因区整合多;(2)癌相关基因整合多;(3)HBV整合断点多为PreS/S和启动子区(图2)。
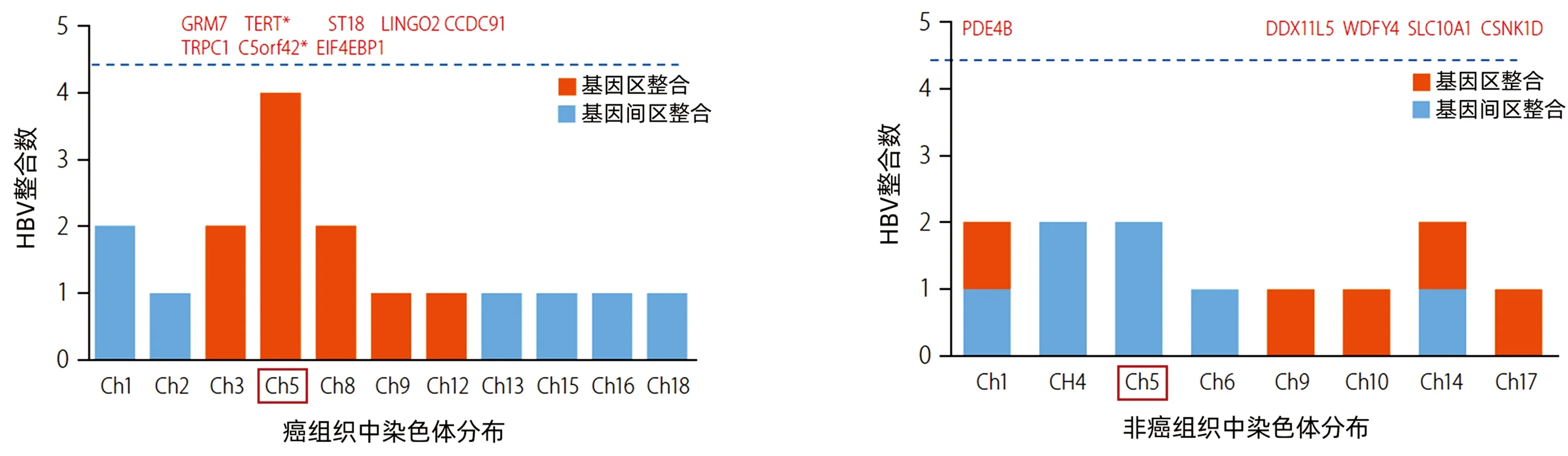
图2 在癌和非癌组织中HBV整合位点分布(根据参考文献[16]绘制)
3 HBsAg清除后发生HCC的启示
Mason等[19]报告,在慢性HBV感染免疫耐受期、HBeAg阳性和阴性免疫活动期患者中,HBV DNA整合肝细胞染色体较为常见,每例慢性乙型肝炎患者的5×1011肝细胞中,约有5×106肝细胞有HBV DNA整合。免疫耐受期、HBeAg阳性和阴性免疫活动期患者均有肝细胞克隆扩增(图3)。
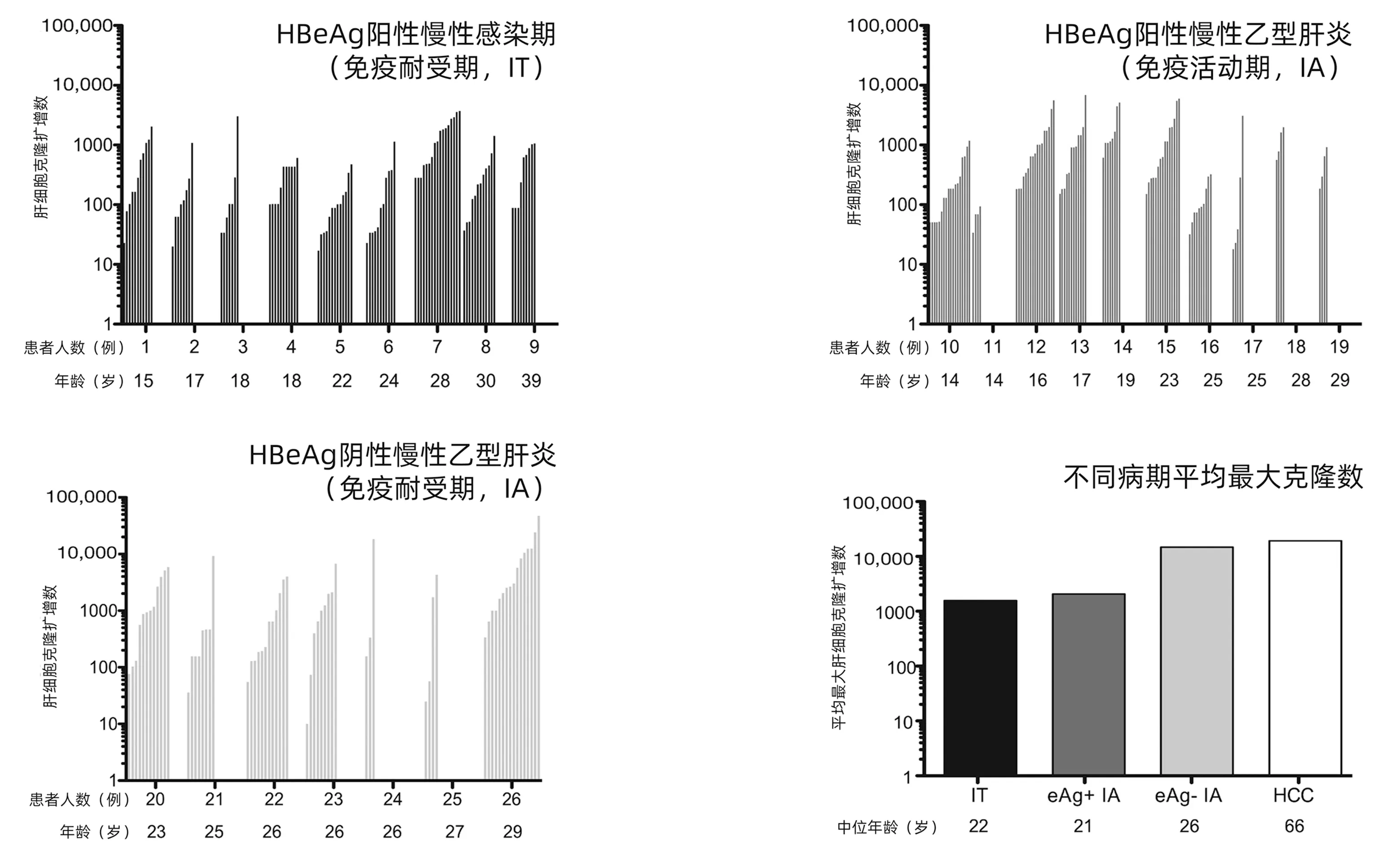
图3 慢性HBV感染不同病期肝细胞克隆扩增数比较(根据参考文献[19]绘制)
Yang等[20]使用鸭乙型肝炎病毒(DHBV)感染雏鸭,在感染后第6天即可检测到每1000~10 000肝细胞至少有1个DHBV DNA整合,提示在感染早期即有DHBV DNA整合。Wooddell等[21]报告,HBV DNA整合随感染HBV时间延长而增多,HBeAg阳性黑猩猩的肝细胞内虽有HBV DNA整合,但以HBV cccDNA占优势,HBeAg阴性黑猩猩的肝细胞内则以整合的HBV DNA占优势(图4)。
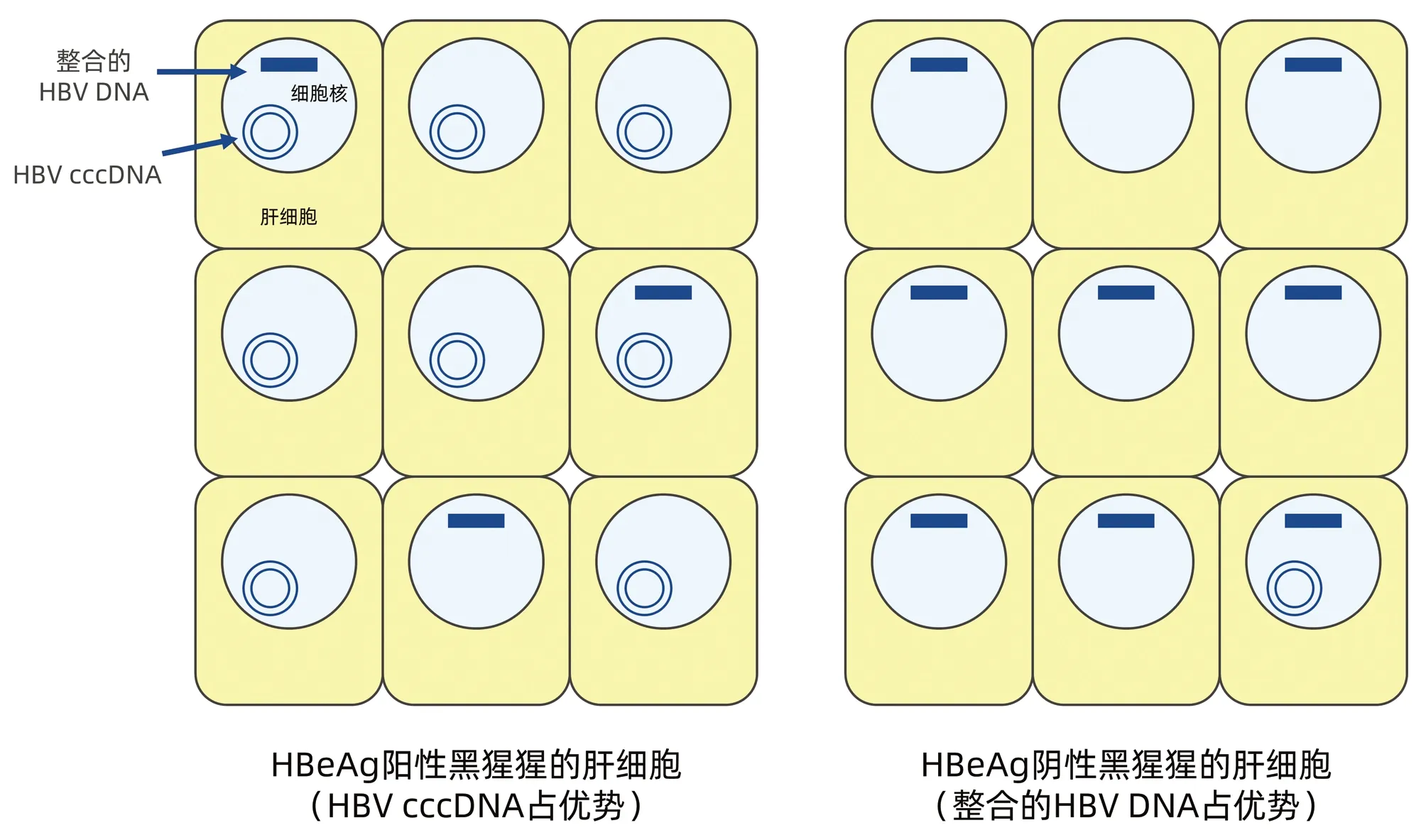
图4 HBeAg阳性和阴性黑猩猩的肝细胞内HBV cccDNA与整合的HBV DNA分布 (根据参考文献[21]绘制)
上述研究提示:(1)早治疗可减少HBV DNA整合宿主基因组的风险,从而预防或减少HCC的发生;(2)对HBsAg血清学清除的慢性HBV感染者,仍应进行HCC监测。
4 小结
(1)慢性HBV感染者于HBsAg血清学清除后,发生HCC风险明显降低,但仍可发生HCC;清除时有肝硬化、男性、年龄≥50岁患者发生HCC的风险显著升高;经抗病毒治疗获得HBsAg血清学清除的患者,其HCC发病率显著高于自发清除患者。(2)HBV具有直接(如HBx、MHB、LHB和HBV DNA整合)和间接(炎症坏死致肝纤维化,进而发展为肝硬化)致癌作用。(3)对慢性乙型肝炎患者早治疗可减少HBV DNA整合,从而降低HCC发病率。(4)慢性HBV感染者于HBsAg血清学清除后,仍应定期进行HCC监测。
利益冲突声明:作者声明不存在利益冲突。
