[1,2,5]噁二唑[3,4-b]吡嗪-5,6-(1H,3H)-二酮及其含能盐的合成及性能
2022-03-17肖悠悠雷才金杨红伟程广斌
肖悠悠,雷才金,杨红伟,程广斌
(南京理工大学化学与化工学院,江苏 南京 210094)
1 引言
在民用和军事的各个领域,含能材料发挥着越来越大的作用,在几十年的发展中,各种不同形式的含能材料如推进剂,火炸药,烟火药等层出不穷。而能同时具备高能量和低敏感性两个特点的含能化合物可以更成功地投入实际应用中,因此,追求这两者之间的平衡是目前含能材料领域急需攻克的难题[1-4]。含能离子盐由阴离子和阳离子两部分组成,通过对两部分结构的修饰,可以达到更高的爆轰性能、更好的热稳定性和更低的感度,同时也能增加含能离子盐的种类,促进含能离子盐的发展[2-5]。
氮杂环结构因其高密度、高生成焓、较好的热稳定性以及低敏感性在含能材料领域备受关注,其能量主要来源于巨大的环张力和高能C─N 键和N─N 键的断裂[6-9]。1,2,5-噁二唑(呋咱)的所有原子处于同一平面,平面性良好,具有较高的密度和生成焓,以其为母体进行扩展的含能化合物近年来得到了广泛的关注。其中呋咱并吡嗪类化合物是近年来发展的一类新型的呋咱化合物,有望应用于推进剂和高能低感炸药。2014 年,刘宁等[10]以3,4-二氨基呋咱为原料,经缩合、氯化、肟化、成环合成了4H,8H-双呋咱并[3,4-b:3′,4′-e]吡嗪(DEP)。2014 年,J. M. Shreeve 课题组[11]以乙二醛和盐酸羟胺为原料合成3,4-二氨基呋咱,3,4-二氨基呋咱经氧化偶联作用合成3,3′-二氨基-4,4′-氧化偶氮呋咱,再经硝化后得到3,3′-二硝胺基-4,4′-氧化偶氮呋咱,利用该化合物和有机碱反应合成了一系列爆轰性能优于HMX,且比HMX 钝感的含能盐。
鉴于含能材料中呋咱骨架的能量以及稳定性,本研究以3,4-二氨基呋咱为原料,经酰胺缩合反应合成含有呋咱骨架的化合物[1,2,5]噁二唑[3,4-b]吡嗪-5,6-(1H,3H)-二酮(1),再与碱反应生成一系列含能离子盐2~5,并通过溶剂挥发法得到了[1,2,5]噁二唑[3,4-b]吡嗪-5,6-(1H,3H)-二酮及其钠盐的单晶,并表征其结构及性能。
2 实验部分
2.1 试剂与仪器
试剂:3,4-二氨基呋咱为分析纯,上海毕得医药有限公司;浓盐酸、85%水合肼、氨水、50%羟胺水溶液均为分析纯,国药集团化学试剂有限公司;氢氧化钠、草酸均为分析纯,上海麦克林生化科技有限公司
仪器:Bruker APEXIICCD X 射线单晶衍射仪;瑞士Mettler Toledo 公司差示扫描量热-热重联用仪(TG/DSC3+);瑞士Bruker 公司500MHZ 核磁共振仪;FSKM 10 BAM 摩擦感度仪;BFH 12 BAM 撞击感度仪。
2.2 实验过程
以3,4-二氨基呋咱和草酸为原料经酰胺缩合反应一步法直接合成了[1,2,5]噁二唑[3,4-b]吡嗪-5,6-(1H,3H)-二酮(1),并进一步与碱反应合成了该化合物的离子盐2~5。合成路线见scheme 1。
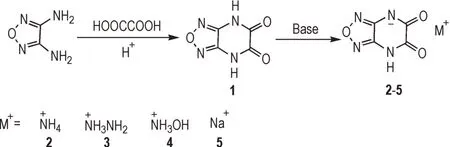
Scheme 1 Synthetic route of compounds 1-5
2.2.2 合成过程
2.2.2.1 [1,2,5]噁二唑[3,4-b]吡嗪-5,6-(1H,3H)-二酮(1)的合成
向50 mL 三口烧瓶中加入15.0 mL 10%的HCl水溶液,搅拌加入10.00 g(100 mmol)二氨基呋咱和13.86 g(110 mmol)二水合草酸,在100 ℃回流三小时[12]。反应结束后冷却,过滤,干燥得白色固体12.60 g,产率81.8%。1H NMR(500 MHz,DMSO-d6,δ):12.85;13C NMR(125 MHz,DMSO-d6,δ):154.32,144.65;IR(KBr,ν/cm-1):3514,3082,2902,2750,1688,1651,1592,1520,1392,1362,1334,1015,912,881,837,826,799,749,731,678,579,568,561。
2.2.2.2 胺盐(2)的合成
将0.31 g(2 mmol)化 合 物1 加 入20.0 mL 甲 醇中,加入0.5 mL(4 mmol)氨水,室温下搅拌反应5 h,经过滤,甲醇洗,干燥得白色固体0.27 g,产率78.9%。1H NMR(500 MHz,DMSO-d6,δ):8.02;13C NMR(125 MHz,DMSO-d6,δ):159.23,149.35;IR(KBr,ν/cm-1):3517,3082,2750,1688,1657,1592,1520,1392,1362,1334,1249,1015,837,826,799,749,731,678,602,590,568。
2.2.2.3 肼盐(3)的合成
合成路径与化合物2 的合成路径类似,化合物1与水合肼的摩尔比为1∶2。得到白色固体0.29 g,产率77.9%。1H NMR(500 MHz,DMSO-d6,δ):7.07,3.16;13C NMR(125 MHz,DMSO-d6,δ):159.31,149.15;IR(KBr,ν/cm-1):3517,3082,2902,2750,1688,1657,1592,1520,1392,1362,1249,1015,913,837,799,749,678,602,579,568。
2.2.2.4 羟胺盐(4)的合成
合成路径与化合物2 的合成路径类似,化合物1与氢氧化钠的摩尔比为1∶2。得到白色固体0.32 g,产率85.5%。1H NMR(500 MHz,DMSO-d6,δ):4.16;13C NMR(125 MHz,DMSO-d6,δ):156.67,146.99;IR(KBr,ν/cm-1):3517,3082,2750,1688,1657,1592,1520,1392,1362,1334,1249,1015,837,826,799,749,678,590,568,561。
2.2.2.5 钠盐(5)的合成
合成路径与化合物2 的合成路径类似,化合物1与水合肼的摩尔比为1∶2。得到白色固体0.25 g,产率71.0%。13C NMR(500 MHz,DMSO-d6,δ):162.42,151.58;IR(KBr,ν/cm-1):3517,3082,2750,1688,1657,1592,1520,1392,1362,1334,1249,1015,837,826,799,749,731,678,602,590;579,561。
3 结果与讨论
3.1 晶体培养与结构分析
将[1,2,5]噁二唑[3,4-b]吡嗪-5,6-(1H,3H)-二酮(1)及其离子盐2~4 分别溶于甲醇溶液中,室温下缓慢挥发,两天后得到化合物1与化合物5的白色单晶。
选取合适尺寸的[1,2,5]噁二唑[3,4-b]吡嗪-5,6-(1H,3H)-二酮(1)及其钠盐(5)的单晶置于X-射线单晶衍射仪上,采用经石墨单色器单色化的MoKα 射线(λ=0.71073 Å)作为X 射线源,以ω扫描方式在一定的θ范围收集单晶衍射数据。各化合物的结构通过SHELX-97 程序用直接法解得,对所有非氢原子进行各向异性修正,同时运用全矩阵最小二乘法进行修正,具体参数见表1。化合物1 和化合物5 的晶体结构与晶胞堆积如图1 和图2 所示,部分键长键角数据列与表2和表3。
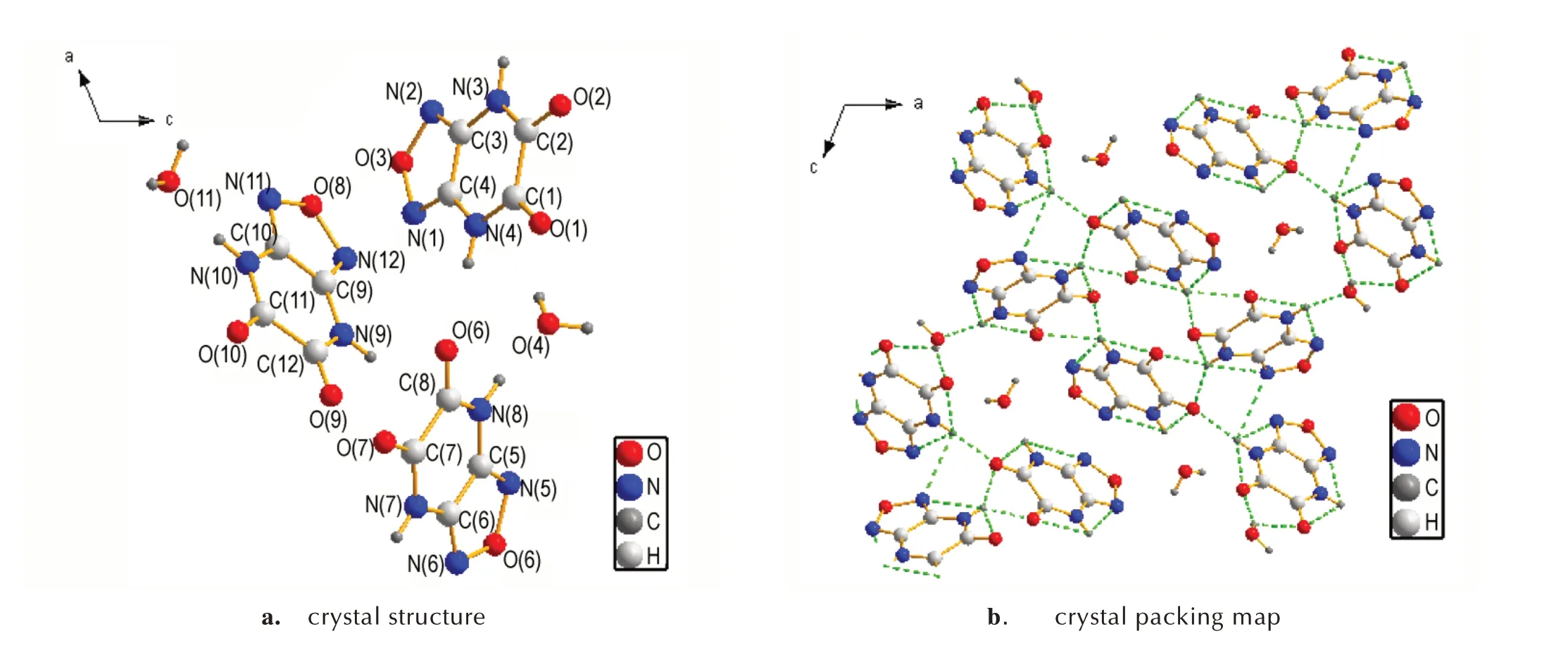
图1 化合物1 的晶体结构和晶胞堆积(虚线表示分子间氢键作用力)Fig.1 Crystal structure and packing map of compond 1(Dashed lines indicate intermolecular hydrogen-bond interaction)
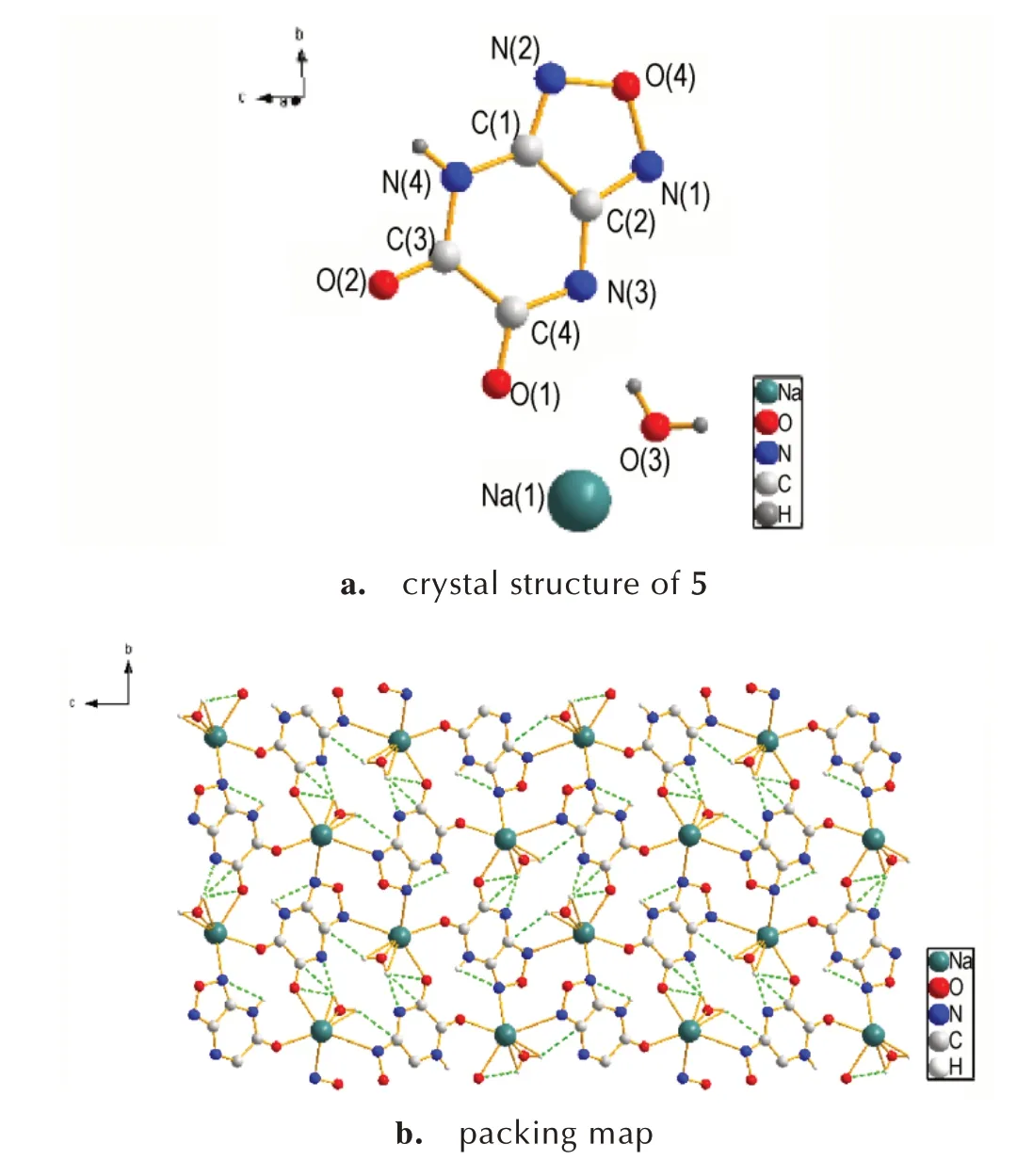
图2 化合物5 的晶胞堆积(虚线表示分子间氢键作用力)Fig.2 Crystal structure and packing map of compound 5(Dashed lines indicate intermolecular hydrogen-bond interaction)

表1 化合物1 和5 的晶体学数据Table 1 Crystallographic data for compounds 1 and 5
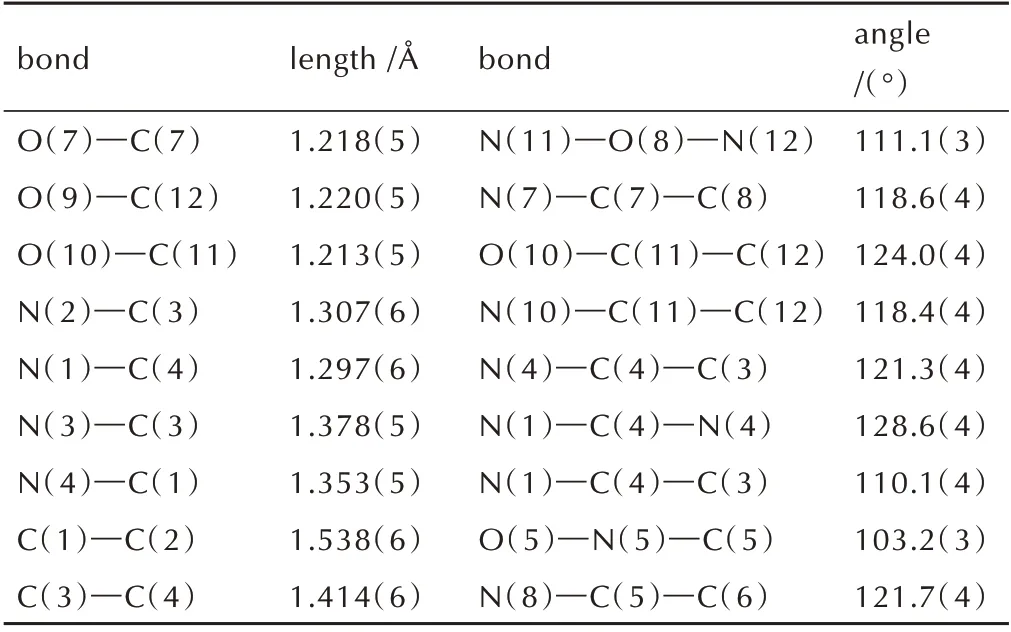
表2 化合物1 的部分键长和键角Table 2 Selected bond lengths and angles of compound 1
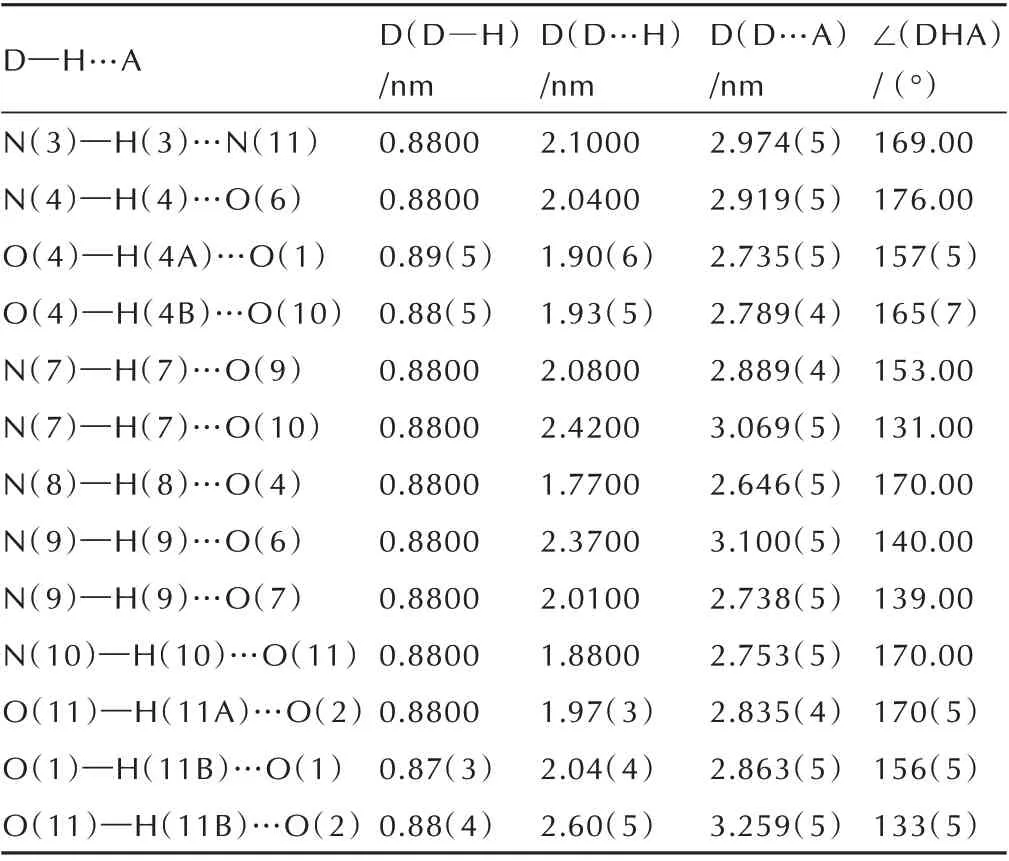
表3 化合物1 的氢键的键长和键角Table 3 Hydrogen bond distances(nm)and bond angles for compound 1
由图1和表2可见化合物1中N(2)─C(3)、N(1)─C(4)、N(3)─C(3)、N(4)─C(1)的键长分别为1.307(6)、1.297(6)、1.378(5)、1.353(5)Å,介于正常C=N 双键(键长为1.27 Å)和C─N 单键(键长为1.47 Å)之间;C(1)─C(2)、C(3)─C(4)的键长分别为1.538(6)、1.414(6),也介于正常的C─C 单键(键长为1.54 Å)和C=C 双键(键长为1.34 Å)之间,这说明呋咱环和吡嗪环之间形成共轭离域结构。化合物1中的扭转角N(2)─O(3)─N(1)─C(4)、O(3)─N(1)─C(4)─C(3)均为0°,C(3)─N(3)─C(2)─O(2)和C(1)─N(4)─C(4)─C(3)分别为178.9°和-1.3°,说明化合物1 分子中呋咱环和吡嗪环几乎处于同一平面。由晶胞堆积图1b 和表3 可知,化合物1 中存在大量的氢键结构,能有效提高分子的结构稳定性并降低其感度。
由图2a 和表4 可知,化合物5 中的C—N 键均介于正常C=N 双键(键长为1.27 Å)和C—N 单键(键长为1.47 Å)之间;C—C 键也介于正常的C—C 单键(键长为1.54 Å)和C=C 双键(键长为1.34 Å)之间,与化合物1 一样具有共轭离域结构,提高了分子的稳定性。5中C(1)—N(4)—C(3)—O(2)、N(4)—C(1)—C(2)—N(1)的扭转角分别为179.90°和-179.66°,说明其阴离子几乎为平面结构,具有较高的稳定性。由图2b 晶胞堆积图和表5 可知,化合物5 中存在着大量的氢键作用,这使得5 的晶体呈层状排布,丰富的氢键网络结构以及层与层的堆积方式有助于提高晶体的热稳定性并降低化合物的感度。
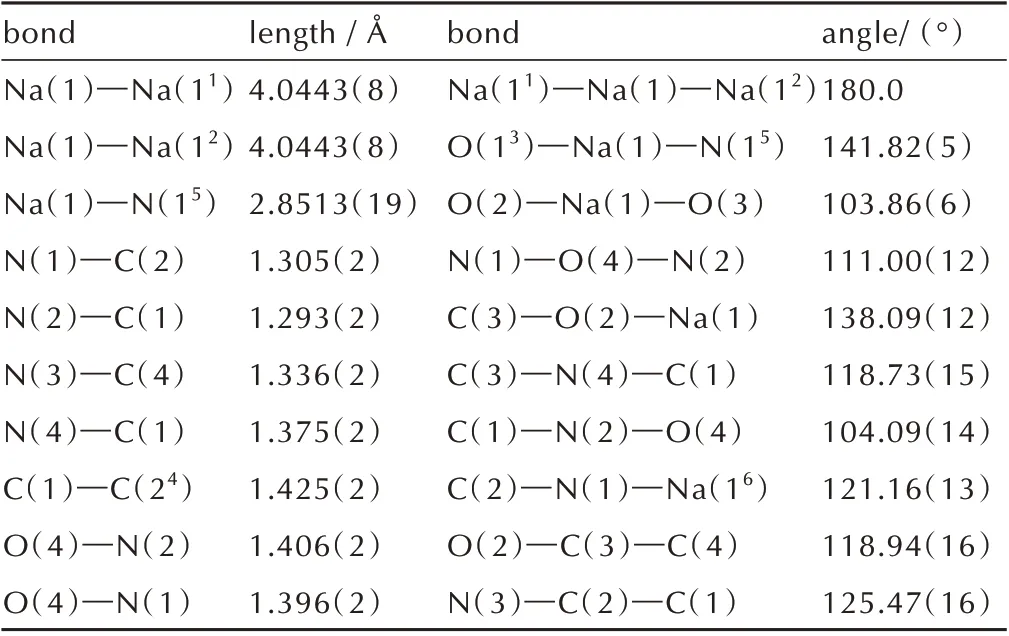
表4 化合物5 的部分键长和键角Table 4 Selected bond lengths and angles of compound 5
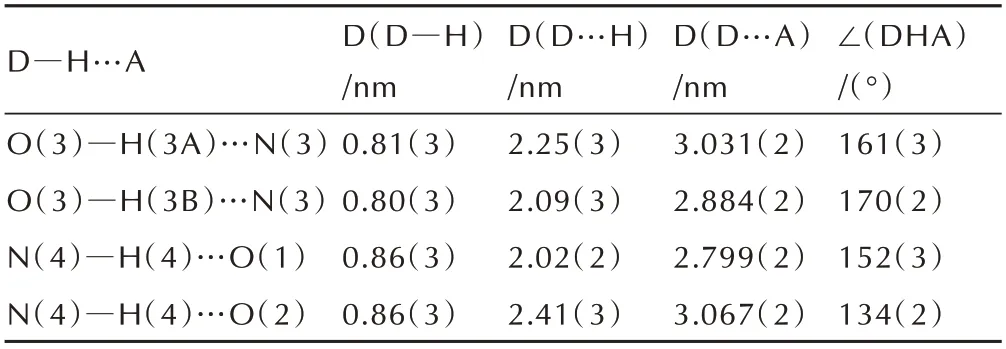
表5 化合物5 的氢键的键长和键角Table 5 Hydrogen bond distances(nm)and bond angles for compound 5
3.2 热力学分析
采用差示扫描量热法(DSC)对合成的[1,2,5]噁二唑[3,4-b]吡嗪-5,6-(1H,3H)-二酮及一系列离子盐的热行为进行了研究,采用的实验条件为:N2氛围中,测试温度范围30~400 ℃,升温速率为5 ℃·min-1。如图3 所示,[1,2,5]噁二唑[3,4-b]吡嗪-5,6-(1H,3H)-二酮的起始分解温度为289 ℃,而含能盐2~5 分别在302,218,293,317 ℃开始分解。分解温度均高于200 ℃,热稳定性优良。其中化合物5 的热分解温度最高,为317 ℃。除化合物3 之外,其他离子盐的分解温度均高于化合物1,说明生成含能离子盐后热稳定性得到了一定程度的提升。
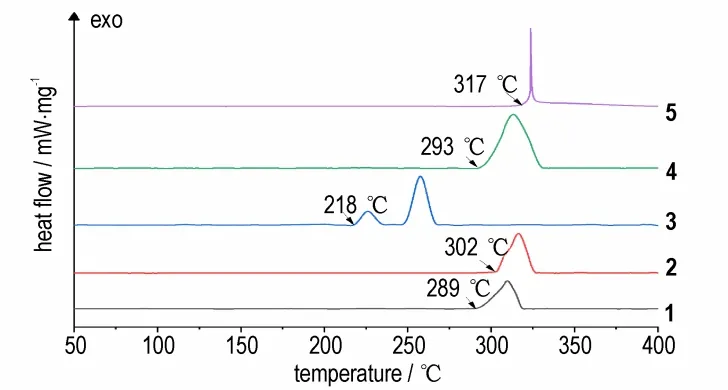
图3 5 ℃·min-1时化合物1~5 的DSC 曲线Fig.3 DSC curves of compounds 1-5(5 ℃·min-1)
3.3 能量与感度性质
运用Gaussian09 程序[13],对化合物1-5 的标准摩尔生成焓进行计算,进一步采用EXPLO5(v. 6.01)程序[14]对其爆轰性能进行了预测,结果见表6。在25 ℃的室温条件下,利用BAM 撞击感度仪和BAM 摩擦感度测试仪,对1~5 的撞击感度及摩擦感度进行测试,结果见表6。同时将TNT 和RDX 的相关性能列于表6 中以供比较[15]。
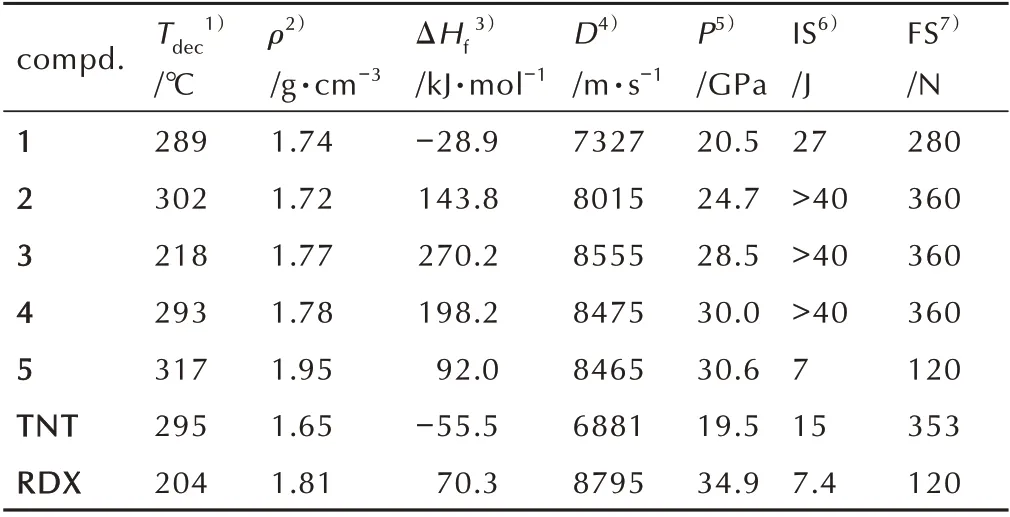
表6 TNT、RDX 和目标化合物的物化参数及爆轰性能Table 6 Physiochemical properties and detonation properties of TNT,RDX and compounds 1-5
由表6 中可以看出,所有目标化合物的密度以及计算爆速和爆压均高于TNT,其中化合物3 的爆速最高,为8555 m·s-1,与RDX相当;化合物5的爆压最高,为30.0 GPa。与中性化合物1 相比,其对应的离子盐2~4的爆轰性能均得到了一定幅度的提升。除化合物5的机械感度性质与RDX 相当,化合物2~4的撞击感度均高于40 J,摩擦感度均为360 N,机械感度低于TNT。
4 结论
(1)以3,4-二氨基呋咱和草酸为原料经缩合反应合成了[1,2,5]噁二唑[3,4-b]吡嗪-5,6-(1H,3H)-二酮(1),并通过成盐反应合成了4种含能离子盐。通过溶剂挥发法得到了[1,2,5]噁二唑[3,4-b]吡嗪-5,6-(1H,3H)-二酮(1)及其钠盐(5)的单晶,化合物1为单斜晶系,P21/c 空间群,晶体密度为1.739 g·cm-3;化合物5为单斜晶系,P21/c空间群,晶体密度为1.955 g·cm-3。
(2)化合物1的初始分解温度为289 ℃,离子盐2~5的分解温度在218~317 ℃之间。成盐后的2,4,5 的热分解温度均高于中性化合物1,热稳定性得到了提升。
(3)化合物1 的计算爆速为7327 m·s-1,爆压为20.5 GPa,其胺盐、肼盐、羟胺盐、钠盐的计算爆速在8015~8555 m·s-1之间,计算爆压在24.7~30.6 GPa 之间,均优于TNT。其中羟胺盐4 的爆速为8555 m·s-1,与RDX 相当,钠盐5 的爆压为30.6 GPa,是爆轰性能优良且具有应用潜力的新型含能材料。
