抑制YAP对宫颈癌细胞增殖、凋亡、迁移及p53、Fra-1表达的影响
2022-03-17李书萍
李书萍,李 波,张 阳
(长沙市第四医院 妇产科,湖南 长沙 410006)
宫颈癌为女性生殖系统高发疾病,死亡率占女性肿瘤第二位。流行病调查显示,截止到2018年全球宫颈癌发病率为0.13%,死亡率较高,约80%发病人群来自经济落后国家[1]。宫颈癌发生发展是多种因素共同导致,主要与感染高危型人头瘤病毒(HPV)加快肿瘤细胞增殖加快病情发展有关[2]。p53是肿瘤抑制因子,恶性肿瘤产生与p53基因突变相关,p53修复功能被削弱时会转化为致癌基因加快肿瘤细胞活性恶化病情。外源性增加野生型p53可促进对宫颈癌细胞凋亡,合并放疗等治疗方式可降低肿瘤的生物活性[3]。Fra-1是位于机体染色体11q 3.1上的转录因子,Fra-1定位于细胞核具有调节细胞活性的作用。在胰腺癌及肺癌中发现Fra-1过表达状态,在宫颈癌组织表达低于癌旁组织[4]。
YAP即Yes相关性蛋白,具有调节器官发育及加快肿瘤形成等作用。YAP蛋白在多种恶性肿瘤表达上调,是评价肿瘤独立预后的指标之一。近些年,科学家们发现HIppo-YAP对肿瘤的发生发展具有重要作用。正常情况下YAP蛋白受严格控制的,YAP激活后即可造成非控制性增殖和凋亡抑制,进而导致恶性肿瘤产生。YAP是一个候选致癌因子,在宫颈癌患者存在HPV感染,肿瘤细胞快速增殖时YAP和磷酸化的YAP蛋白显著升高,当将YAP基因被敲除后,肿瘤细胞增殖被抑制,说明YAP可能是宫颈癌细胞HPV感染的重要介质[5],但是具体研究机制还不得而知。本文通过外源性干预YAP蛋白观察其对细胞生物活性及p53、Fra-1表达的影响。
1 材料与方法
1.1 细胞来源、主要试剂与仪器 宫颈癌Hela/SiHa细胞株均购自上海信裕,本文研究符合我院伦理规定。主要试剂与仪器YAP-shRNA 及空载体质粒(中国上海吉玛公司);p53抗体(中国深圳豪地华拓生物科技);FRA1抗体(中国上海士峰生物);DMEM培养、FBS、0.25%胰酶消化液(中国中盛溯源生物);CCK8试剂、二甲基亚砜(DMSO)(上海蔚霆生物);流式细胞仪(中国常州必达科生物科技);Transwell 小室(中国北京优尼康生物);蛋白垂直电泳系统(中国北京君意东方);倒置生物显微镜(中国苏州景通仪器);RT-PCR试剂(Promega公司)。
1.2 方法
1.2.1 细胞培养 将低温冷藏的Hela细胞株、SiHa细胞株,快速移入37℃水中溶解,离心后,离弃上清液,加入培养基,5% CO2常温保存,贴壁生长,次日更换培养基,细胞生长85%时,0.25%胰蛋白酶消化24 h,1∶3传代,取对数细胞1.0× 106/mL进行后续实验。
1.2.2 细胞转染及分组 取对数生长Hela细胞株、SiHa细胞株,接种6孔板中,细胞培养至80%~90%,把体积为4 μL脂质体和体积为200 μL缓冲液依次加入到无菌的EP管中,采用Lipofectamine2000将YAP-shRNA,YAP-shRNA-NC转染至Hela细胞,将细胞悬液加入6孔板,转染5 h后,继续培养,Hela细胞株、SiHa细胞株均分为3组,宫颈癌组(无转染的宫颈癌细胞),NC组(宫颈癌组+YAP-shRNA-NC)及YAP-shRNA组(宫颈癌组+YAP-shRNA)。
1.2.3 RT-PCR检测3组细胞YAP、p53及FRA1基因水平 检测Hela细胞株、SiHa细胞株YAP表达,检测Hela细胞株p53及FRA1基因,严格按照PCR仪器说明书进行操作。各组宫颈癌细胞放入离心管中,1 000 r/min分离20 min,采用Trizol法提取总RNA,无核酸酶溶解。将提取的RNA进行转录为cDNA,获得反体系,条件为:42 ℃作用60 min,72 ℃作用5 min,4 ℃终点。每个细胞设置6个复孔,以β-actin为内参,反应条件为95 ℃预作用3 min,95 ℃作用5 s,58 ℃退火,40个循环。引物序列见表1。

表1 引物序列
1.2.4 CCK8检测Hela细胞活力 取生长良好的对数生长细胞1.0× 106/mL的Hela细胞,进行Hela细胞活力实验,加入0.25%胰蛋白酶消化后,将Hela细胞制成悬浮液,放入离心管中,按照1 000 r/min分离5 min后,计算细胞数。按照每孔800个细胞,接种6孔板,饱和湿度常规培养,培养1、2、3 d后,加入20 μL,10%的CCK-8溶液,450 nm下计算每孔吸光值,绘制细胞生长曲线。
1.2.5 流式细胞仪检测Hela凋亡率 取生长良好的对数生长细胞1.0× 106/mL的Hela细胞接种到6孔板中,常规饱和湿度下进行培养,加入0.25%消化酶,离心机2 000 r/min运转10 min,加入1 mL PI染色进行染色,40~60 min后,采用流式细胞仪检测Hela凋亡程度。
1.2.6 Transwell小室法检测Hela细胞迁移能力 在培养室中防放置Transwell小室,上层加入Hela细胞悬液,下层加入少量胎牛血清培养基,将100 μg/mL TMP溶液加入至下室,37.5 ℃,培养24 h后,取出小室,棉签拭去残留Hela细胞,纯净水冲洗3次,甲醛固定15 min,显微镜×400倍下计算Hela细胞迁移数量,随机选择4个视野,取实验3次的平均值。
1.2.7 免疫印迹检测p53、Fra-1蛋白水平 细胞浓度及接种数量同上,加入0.25%消化液,放入离心管中分离上清液,提取蛋白,然后煮沸、变性,进行电泳,PVDF膜TBS浸泡10 min,反复PBS冲洗,5 min/次,分别加入p53、Fra-1,GAPDH抗体(1∶500)、二抗(1∶2 000),杂交60 min后,纯净水反复冲洗3次,将膜浸入ECL液体中,检测获取图象。

2 结果
2.1 RT-PC检测Hela、SiHa细胞株中YAP基因水平 NC组与宫颈癌组Hela细胞株中YAP基因水平比较无统计学意义(P>0.05),YAP-shRNA组中Hela细胞株中YAP基因水平均低于NC组与宫颈癌组,组间比较差异有统计学意义(P<0.05,见表2)。
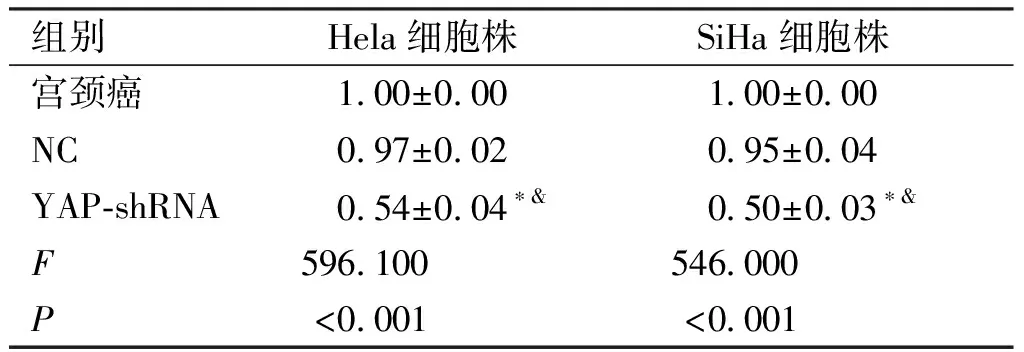
表2 Hela、SiHa细胞株中YAP基因水平比较(n=6)
2.2 Hela细胞增殖能力比较 宫颈癌组和NC组Hela细胞吸光度(A)值在24、48、72 h比较均无统计学差异(P>0.05),YAP-shRNA组Hela细胞吸光度(A)值均低于宫颈癌组和NC组,组间比较差异有统计学意义(P<0.05),并呈现时间依赖性(见表3)。
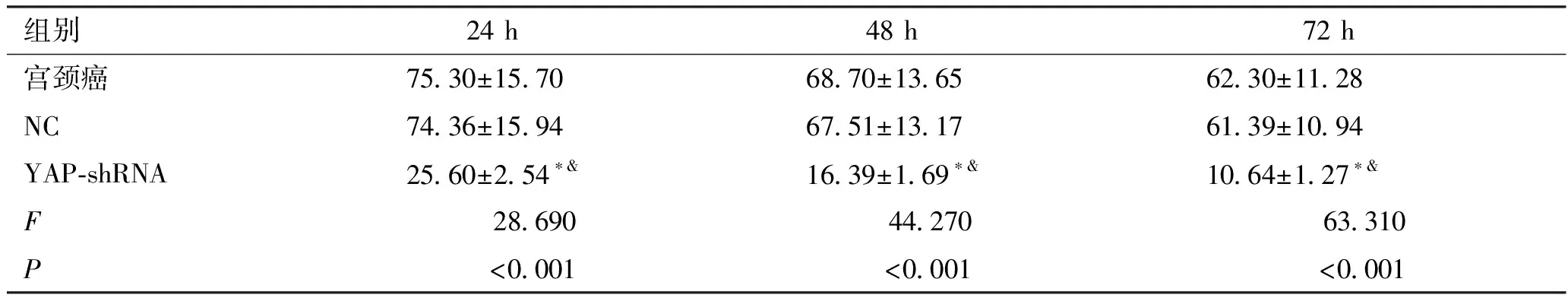
表3 各组Hela细胞增殖能力比较(n=6)
2.3 各组Hela细胞凋亡率比较 宫颈癌组、NC组和YAP-shRNA组Hela细胞凋亡率分别为(6.21±0.50、7.14±1.18、65.45±1.30)%,组间比较差异具有统计学意义(F=6221.000,P<0.001)。宫颈癌组和NC组Hela细胞凋亡率组间比较无统计学意义(P>0.05),YAP-shRNA组Hela细胞凋亡率高于宫颈癌组(P<0.001)和NC组(P<0.001)(见图1)。

*:与宫颈癌组比较,P<0.05;&:与NC组比较,P<0.05。图1 各组Hela细胞凋亡率比较
2.4 Hela细胞迁移数目比较 宫颈癌组、NC组和YAP-shRNA组Hela细胞迁移数目分别为(85.1±12.03、83.9±13.5、41.39±7.50)个,组间比较差异具有统计学意义(F=6.645,P<0.001)。宫颈癌组和NC组Hela细胞迁移数目组间比较无统计学意义(P>0.05),YAP-shRNA组Hela细胞迁移数目低于宫颈癌组(P<0.001)和NC组(P<0.001)(见图2)。
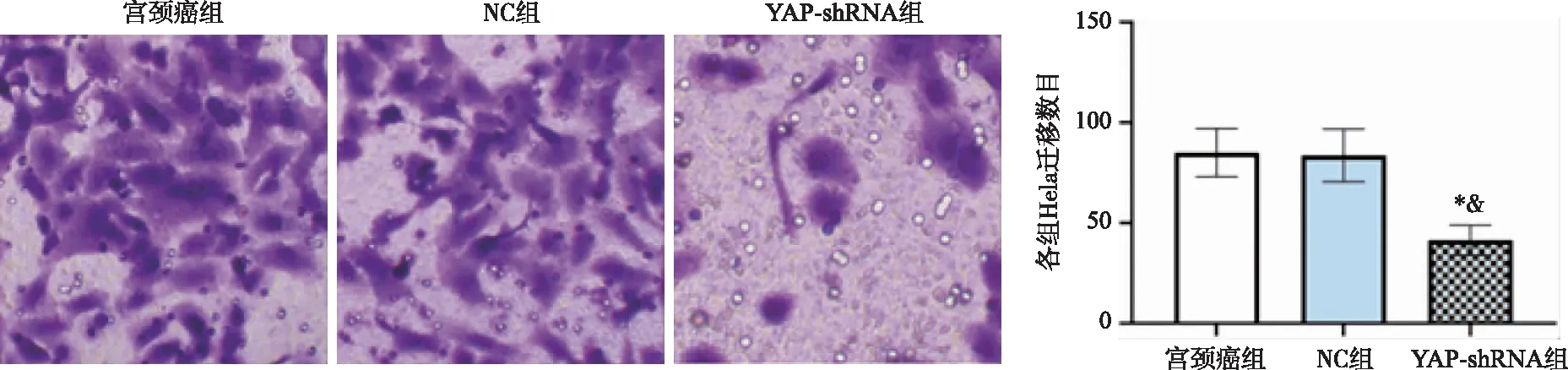
*:与宫颈癌组比较,P<0.05;&:与NC组比较,P<0.05。图2 各组Hela细胞迁移数目比较
2.5 Hela细胞p53、Fra-1蛋白水平比较 宫颈癌组、NC组和YAP-shRNA组Hela细胞p53蛋白表达水平分别为(1.03±0.17、0.98±0.16、2.23±0.26),Fra-1蛋白表达水平分别(0.74±0.08、0.72±0.06、1.12±0.15),组间比较差异具有统计学意义(Fp53蛋白=99.610,P<0.001;FFra-1蛋白=338.300,P<0.001)。宫颈癌组和NC组Hela细胞p53、Fra-1蛋白水平组间比较无统计学意义(P>0.05),YAP-shRNA组Hela细胞p53蛋白水平高于宫颈癌组(P<0.001)和NC组(P<0.001),YAP-shRNA组Hela细胞Fra-1蛋白水平高于宫颈癌组(P<0.001)和NC组(P<0.001)(见图3)。
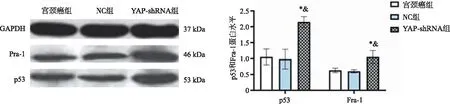
*:与宫颈癌组比较,P<0.05;&:与NC组比较,P<0.05。图3 各组Hela细胞p53、Fra-1蛋白水平比较
2.6 Hela细胞p53、Fra-1 mRNA水平比较 宫颈癌组、NC组和YAP-shRNA组Hela细胞p53mRNA表达水平分别为(1.00±0.00、0.97±0.05、1.68±0.21),Fra-1mRNA表达水平分别(1.00±0.00、0.95±0.08、1.37±0.18),组间比较差异具有统计学意义(Fp53 mRNA=337.600,P<0.001;FFra-1 mRNA=292.800,P<0.001)。宫颈癌组和NC组Hela细胞p53mRNA、Fra-1mRNA水平组间比较无统计学意义(P>0.05),YAP-shRNA组Hela细胞p53mRNA水平高于宫颈癌组(P<0.001)和NC组(P<0.001),YAP-shRNA组Hela细胞Fra-1mRNA水平高于宫颈癌组(P<0.001)和NC组(P<0.001)(见图4)。
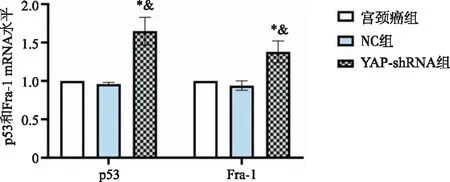
*:与宫颈癌组比较,P<0.05;&:与NC组比较,P<0.05。图4 各组Hela细胞p53、Fra-1 mRNA水平比较
3 讨论
YAP蛋白首次在哺乳动物细胞内发现,当与TEAD信号通路相结合后能抑制细胞凋亡。Hippo-YAP作为重要的信号传到信号通路,在肿瘤疾病中发挥重要生物学作用[6-8]。已经证实YAP蛋白在胃癌、卵巢癌及肺癌中表达上调,YAP-shRNA或体外干预能够通过抑制YAP蛋白而抑制肿瘤复制,改善病情[9]。Hela细胞生物学来源与美国女性的宫颈癌细胞系相比,具有增殖、迁移快的特点,常应用与宫颈癌实验研究。细胞增殖过程中细胞分裂是主要增殖方式,细胞凋亡属于主动过程,激活基因通过维持内环境稳定,从而调控细胞活性。在肿瘤状态下,YAP蛋白失效增加本身活性参与肿瘤的产生及发展[10-11]。裴峰等[12-13]表示通过体外建立宫颈癌细胞株实验,发现当敲除YAP蛋白时宫颈癌增殖及迁移能力降低。本文证实YAP-shRNA组Hela细胞出现大量凋亡,增殖及迁移数目均降低,说明YAP-shRNA能够抑制宫颈癌发展。沉默YAP蛋白后期诱导生长因子及凋亡抑制信号能力减弱,肿瘤抑制因子呈现高表达,从而减少宫颈癌细胞恶性增殖及迁移,细胞活性显著降低。YAP是Hippo通路的转录因子,其磷酸化后与相关因子结合可促进下游因子表达,提高肿瘤细胞的生物行为,因此抑制YAP蛋白的表达可有减缓肿瘤的发展。
p53是位于染色体17号短臂上的蛋白因子,进化相对保守,p53作用多样,能够修复损伤细胞,加快细胞灭活,抑制多种亲癌信号的表达[14]。p53可通过诱导相应编码的蛋白活性调节肿瘤细胞生物活性。p53主要分布于细胞浆内,在正常机体内p53具有监测基因组完整性作用,具有修复细胞基因损伤等特点,当p53基因发生突变时,会导致细胞癌变。相关文献证实,Hela细胞株中p53蛋白激活后诱导肿瘤细胞凋亡,p53表达激活后Hela细胞增殖分裂,减少Hela细胞从G期向S期扩增,改善宫颈癌病情[15]。本文证实YAP-shRNA组p53表达升高,产生原因在于抑制YAP后P53抑制肿瘤细胞分化能力增强,P53表达升高诱导Hela细胞凋亡。在肺癌细胞中,YAP蛋白活性表达下调时可激活p53基因表达,p53参与了YAP蛋白抑制肺癌细胞凋亡的过程[16]。在肝癌细胞中YAP蛋白能够发挥蛋白执行功能,能够上调p53水平发挥肿瘤抑制作用,进而加快肝癌细胞凋亡[17]。在食管癌Eca-109细胞中干扰YAP能够显著升高p53水平、降低食管癌细胞增殖分裂[18]。
宫颈癌中Fra-1及p53表达下调,而MDM2活性增加,体外实验表示,当敲除MDM2后,HPV病毒p53活性升高[19]。Henken等[20]研究发现过表达Fra-1能够降低MDM2水平。FRA1具有促进肿瘤增殖、分化、侵袭和凋亡等生物学功能,Fra-1在许多肿瘤中异常表达并发挥相关作用,Fra-1在乳腺癌、肺癌、结直肠癌、前列腺癌、鼻咽癌、甲状腺癌和其他癌症中过度表达肿瘤,但是宫颈癌中Fra-1的表达降低[21]。在口腔鳞状细胞癌中沉默YAP蛋白能够通过下调Fra-1水平而抑肿瘤细胞分裂增殖[22]。这与本文研究结果不同,其原因在于,Fra-1在不同肿瘤疾病作用机制存在差异性。但已有文献证实[23-24],过表达Fra-1能够通过上调p53活性而减少Hela细胞的能量代谢及体外分裂,但是具体研究机制还需要进行后续实验。本文Hela细胞YAP-shRNA后,Fra-1表达升高,减少Hela生物学效应,减少肿瘤发生对于临床治疗有一定的参考价值。
本文未建立YAP蛋白过表达组,讨论中YAP与Fra-1之间的研究机制还需要进一步完善,对实验结果可能产生偏差,后期本课题组会加强和其他相关研究单位合作,增加样本量,细化实验内容,为宫颈癌临床研究提供实践依据。综上所述,YAP在宫颈癌细胞中存在高表达,沉默后能够降低宫颈癌Hela细胞株增殖及迁移能力,加快细胞凋亡率,这可能与激活P53及Fra-1基因相关。
