番鸭GDF9基因克隆、生物信息学及组织表达分析
2022-03-17石雨竹罗儒唐
石雨竹,罗儒唐,陈 超,吴 旭,李 昂
(福建农林大学动物科学学院(蜂学学院),福州 350000)
番鸭(Cairinamoschata)是一种优质的瘦肉型肉鸭品种[1],与其他家禽相比,具有易于饲养[2],耐热性好[3-4],脂肪含量较低,对环境和疾病有较强的抵抗力等优点。但其就巢性强、产蛋率低等特点严重影响了其养殖业的经济效益。因此,阐明就巢性状的分子遗传机制成为改善就巢性高、产蛋性能低的关键问题。影响产蛋性能有较多因素,卵泡发育直接影响产蛋性能。 转化生长因子-β(transforming growth factor β,TGF-β)超家族由TGF-β、抗缪勒氏管激素(anti-mullerian hormone,AMH)、激活素(activin)、骨形态发生蛋白(bone morphogenetic protein,BMP)和生长分化因子(growth differentiation factor,GDF)组成;其家族成员被认为通过旁分泌、自分泌的方式在调控卵泡的生长发育中发挥重要作用[5]。 其中,生长分化因子9(growth differentiation factor 9,GDF9)是卵母细胞分泌的一个重要生长因子,是McPherron等[6]以已知的TGF-β超家族的保守序列为模板,通过消减PCR技术首次发现的。GDF9基因位于常染色体上,基因结构比较保守,通常是由2个外显子和1个内含子组成[7]。GDF9在多个物种的卵巢上高度表达,被广泛认为在卵泡的发育过程中发挥着重要作用[8]。作为卵母细胞和颗粒细胞之间双向通讯的一个重要影响因子,通过自分泌和旁分泌的方式参与调控颗粒细胞和膜细胞的增殖分化、相关功能蛋白和因子产生、生殖系统相关基因表达以及卵巢细胞的代谢、凋亡等生物学过程,从而在卵巢卵泡的生长以及卵母细胞成熟、排卵和黄体化等方面发挥关键作用[9]。GDF9基因突变后,绵羊和小鼠都表现为卵母细胞在初级卵泡阶段死亡,卵泡发育停滞[10-11]。此外,GDF9基因在哺乳动物中高度保守,与BMP15基因结构相似,被归为BMP亚族成员[12]。研究发现,GDF9和BMP15以协同作用形成了GDF9/BMP15二聚体,在调控卵泡颗粒细胞增殖、分化与促进卵泡与卵丘发育中发挥着重要作用[13-14]。
此外,GDF9与动物的繁殖性能也密切相关,被作为绵羊[15]和山羊[10]高繁殖力的候选基因。位于GDF9基因上的多个SNPs与中国多个地方鸡品种繁殖性能高度显著相关,如Lou等[16]在京海黄鸡GDF9基因发现存在2个位点(A2053G和C2420T)与其300日龄蛋重显著相关,Qin等[17]在大骨鸡GDF9基因发现存在1个位点,与其产蛋量和蛋种重显著相关,说明该基因在提高鸡产蛋率中发挥着重要作用。研究证实,GDF9还能和其他因子共同调控孕酮的合成。在鸡的研究中,GDF9通过增强促卵泡素受体(FSHR)的表达调控孕酮的合成[18],GDF9也可以刺激体外培养的牛颗粒细胞中孕酮的合成[19]。但GDF9抑制了人的孕酮合成[20],这说明GDF9基因在不同物种卵巢发育中的作用有着物种特异性。GDF9在番鸭卵巢中的调控作用鲜见报道。前期转录组研究证明,GDF9基因在番鸭产蛋期和就巢期存在显著差异,预测其可能作为卵泡发育时期的重要候选基因(结果未发表)。
快速分离cDNA末端(rapid-amplification of cDNA ends,RACE)技术是依据PCR技术,基于一段已知cDNA序列,克隆未知的cDNA末端的技术[21],现在RACE克隆技术被广泛用于克隆未知序列。本试验以番鸭为研究对象,利用RACE方法克隆GDF9基因CDS区序列并对其进行生物信息学分析,阐明该基因的生物学功能。同时,利用实时荧光定量PCR方法来检测该基因在不同发育时期及不同组织中的表达差异,为进一步研究番鸭GDF9基因的功能提供理论基础,也为该基因在调控其他物种繁殖分子机制提供关键依据。
1 材料与方法
1.1 材料
1.1.1 样品采集 试验动物为广东温氏家禽有限公司(莆田秀屿种鸭场)提供的小型白羽母番鸭(MB品系),饲养方式为笼养,按常规方法饲养管理,随机选择饲养条件相同的产蛋高峰期(21周龄,产蛋率为90%以上)、就巢期(42周龄)的母番鸭各9只。颈部放血后迅速取出其下丘脑、垂体、脾脏、心脏、肾脏、肝脏、肺脏、十二指肠、卵巢和子宫组织,用锡纸包裹,迅速放入液氮冷冻后置于-80 ℃保存备用。同一时期每3只番鸭的相同组织混成1个样品,做成3个重复。
1.1.2 主要试剂和仪器 TRIzol Reagent(15596026)购自Invitrogen公司;氯仿(10006818)、异丙醇(40064360)和无水乙醇(10009218)均购自国药集团化学试剂(上海)有限公司;反转录试剂盒3′-Full RACE Core Set with PrimeScriptTMRTase(6106)、SMARTer®RACE 5′/3′Kit(634860)、Tks Gflex DNA Polymerase(R060A)、克隆载体pMDTM19-T Vector Cloning Kit(6013)、大肠杆菌JM109感受态细胞(9052)、胶回收试剂盒Mini BEST DNA Fragment Purification Kit Ver.4.0(9761)、In-Fusion®HD Cloning Kit(639648)均购自宝日医生物技术(北京)有限公司;FastKing一步法除基因组cDNA第一链合成预混试剂(KR118)购自天根生化科技(北京)有限公司;GoTaq®Real-time PCR Systems(A6002)购自普洛麦格(北京)生物技术有限公司。
1730R微量高速冷冻离心机(型号:1730R)、酶标仪(型号:EPOLH)均购自基因有限公司;实时荧光定量PCR仪(型号:ECO)购自Illumina公司;热循环仪(型号:SimpliAmp)购自赛默飞世尔科技公司;电泳仪(型号:DYY-8C)购自北京六一生物科技有限公司。
1.2 方法
1.2.1 总RNA提取及cDNA合成 采用Trizol法提取番鸭各组织的总RNA,将提取的总RNA用酶标仪和电泳确定其纯度和浓度,选择D260 nm/D280 nm在1.8~2.0、28S和18S条带的亮度和宽度比例为2∶1的RNA为模板,采用反转录试剂盒合成cDNA,反转录产物保存于-20 ℃备用。
1.2.2 引物设计与合成 根据绿头鸭(Anasplatyrhynchos,登录号为XM_013104015)、凤头潜鸭(Aythyafuligula,登录号:XM_032196611.1)、疣鼻天鹅(Cygnusolor,登录号:XM_040573681.1)和棕硬尾鸭(Oxyurajamaicensis,登录号:XM_035338369.1)GDF9基因的mRNA序列,在序列保守性比较高的位置,设计3对引物用于番鸭GDF9基因CDS区的PCR扩增;根据获得的番鸭GDF9基因CDS区片段,分别设计5′-RACE和3′-RACE巢式PCR引物;根据获得的5′-RACE和3′-RACE以及CDS区序列分别设计引物F0和R0(GDF9-4),用于线性关系验证;利用获得的番鸭GDF9基因完整序列,设计实时荧光定量PCR引物,其中GAPDH为内参基因,引物信息见表1。引物均由北京睿博兴科生物科技有限公司合成。

表1 引物信息
1.2.3GDF9基因CDS区的克隆 根据设计的3对引物(GDF9-1、GDF9-2和GDF9-3),使用Tks Gflex DNA Polymerase进行PCR扩增番鸭GDF9基因CDS区。PCR反应总体系为50 μL:cDNA模板1 μL,2×Gflex PCR Buffer 25 μL,上、下游引物各1 μL,Tks Gflex DNA Polymerase 1 μL,ddH2O 21 μL。PCR反应条件:94 ℃预变性1 min;98 ℃变性10 s,55 ℃退火15 s,68 ℃延伸1 min,共35个循环。PCR扩增产物用1.5%琼脂糖凝胶电泳检测,用DNA胶回收试剂盒进行目的片段回收纯化,并将回收纯化的目的片段连接到pMDTM19-T克隆载体,转化大肠杆菌JM109感受态细胞,在平板上培养后挑出阳性菌落并接种于液体培养基中,于37 ℃恒温摇床中摇菌8 h后可见液体培养基浑浊,然后进行PCR鉴定,挑选3个阳性克隆送往北京睿博兴科生物科技有限公司测序。
1.2.4GDF9基因的RACE克隆 巢式PCR扩增番鸭GDF9基因5′-端和3′-端完整序列。5′-RACE PCR反应体系50 μL:cDNA模板1 μL,2×Gflex PCR Buffer 25 μL,Tks Gflex DNA Polymerase 1 μL,UPM Primer(试剂盒通用引物) 5 μL,5RACE-GSP1引物1 μL,ddH2O 17 μL。由于番鸭GDF9基因3′-端结构复杂,则采用巢式PCR扩增,3′-RACE第一次PCR反应体系50 μL:cDNA模板1 μL,2×Gflex PCR Buffer 25 μL,Tks Gflex DNA Polymerase 1 μL,Outer primer(试剂盒通用引物)1 μL,3RACE-GSP1引物 1 μL,ddH2O 21 μL。PCR反应条件:94 ℃预变性1 min;98 ℃变性10 s,55 ℃退火15 s,68 ℃延伸1 min,共35个循环。以第一次PCR产物为模板,3RACE-GSP2和试剂盒Inner为引物做巢式PCR扩增。反应体系与扩增条件与第一次一致。
5′-RACE 和3′-RACE最终的PCR扩增产物用1.5%的琼脂糖凝胶电泳检测,切胶回收目的产物,进行无缝克隆(infusion cloning),无缝克隆的步骤按说明书进行操作。挑选阳性克隆菌液,提取质粒并测序。
1.2.5 序列线性关系验证 使用验证引物F0和R0(GDF9-4)进行线性验证,其中F0位于5′-RACE扩增产物的中间位置,R0位于3′-RACE扩增产物的中间位置,若引物组合可以扩增到目的长度片段,则证明试验获得的5′-RACE和3′-RACE与目的条带在一条直线上。PCR反应体系和反应程序与3′-RACE PCR扩增一致。PCR扩增产物经1.5%琼脂糖凝胶电泳检测,切胶回收目的产物,按说明书对产物进行无缝克隆,提取质粒并测序,上述测序质粒均送往北京睿博兴科生物科技有限公司进行测序。
1.2.6 生物信息学分析 利用DNAStar v.7.1.0软件对番鸭GDF9基因各段测序的结果进行拼接;利用NCBI数据库中ORF finder在线软件预测番鸭GDF9基因的CDS区;利用DNAMAN 8.0软件将番鸭GDF9基因核苷酸序列翻译为氨基酸序列;利用NCBI中的BLAST程序对不同物种的GDF9基因的编码序列进行相似性比对;利用Mega 7.0构建系统进化树;利用ProtParam程序(http:∥web.expasy.org/protparam/)分析番鸭GDF9蛋白的理化性质,包括相对分子质量、氨基酸组成、理论等电点和不稳定系数等;利用ProtScale 在线软件(http:∥web.expasy.org/protscale/)分析番鸭GDF9蛋白的亲疏水性;利用NetPhos 3.1 Server程序(https:∥services.healthtech.dtu.dk/service.php?NetPhos-3.1)分析番鸭GDF9蛋白的磷酸化位点;利用NetOGlyc 4.0 Server(http:∥www.cbs.dtu.dk/services/NetOGlyc/)和 NetNGlyc 1.0 Server程序(http:∥www.cbs.dtu.dk/services/NetNlyc/)预测番鸭GDF9蛋白的O-糖基化位点和N-糖基化位点;利用SMART v 8程序(http:∥smart.embl-heidelber.de/)预测蛋白结构域;用TMHMM Server v.2.0程序(http:∥www.cbs.dtu.dk/services/TMHMM/)分析番鸭GDF9蛋白跨膜区域;利用SignalP 3.0 Server程序(http:∥www.cbs.dtu.dk/services/SignalP/)分析信号肽;利用PSORT Ⅱ Prediction程序(https:∥www.genscript.com/psort.html)分析番鸭GDF9蛋白的亚细胞定位;利用PSIPRED v.4.02程序(http:∥bioinf.cs.ucl.ac.uk/psipred/)分析蛋白二级结构;利用SWISS-MODEL在线软件(http:∥www.swissmodel.expasy.org/)对GDF9蛋白的三级结构进行建模;利用STRING交互式数据库(http:∥www.string-db.org/)对蛋白相互作用进行分析。
1.2.7 荧光定量PCR检测GDF9基因mRNA相对表达量 以番鸭下丘脑、垂体、脾脏、心脏、肾脏、肝脏、肺脏、十二指肠、卵巢和子宫组织cDNA序列为模板,以GAPDH为内参基因,参照GoTaq®qPCR Master Mix试剂盒说明书,采用实时荧光定量PCR检测番鸭GDF9基因的相对表达量。PCR反应体系20 μL:cDNA模板1 μL,GoTaq®qPCR Master Mix 10 μL,上、下游引物各1 μL,Supplemental CXR Reference Dye 0.2 μL,ddH2O 6.8 μL。PCR反应条件:50 ℃ UDG孵育2 min;95 ℃ 10 min;95 ℃ 10 s,60 ℃ 30 s,共40个循环;95 ℃ 15 s,55 ℃ 15 s,95 ℃ 15 s。然后分析熔解曲线,用2-△△Ct法计算GDF9基因的相对表达量。每个处理为3个生物学重复,每个生物学重复设置3个技术学重复。
1.2.8 统计分析 利用Graphpad Prism 8.2.1软件分析番鸭GDF9基因不同时期不同组织的相对表达量,同一时期不同组织间采用单因素方差分析(One-Way ANOVA)进行差异显著性检验,同一组织不同时期采用独立性t检验,结果均以平均值±标准差表示。P<0.05表示差异显著;P<0.01表示差异极显著;P>0.05表示差异不显著。
2 结 果
2.1 番鸭GDF9基因克隆及其序列分析
以番鸭卵巢cDNA为模板,以GDF9-1、GDF9-2、GDF9-3引物进行PCR扩增,获得了3个目的条带(图1A、1B和1C),经过切胶回收目的产物并测序,分别获得563、1 230、516 bp长度的片段。5′-RACE和3′-RACE扩增产物经琼脂糖凝胶电泳检测显示,分别获得2个目的条带(图1D和1E),切胶回收目的产物并测序,分别获得408和363 bp长度的片段,与预期结果一致。序列验证扩增产物用琼脂糖凝胶电泳检测显示,得到1个目的条带(图1F),切胶回收目的产物并测序,获得1 786 bp长度的片段,与预期结果一致。测序结果去除载体序列后用DNAStar v.7.1.0拼接得到番鸭GDF9基因完整序列,共2 024 bp,其中ATG是起始密码子,TAG是终止密码子。利用ORF finder在线软件预测番鸭GDF9基因CDS区位于第55-1 434 bp处,共1 380 bp,编码459个氨基酸;5′-UTR长度为54 bp,3′-UTR长度为590 bp。序列提交至GenBank,登录号为:OL606748。
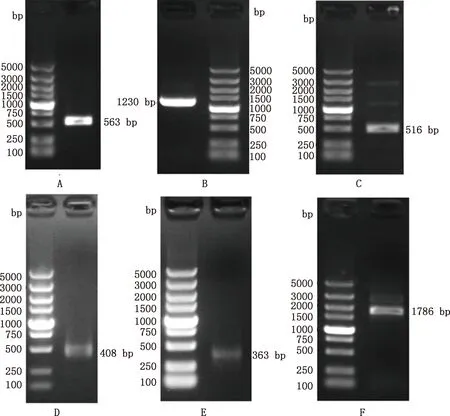
A~C,分别为GDF9-1、GDF9-2、GDF9-3引物PCR扩增产物;D,5′-RACE扩增产物;E,3′-RACE扩增产物;F,线性验证结果A-C,The PCR amplification results of GDF9-1,GDF9-2 and GDF9-3 primers;D,Amplification of 5′-RACE;E,Amplification of 3′-RACE;F,Linearity verification results图1 番鸭GDF9基因PCR扩增及序列验证Fig.1 PCR amplification and sequence verification of GDF9 gene in Muscovy duck
2.2 GDF9基因相似性比对和系统进化树的构建
番鸭GDF9基因序列与GenBank已公布的凤头潜鸭(XM_032196611.1)、绿头鸭(XM_013104015.4)、天鹅(XM_035560815.1)、棕硬尾鸭(XM_035338369.1)、浙东白鹅(XM_013175813.1)、企鹅(XM_009285943.1)、鸡(NM_206988.2)、牛(NM_174681.2)、绵羊(NM_001142888.2)、猪(NM_001001909.1)和小鼠(XM_006532220.5)对应序列的相似性依次为98.8%、97.5%、96.4%、95.8%、94.4%、90.2%、87.5%、64.5%、64.2%、63.9%和60.6%(图2)。系统进化树结果显示,番鸭与凤头潜鸭的亲缘关系最近,与绿头鸭的亲缘关系较近,与小鼠的亲缘关系较远(图3),进化树的结果与分类学保持了较高的一致性。
2.3 番鸭GDF9蛋白的理化性质、亲疏水性、蛋白翻译后位点修饰和结构域位点预测
预测结果显示,番鸭GDF9蛋白质理论分子质量为 52.81 ku,分子式为C2337H3663N671O676S26,等电点为8.96,失稳指数为61.67,属不稳定蛋白。共编码459个氨基酸,GDF9蛋白由20种氨基酸组成,氨基酸组成见表2。其中,亮氨酸(Leu)所占比例最高,为10.9%,色氨酸(Trp)所占比例最低,仅为1.5%。带负电荷残基总数(Asp+Glu)共48个,带正电荷残基总数(Arg+Lys)共60个,说明番鸭GDF9蛋白可能为碱性蛋白;脂肪族氨基酸指数为79.22;利用ProtScale在线软件预测该蛋白属于亲水性蛋白(图4)。NetPhos 3.1 Server在线分析软件预测GDF9蛋白可能存在45个磷酸化位点,其中丝氨酸(Ser)磷酸化位点31个,苏氨酸(Thr)磷酸化位点9个,酪氨酸(Tyr)磷酸化位点5个(图5);NetOGlyc 4.0 Server在线软件预测GDF9蛋白O-糖基化位点有8个,分别位于氨基酸序列的第20、28、34、176、180、204、226和457位(图6);NetNGlyc 1.0 Server在线软件预测GDF9蛋白存在3个潜在的N-糖基化位点,分别位于氨基酸序列的第245、277和343位(图7)。SMART程序预测在第358-459位氨基酸处存在1个转化生长因子-beta(TGF-β)结构域(图8)。

图2 不同物种间GDF9基因核苷酸相似性比对Fig.2 Similarity alignment of nucleotide sequences of GDF9 gene in different species
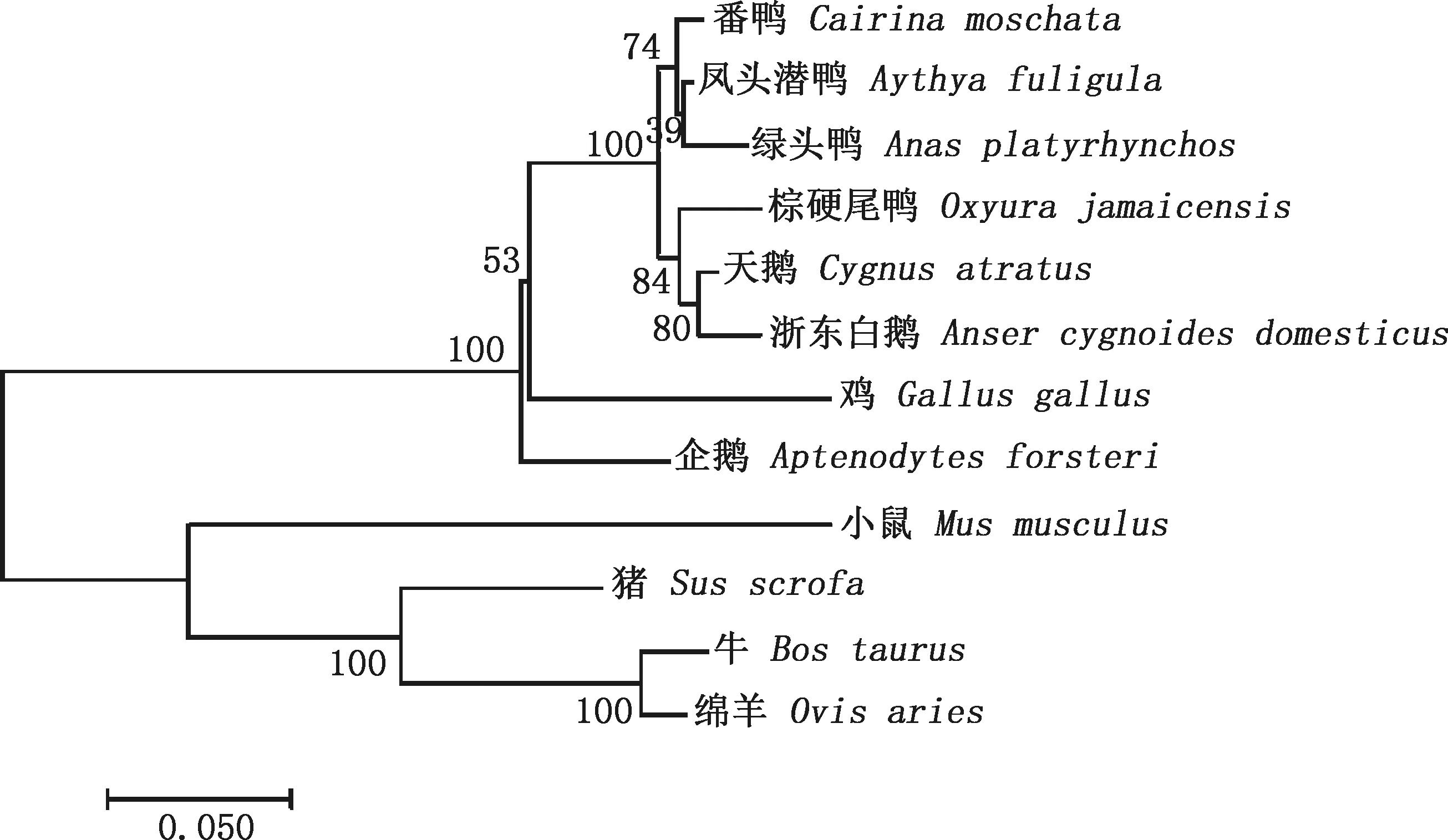
图3 GDF9基因序列的系统进化树Fig.3 Phylogenetic tree of GDF9 gene sequence
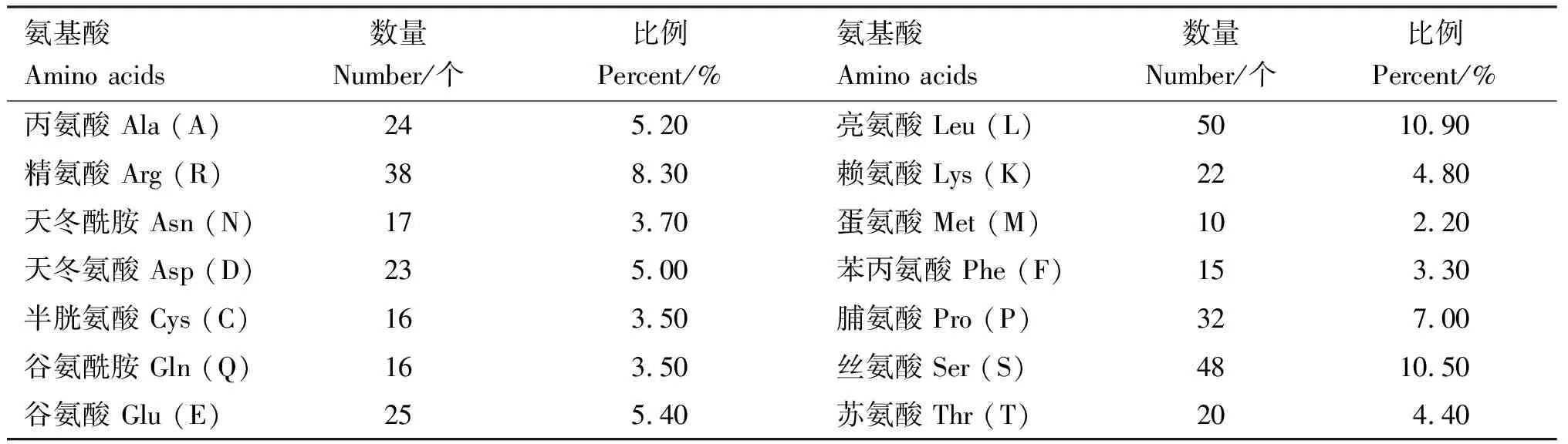
表2 番鸭GDF9蛋白的氨基酸组成
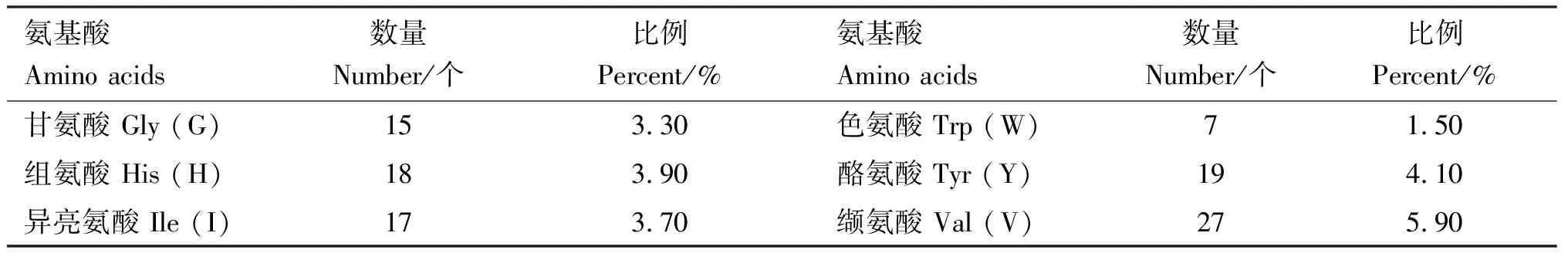
续表
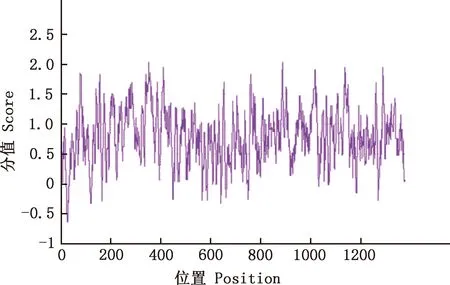
图4 番鸭GDF9蛋白的亲疏水性预测Fig.4 Prediction of hydrophilicity of GDF9 protein in Muscovy duck
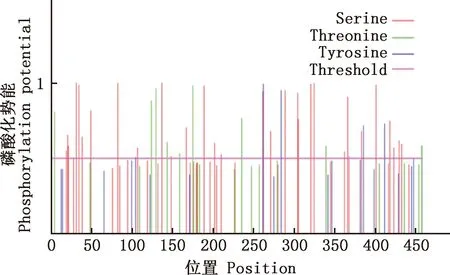
图5 番鸭GDF9蛋白的磷酸化位点预测Fig.5 Prediction of phosphorylation sites of GDF9 protein in Muscovy duck
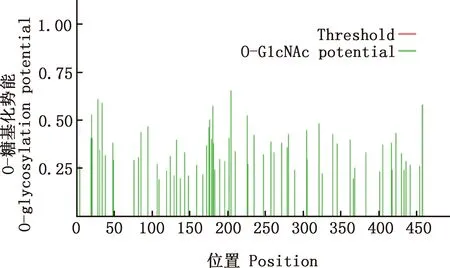
图6 番鸭GDF9蛋白的O-糖基化位点预测Fig.6 Prediction of O-glycosylation sites of GDF9 protein in Muscovy duck

图7 番鸭GDF9蛋白的N-糖基化位点预测Fig.7 Prediction of N-glycosylation sites of GDF9 protein in Muscovy duck

图8 番鸭GDF9蛋白的结构域预测Fig.8 Prediction of structural domain of GDF9 protein in Muscovy duck
2.4 番鸭GDF9蛋白跨膜结构、信号肽预测及亚细胞定位
利用TMHMM Server v.2.0 在线软件进行跨膜区域预测分析,结果表明该蛋白均位于膜外区域,是膜外蛋白(图9)。SingalP 3.0 Server在线软件预测结果发现GDF9蛋白存在1个信号肽区,位于第1—24位氨基酸处,信号肽的剪切位点位于第24—25位氨基酸之间(图10)。亚细胞定位结果显示,番鸭GDF9蛋白有65.2%的可能性存在于细胞核上,而位于线粒体上的概率是26.1%,位于细胞质上的概率为4.3%,位于细胞骨架上的概率为4.3%。
2.5 番鸭GDF9蛋白二级结构和三级结构预测
利用PSIPRED v.4.02在线软件预测结果显示,番鸭GDF9蛋白的二级结构中α-螺旋、β-折叠、T-转角和无规则卷曲分别为22.22%、2.61%、16.56%和58.61%(图11)。利用SWISS-MODEL在线软件预测GDF9蛋白三级结构,发现其无规则卷曲占比最多(图12),与二级结构的预测结果一致。

图9 番鸭GDF9蛋白的跨膜结构预测Fig.9 Prediction of transmembrane structure of GDF9 protein in Muscovy duck
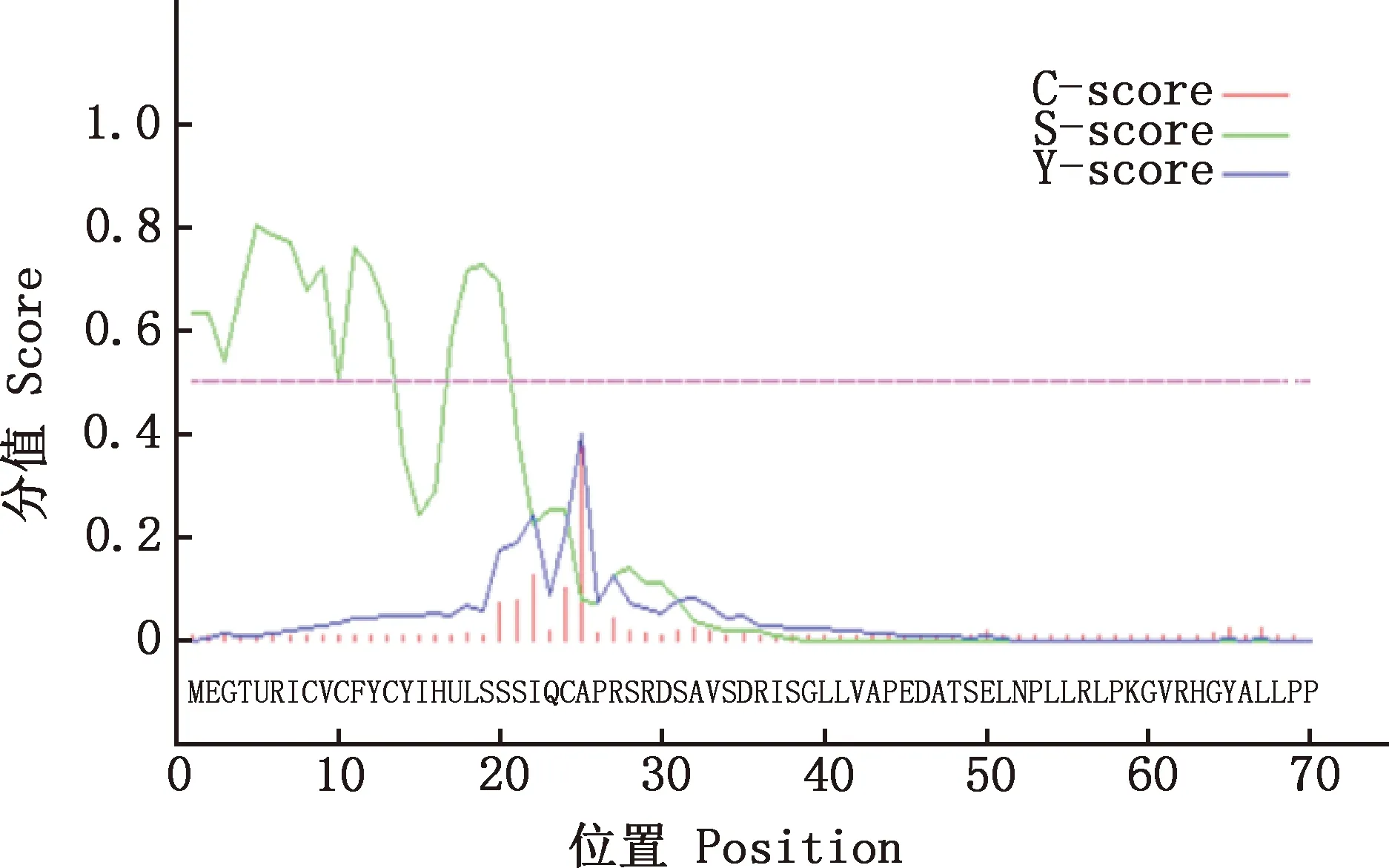
图10 番鸭GDF9蛋白的信号肽预测Fig.10 Prediction of signal peptide of GDF9 protein in Muscovy duck
2.6 番鸭GDF9蛋白相互作用分析
利用STRING交互式数据库在线软件预测GDF9蛋白相互作用,结果发现,GDF9蛋白可能与BMP15、BMPR1B、BMPR2、TGFBR1、ACVR1B、POF1B、ZP2、ZAR1、MOS等蛋白存在相互作用(图13)。
2.7 GDF9基因在就巢期和产蛋期番鸭的组织表达图谱
由图14知,所检测的就巢期和产蛋期番鸭各组织中均有GDF9基因的表达,其中两个时期卵巢中的表达量均最高,且极显著高于同一时期其他组织基因表达量(P<0.01)。同一组织不同时期相比,就巢期番鸭GDF9基因在脾脏、心脏和肾脏的表达量显著或极显著低于产蛋期(P<0.05;P<0.01),在卵巢中的表达量极显著高于产蛋期(P<0.01),其他组织中的表达量在两个时期间差异均不显著(P>0.05)。
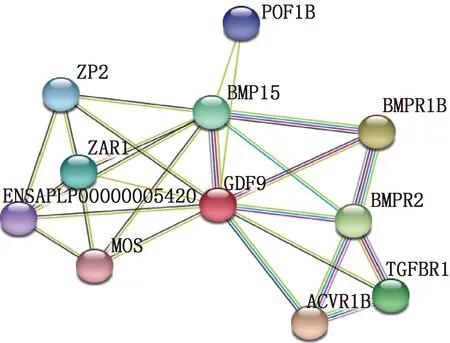
GDF9,生长分化因子9;BMP15,骨形态发生蛋白15;ZP2,透明带糖蛋白2;ZAR1,合子阻滞因子;POF1B,卵巢功能早衰1B;BMPR1B,骨形态发生蛋白受体1B;BMPR2,骨形态发生蛋白Ⅱ型受体;TGFBR1,转化生长因子-β受体1;ACVR1B,激活素受体1B;MOS,莫洛氏鼠类肉瘤病毒癌基因的同源蛋白产物GDF9,Growth differentiation factor 9;BMP15,Bone morphogenetic protein 15;ZP2,Zona pellucida glycoprotein 2;ZAR1,Zygote arrest 1;POF1B,POF1B actin binding protein;BMPR1B,Bone morphogenetic protein receptor type 1B;BMPR2,Bone morphogenetic protein receptor type 2;TGFBR1,Transforming growth factor beta receptor 1;ACVR1B,Activin A receptor type 1B;MOS,MOS proto-oncogene,serine/threonine kinase图13 番鸭GDF9蛋白与其他蛋白的相互作用网络Fig.13 Interaction network of GDF9 protein in Muscovy ducks with other proteins

①1,下丘脑;2,垂体;3,脾脏;4,心脏;5,肾脏;6,肝脏;7,肺脏;8,十二指肠;9,卵巢;10,子宫。②同一时期不同组织进行比较,数据肩标不同小写字母表示差异显著(P<0.05);肩标不同大写字母表示差异极显著(P<0.01);肩标相同字母标注表示差异不显著(P>0.05)。③同一组织不同时期相比,*,差异显著(P<0.05);**,差异极显著(P<0.01);无*,差异不显著(P>0.05)①1,Hypothalamus;2,Pituitary;3,Spleen;4,Heart;5,Kidney;6,Liver;7,Lung;8,Duodenum;9,Ovary;10,Uterus.②Compared different organizations in the same period,values with different small letter superscripts mean significant difference (P<0.05);And with different capital letter superscripts mean extremely significant difference (P<0.01);While with the same letter superscripts mean no significant difference (P>0.05).③Compared with different periods of the same organization,*,Significant difference (P<0.05);**,Extremely significant difference (P<0.01);No *,No significant difference (P>0.05)图14 番鸭GDF9基因的组织表达分析Fig.14 Tissue expression analysis of GDF9 gene in Muscovy ducks
3 讨 论
GDF9基因作为TGF-β超家族的重要成员之一。通过激活细胞膜上的丝氨酸(Ser)或苏氨酸(Thr)激酶的受体(ALK5和BMPRⅡ)来调控动物的生长发育[22]。目前,GDF9在番鸭上的研究鲜有报道,本试验通过RACE技术成功克隆了番鸭GDF9基因的完整序列。其中CDS区共1 380 bp,编码459个氨基酸。对其进行了生物信息学分析,发现GDF9基因与凤头潜鸭、绿头鸭、天鹅、棕硬尾鸭等物种相似性在95%以上,表明GDF9基因在禽类具有高度保守性。 GDF9蛋白不稳定指数为61.67,蛋白质不稳定系数达到40以上被认为蛋白质结构不稳定。无规则卷曲是影响蛋白质结构稳定性的重要因素,GDF9蛋白的二级结构预测发现,无规则卷曲占比为58.61%,这与预测结果中其为不稳定蛋白结果相一致[23]。GDF9蛋白可能与POF1B[24]、ZP2[25]、ZAR1[26]等在卵巢发育中发挥重要功能的蛋白有关,GDF9可能与这些基因共同在卵巢中发挥交互作用。
蛋白质磷酸化是蛋白质翻译后最主要的修饰方法之一[27],参与调控细胞增殖、化学信号转导[28]、细胞凋亡[29]等重要生理过程。经预测发现番鸭GDF9蛋白PTM磷酸化位点丰富,说明GDF9基因可能参与复杂的生理学过程。当丝氨酸或苏氨酸的激酶受体(ALK5和BMPRⅡ)与GDF9结合后,受体间会形成异源二聚体复合物,Ⅱ型受体(BMPRⅡ)激活Ⅰ型受体(ALK5和ALK6)。当Ⅰ型受体被激活后,受特异性受体调控的SMAD蛋白(RSMAD)发生磷酸化反应,与普通SMAD(SMAD4或Co-SMAD)蛋白相互作用传导信号入核,引发转录和翻译过程从而完成信号传导[9]。研究发现,GDF9基因被认为促进鼠体内的颗粒细胞增殖和DNA合成[30],促进鸡的颗粒细胞周期进程,加强DNA复制过程并且抑制细胞凋亡[18]。说明本研究中预测到的这些位点可能在番鸭卵泡颗粒细胞的细胞增殖和分化,细胞周期和细胞凋亡等重要生长过程中发挥了重要作用。
本研究中检测了就巢期和产蛋期两个时期番鸭各组织表达量中GDF9的mRNA表达图谱,结果发现,GDF9在番鸭的下丘脑、垂体、心脏、肝脏、脾脏、肺脏、肾脏、十二指肠、卵巢和子宫中均有表达,在产蛋期和就巢期的卵巢组织中高度表达,在其他组织中微量表达。结果说明GDF9在番鸭的生殖器官中发挥着重要作用,可能对其他组织器官也具有一定的作用。这种在卵巢组织中高表达模式的结果与羊[31]、牛[32]等物种的GDF9基因表达量一致。胡冬利等[33]在湖羊的研究发现,GDF9基因是湖羊卵巢中的差异表达基因,这与本试验结果一致。在本试验中,就巢期番鸭卵巢GDF9基因表达量极显著高于产蛋期番鸭卵巢GDF9基因表达量,说明GDF9基因为番鸭卵巢发育中的差异表达基因,参与番鸭的卵泡发育过程。而何远清[34]利用半定量RT-PCR技术对山羊不同GDF9基因型卵巢组织中GDF9基因的表达量进行了研究,结果发现,不同基因型山羊GDF9基因在同一时期卵巢GDF9基因表达量存在显著差异且突变型个体表达量最高,可能是GDF9基因的高表达量水平维持卵泡生长发育,但这与本试验结果不一致,猜测其原因为番鸭与山羊存在不同的卵泡发育机制。
GDF9基因在调控卵泡颗粒细胞增殖中存在物种差异性。Hickey[35]发现,GDF9可以促进体外培养的猪卵泡颗粒细胞增殖;Vitt等[30]在大鼠中研究发现,GDF9也可以促进大鼠排卵前卵泡颗粒细胞增殖;但李金秋[7]在鸡中的报道发现,在一定浓度的外源GDF9蛋白范围内,GDF9都抑制了颗粒细胞的活性,并且呈现剂量依赖性。而本试验结果发现,就巢期番鸭的GDF9基因表达量极显著高于产蛋期,猜测这一现象可能是因为GDF9基因表达量过高抑制番鸭卵泡颗粒细胞增殖,且大鼠、猪和家禽的卵泡发育机制不同。后续研究将以番鸭卵巢的颗粒细胞为试验材料,研究其抑制颗粒细胞增殖的遗传机制。
4 结 论
本研究成功克隆了番鸭GDF9基因的CDS区,全长1 380 bp,编码459 个氨基酸。相似性比对与进化树结果表明,番鸭GDF9基因与凤头潜鸭和绿头鸭的亲缘关系较近,与小鼠的亲缘关系较远;GDF9蛋白是一种不稳定的碱性亲水膜外蛋白,磷酸化位点、O-糖基化位点、N-糖基化位点丰富,存在1个TGF-β结构域,主要二级结构为无规则卷曲。GDF9基因在番鸭各组织中均有表达,但在卵巢组织极显著表达。GDF9基因为产蛋期和就巢期在卵巢、心脏、肾脏、脾脏的差异表达基因。该研究为进一步探索番鸭中GDF9基因的功能提供了理论依据,也为研究GDF9基因在卵巢发育中的分子机制奠定基础。
