瘢痕内注射曲安奈德和A型肉毒毒素治疗增生性瘢痕
2022-03-17张亦轩卫家玉俞舜王丹杨敏烈吕国忠
张亦轩 卫家玉 俞舜 王丹 杨敏烈 吕国忠



[摘要]目的:比較瘢痕内注射A型肉毒毒素和曲安奈德的疗效及副作用。方法:选取2020年6月-2021年1月笔者医院整形美容科就诊的40例增生性瘢痕患者为研究对象,依据随机数字表法将患者分为两组,每组20例。对照组局部注射曲安奈德治疗,观察组局部注射A型肉毒毒素治疗,比较两组患者治疗后满意度和不良反应发生率,采用改良温哥华瘢痕量表(VSS)评估治疗前后增生性瘢痕的变化,采用视觉模拟评分表(VAS)评估治疗前后瘢痕处痛痒觉变化,采用CBS瘢痕检测仪评估治疗前后瘢痕处皮肤特性(瘢痕面积、色素含量、水分含量及油分含量)变化。结果:观察组患者总满意度为80.00%,显著高于对照组的45.00%,组间差异有统计学意义(P<0.05);对照组不良反应发生率为20.00%,显著高于观察组的0.00%,组间差异有统计学意义(χ2=4.444,P<0.05)。治疗后,两组VSS分值及VAS均较治疗前降低,差异均有统计学意义(P<0.05)。治疗后两组VSS、VAS改善程度比较,差异无统计学意义(P>0.05)。结论:曲安奈德和A型肉毒毒素注射液治疗增生性瘢痕,其临床疗效未见明显差异,但肉毒毒素治疗不良反应发生率低,副作用少,患者满意度高,安全性更高,可临床推广应用。
[关键词]增生性瘢痕;瘢痕治疗;曲安奈德;A型肉毒毒素;瘢痕量表
[中图分类号]R619+.6 [文献标志码]A [文章编号]1008-6455(2022)02-0077-05
Treating Hypertrophic Scars by Injecting Triamcinolone Acetonide and Botulinum Toxin A (BTX-A) into Focus, A Random Contrast Experiment
ZHANG Yixuan1, WEI Jiayu2, YU Shun3, WANG Dan3,YANG Minlie3,LV Guozhong1,3
(1.Graduate School,Nanjing University of Chinese Medicine,Nanjing 210023,Jiangsu,China; 2.Wuxi Medical College,Jiangnan University,Wuxi 214122,Jiangsu,China; 3.Department of Burns and Orthopedic Surgery, Affiliated Hospital of Jiangnan University,Wuxi 214041,Jiangsu,China)
Abstract: Objective To compare the efficacy and side effects of injecting BTX-A and triamcinolone acetonide into focus. Methods Patients with scar tissue who visited the outpatient department of plastic surgery in our hospital from June 2020 to January 2021 were selected. Forty patients were enrolled and randomly divided into two groups according to the random number table method. The 20 cases in the contrast group were treated with local injection of triamcinolone acetonide while the 20 cases in the observation group were treated with local injection of BTX-A. The satisfaction degrees and adverse reaction incidence rates of patients in the two groups after treatment were treated. The modified Vancouver Scar Scale (VSS) was used to evaluate the changes of hypertrophic scars before and after treatment. Visual Analogue Scale (VAS) was used to evaluate the changes of pain and itching sensations in the focus before and after treatment. CBS Scar Detector introduced from Taiwan was used to evaluate the changes of skin characteristics (scar area, pigment content, moisture content and oil content) before and after treatment. Results The total satisfaction degree of patients in the observation group is 80.00%, which is significantly higher than 45.00% of the contract group. The inter-group difference is of statistical significance (P<0.05). The adverse reaction incidence rate of the contrast group is 20.00%, which is significantly higher than 0.00% of the observation group. The inter-group difference is of statistical significance (χ2 =4.444, P<0.05). After the treatment, VSS scores and VAS scores of both hormone group and BTX group are both lowered those before the treatment, showing the difference of statistical significance (P<0.05). After the treatment, the VSS and VAS improvement degrees between both groups are insignificant, showing no statistical significance(P>0.05). It indicates that scars of both groups are improved after treatment, but with insignificant efficacy differences between two groups. CBS Scar Detector shows that the scar areas of patients before and after treatment are obviously reduced and there is no obvious change in skin pigment content, moisture content and oil content. Conclusion In the two groups, there is no obvious difference in clinical efficacy of triamcinolone acetonide and BTX-A injections on hypertrophic scars. However, BTX group is featured by lower adverse reaction incidence rate, fewer side effects, higher patient satisfaction degree and higher security, which is more worthy of clinical promotion.
Key words: hypertrophic scars; scar treatment; triamcinolone acetonide; botulinum toxin A;scar scale
治疗病理性瘢痕对临床医生来说是一个挑战。临床报道有许多不同的治疗策略,但尚未有标准的治疗方案[1-2]。曲安奈德(Triamcinolone acetonide,TAC)治疗增生性瘢痕的疗效早在20世纪六七十年代就已在临床试验中得到证实[3]。基于这些早期的试验,TAC在临床上大多数治疗过的增生性瘢痕中显示了临床效果[4]。然而,最近的数据表明长期注射类固醇激素,会导致瘢痕耐药性产生,导致注射无效[5]。此外,最初对TAC治疗有效的增生性瘢痕中有9%~50%会复发[5]。除了TAC治疗无效或复发的病理性瘢痕比例相当高之外,约一半TAC治疗的病理性瘢痕也与副作用相关,如:皮下萎缩和毛细血管扩张。因此,A型肉毒毒素(BTX-A)已成为新的可行的选择,可以提高治疗效果,而副作用较少[6]。基于此,本研究选取笔者医院收治的40例增生性瘢痕患者给予不同治疗方法并比较疗效,旨在探究瘢痕内注射A型肉毒毒素治疗增生性瘢痕的疗效及其副作用,现将结果报道如下。
1 资料和方法
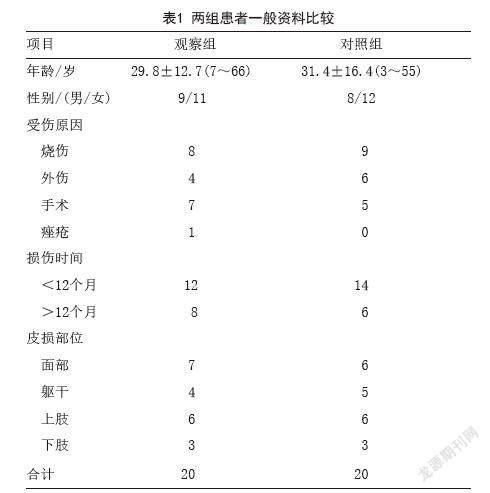
1.1 一般资料:选取2020年11月-2021年5月笔者科室收治的40例增生性瘢痕患者为研究对象,其中女23例,男17例,年龄3~66岁,病史40天至14年,符合增生性瘢痕的相關诊断标准。依据数字表法随机分为观察组和对照组,每组20例。观察组男9例,女11例,平均年龄(29.8±12.7)岁;对照组男8例,女12例,平均年龄(31.4±16.4)岁,瘢痕形成原因涉及外伤、烧伤、手术和痤疮,主要部位为面部、躯干、上肢及下肢。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。
1.2 纳入标准:所有患者在治疗开始前均获得知情同意,临床症状符合《临床诊疗指南:整形外科学分册》中相关诊断标准。
1.3 排除标准:①既往对TAC或BTX-A有过敏反应的患者;②孕妇及哺乳期女性;③最近6个月内因瘢痕使用其他治疗方式治疗者;④既往有神经肌肉疾病史,心脏病、血液疾病、活动性皮肤感染、活动性肺结核患者;⑤严重全身性感染、活动性消化性溃疡、严重抑郁或精神病者。
1.4 方法
1.4.1 TAC组:在瘢痕表面涂抹5%复方利多卡因乳膏(10克/支,同方药业集团有限公司)30 min,将TAC(浙江仙据制药股份 公司)制剂5毫升:50毫克/支与0.9%氯化钠注射液1:1比例混匀,在瘢痕周围封闭注射5 mg/cm2,至皮损轻微发白终止。每次注射剂量不超过40 mg,每2周1次,重复4次。
1.4.2 BTXA组:在瘢痕表面涂抹复方利多卡因乳膏30 min,A型肉毒毒素(兰州生物技术开发有限公司,每支100 U)制剂与2 ml的0.9%氯化钠注射液稀释至50 U/ml,在瘢痕周围封闭注射5 U/cm2,至皮损轻微发白终止。总剂量每次小于100 U,每2周1次,重复4次。
两组均为皮内注射,由一位整形外科医生完成。两组完成治疗周期后,对所有患者随访6个月,治疗期间每2周随访1次,治疗结束后每月随访1次。记录随访照片和可能的不良反应。瘢痕的数码照片(Canon 700D,东京,日本)是在相同光源和照明条件下使用标准光源盒拍摄的。在拍摄所有照片之前,必须获得书面的知情同意和许可。
1.5 临床疗效评价
1.5.1 满意度评估:对患者总体满意度评分进行评估,即所有参与者在研究结束时完成一份问卷调查,由患者进行疗效主观评价(不满意=无变化,不太满意=轻微改善,满意=中等改善,非常满意=良好改善)。
1.5.2 不良反应情况:对所有患者的不良反应进行问卷调查,即所有参与者在每次治疗后,进行微信随访,由同一名医生及时记录患者注射后不良反应发生情况。
1.5.3 采用温哥华瘢痕量表(VSS)对增生性瘢痕病变进行主观评估。它包含了4个参数的评估(色泽、血管分布、厚度和柔软度),总分为15分。评分越低,瘢痕改善效果越好。
1.5.4 采用视觉模拟量表(Visual analogue scale,VAS)评估患者的主观感受(瘙痒、疼痛)。由患者进行主观评定,总分10分,0分为无痛;1~3分轻微疼痛,可以忍受;4~6分为疼痛影响睡眠,尚能忍受;7~10分为疼痛难忍,影响睡眠和食欲。
1.5.5 用CBS瘢痕仪测量皮肤特性,CBS瘢痕仪使用高清皮肤镜完成对所有病变在基线和治疗结束后增生性瘢痕的客观评估,包含瘢痕处表面积、色素含量、水分含量及油分含量值。
1.6 统计学分析:使用SPSS version 21.0软件IBM SPSS Statistics for Windows, version 21.0。为了比较TAC组和BTX-A组的患者特征,使用卡方(离散变量)检验和Mann-Whitney U检验(连续变量)。用卡方检验分析副作用发生的频率。配对t检验用于比较BTX-A组和TAC组的VSS评分、VAS评分、患者总体满意度和皮肤特性值,P<0.05为有统计学意义。
2 结果
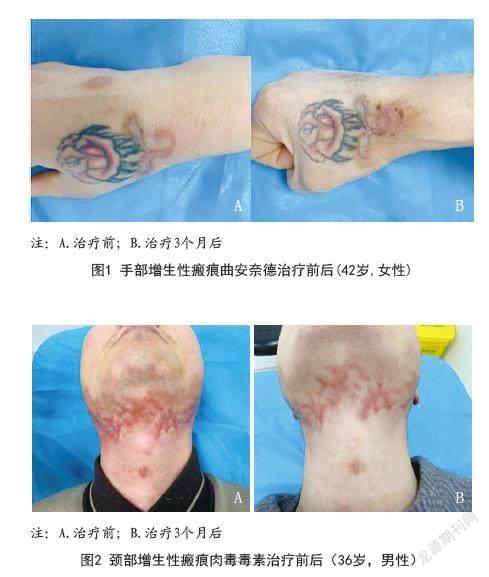
2.1 满意度评价:治疗后,观察组患者总满意率为80.00%,显著高于对照组的45.00%,两组比较差异有统计学意义(P<0.05),见表2。相较于对照组,观察组患者满意度更高。典型病例见图1~3。
2.2 两组不良反应情况比较:治疗后,对照组皮肤萎缩、色素脱失、月经紊乱各1例;观察组未见不良反应发生,对照组不良反应发生率(20.00%)显著高于观察组(0.00%),组间差异有统计学意义(χ2=4.444,P<0.05)。
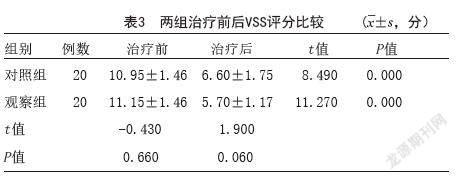
2.3 温哥华瘢痕评估(VSS):两组治疗后VSS评分分别为(6.60±1.75)分、(5.70±1.17)分,分值均较治疗前降低,与治疗前比较差异有统计学意义(P<0.05)。治疗后,两组VSS改善程度比较差异无统计学意义(P>0.05),说明两组瘢痕经过治疗均得到改善,但组间疗效差异不明显。见表3。
2.4 瘢痕疼痛与瘙痒比较:大多数患者注射A型肉毒毒素1~2个疗程后瘢痕疼痛与瘙痒明显缓解,甚至完全消失,对照组和观察组治疗周期完成后VAS评分分别为(2.00±0.97)分、(2.10±0.78)分,分值均较治疗前降低,差异有统计学意义(P<0.05)。治疗后,两组VAS改善程度比较,差异无统计学意义(P>0.05),说明两组瘢痕经治疗后痛痒觉均得到改善,但两组疗效差异不明显。见表4。
2.5 皮肤特性检测:采用CBS瘢痕检测仪,两组在治疗周期完成后,瘢痕面积明显缩小,但皮肤色素值、皮肤水分含量及油分含量均未见明显变化,且两组治疗后组间差异无统计学意义(P>0.05),见表5。见图4~5。
3 讨论
增生性瘢痕是一种纤维性皮肤疾病,其特征是成纤维细胞增生和过量的胶原沉积。据报道,增生性瘢痕已被证明在30%~75%的烧伤患者和75%的术后患者中发生[7-9]。增生性瘢痕会导致患者疼痛、瘙痒、严重的情绪困扰和自信心下降,同时这些症状通过引起心理、社会、功能及审美上的痛苦而显著影响患者[10]。目前治療增生性瘢痕的方法包括手术切除、皮质类固醇和5-氟尿嘧啶(5-FU)治疗,但每种方法都有其自身的局限性和副作用。临床证据表明,A型肉毒毒素(BTX-A)可预防和治疗瘢痕疙瘩和增生性瘢痕[11-12]。BTX-A已广泛用于治疗皱纹、眼睑痉挛、面肌痉挛,可通过减少瘢痕大小、红斑、疼痛和瘙痒,成为增生性瘢痕的有效预防或治疗选择[13-14]。相关研究发现BTX-A可能通过减少成纤维细胞增殖,调节转化生长因子-b的活性,以及减少增生性瘢痕来源的真皮成纤维细胞因子的转录和表达来减少皮肤纤维化,虽然BTX-A可能调节胶原沉积,但缺乏关于具体作用机制的证据[15]。在目前临床治疗上,瘢痕内注射皮质类固醇依旧是增生性瘢痕的一线治疗方法[16]。目前最常用的方案是不溶性TAC 10~40 mg/ml单独或更好地与利多卡因每周、2周或每月联合使用[17]。据报道,糖皮质激素通过抗炎和免疫抑制作用、血管收缩以及抗有丝分裂作用而抑制成纤维细胞和角质形成细胞增殖来抑制愈合和病理瘢痕形成[18]。单独注射曲安奈德对减少增生性瘢痕的体积是有效的[19]。但是注射曲安奈德后复发率高且副作用明显,因而A型肉毒毒素(BTX-A)成为治疗增生性瘢痕的有效预防或治疗选择。成纤维细胞过度增殖和细胞外基质沉积是增生性瘢痕的两个共同特征[20-21],细胞因子和生长因子是这一过程中的重要调控因子,如:转化生长因子b(TGF-b)、成纤维细胞生长因子(FGF)、表皮生长因子(EGF)等。除趋化神经外,Xiao等[22-23]也发现BTX-A能明显抑制TGF-b的合成,抑制成纤维细胞的增殖,从而减少Ⅰ、Ⅲ型胶原的沉积。
本研究旨在比较瘢痕内注射BTX-A和瘢痕内注射TAC治疗增生性瘢痕的疗效,研究共纳入40例经临床证实的增生性瘢痕病变患者。结果显示,两组患者治疗周期结束后,观察组患者总满意度显著高于对照组,说明A型肉毒毒素在治疗增生型瘢痕的过程中接受度更高,效果更好。对照组不良反应发生率显著高于观察组,说明A型肉毒毒素在瘢痕治疗中的安全性更高。两组治疗后VSS分值均较治疗前降低,治疗后两组之间VSS改善程度差异不显著,说明两组瘢痕经过曲安奈德或者A型肉毒毒素注射液治疗后均可改善增生性瘢痕的色泽、血管分布、厚度和柔软度,是目前治疗增生性瘢痕的有效手段。两组治疗后VAS分值均较治疗前降低,治疗后两组之间VAS改善程度差异不显著,说明两组瘢痕经过曲安奈德或者A型肉毒毒素注射液治疗后患者的痛痒程度均得到改善,可起到缓解瘢痕增生过程中的不适感。
经过CBS瘢痕检测仪显示,两组在治疗周期完成后,瘢痕面积明显缩小,但皮肤色素值、皮肤水分含量及油分含量均未见明显变化,治疗后瘢痕检测仪情况显示,两组治疗后瘢痕明显萎缩,表面区域平整,颜色变浅。说明曲安奈德或者A型肉毒毒素注射液均可以改善瘢痕的大小,但对瘢痕处皮肤特性的作用是不明显的。分析其原因可能在于A型肉毒杆菌毒素(BTXA)是一种神经毒性蛋白,可通过抑制神经肌肉接头处乙酰胆碱的释放来诱导化学去神经,导致持续约6个月的肌肉麻痹,因而防止愈合期潜在的肌肉收缩来减轻伤口上的张力,减小瘢痕增生的范围。BTXA可通过抑制细胞周期来延缓成纤维细胞的生长,并且能够在伤口愈合过程中降低转化生长因子-b1(TGF-b1)的表达[24-25]。BTXA在体外抑制成纤维细胞向肌成纤维细胞的分化[26],减少瘢痕治疗后的反跳现象,减少复发率,更加促进增生性瘢痕治疗的预后。此外,BTXA抑制感觉神经末梢释放SP,从而解释了BTXA止痒止痛的机理。A型肉毒毒素治疗效果确切,满意度及安全性均较高高,更值得临床推广。
本研究仍存在一定的局限性。两组样本量较小,未进行相关亚组分析。同时,由于样本量小,A型肉毒毒素剂量的潜在标准没有记录。此外,为了进一步探讨注射A型肉毒毒素改善瘢痕外观的作用,今后还应关注不同肌肉下瘢痕的愈合能力等变化。
[参考文献]
[1]AlAttar A,Mess S,Thomassen J M,et al.Keloid pathogenesis and treatment[J].J Plast Reconstr Surg,2006,117(1):286-300.
[2]Chike-Obi C J,Cole P D, Brisset A E.Keloids:pathogenesis,clinical features,and management[J].Seminars Plast Surg,2009,23(3):
178-184.
[3]Murray R D.Kenalog and the treatment of hypertrophied scars and keloids in negroes and whites[J].J Plast Reconstr Surg,1963,31(3):275.
[4]Mustoe T A,Cooter R D,Gold M H.International clinical recommendations on scar management[J].J Plast Reconstr Surg,2002,110(2):560.
[5]Ud-Din S,Bowring A,Derbyshire B,et al.Identification of steroid sensitive responders versus non-responders in the treatment of keloid disease[J].Arch Dermatol Res,2013,305(5):423-432.
[6]Sun Pengfei, Ji Zhonglei, Li Zhengyong, et al.Prevention of scar hyperplasia in the skin by conotoxin:A prospective review[J].J Cosmet Dermatol,2021,20(6):1885-1888.
[7]Kiprono S K,Chaula B M,Masenga J E,et al.Epidemiology of keloids in normally pigmented Africans and African people with albinism: population-based cross-sectional survey[J].Br J Dermatol,2015,173(3):852-854.
[8]Sun L M,Wang K H,Lee Y C. Keloid incidence in Asian people and its comorbidity with other fibrosis-related diseases: a nationwide population-based study[J].Arch Dermatol Res,2014,306(9):803-808.
[9]Bombaro K M,Engrav L H,Carrougher G J,et al.What is the prevalence of hypertrophic scarring following burns?[J].Burns,2003,29(4):299-302.
[10]Kouwenberg C A,Bijlard E,Timman R,et al.Emotional quality of life is severely affected by keloid disease: pain and itch are the main determinants of burden[J].Plast Reconstr Surg,2015,136(4):150-151.
[11]Arno A I,Gauglitz G G,Barret J P,et al.Up-to-date approach to manage keloids and hypertrophic scars: a useful guide[J].Burns,2014,40(7):1255-1266.
[12]Ogawa R.The most current algorithms for the treatment and prevention of hypertrophic scars and keloids[J].Plast Reconstr Surg,2010,125(2):557-568.
[13]Shaarawy E,Hegazy R A,Abdel Hay R M.Intralesional botulinum toxin type A equally effective and better tolerated than intralesional steroid in the treatment of keloids: a randomized controlled trial[J].J Cosmet Dermatol,2015,14(2):161-166.
[14]Elhefnawy A M.Assessment of intralesional injection of botulinum toxin type A injection for hypertrophic scars[J].Indian J Dermatol Venereol Leprol,2016,82(3):279-283.
[15]Austin E,Koo E,Jagdeo J.The cellular response of keloids and hypertrophic scars to botulinum toxin A:A comprehensive literature review[J].Dermatol Surg,2018,44(2):149-157.
[16]Mehta A B, Nadkarni N J,Patil S P.Topical corticosteroids in dermatology[J].Indian J Dermatol Venereol Leprol,2016,82(4):
371-378.
[17]Gupta S,Sharma V K.Standard guidelines of care: Keloids and hypertrophic scars[J].Indian J Dermatol Venereol Leprol,2011,77(1):94-100.
[18]Arno A I, Gauglitz G G, Barret J P.Up-to-date approach to manage keloids and hypertrophic scars: A useful guide[J].Burns,2014,40(7):1255-1266.
[19]Atiyeh B S.Nonsurgical management of hypertrophic scars:evidence-based therapies, standard practices,and emerging methods[J].Aesth Plast Surg,2007,31(5):468-492.
[20]Miller M C,Nanchahal J.Advances in the modulation of cutaneous wound healing and scarring[J].Bio Drugs,2005,19(6):363-381.
[21]Lee J Y,Yang C C,Chao S C,et al.Histopathological differential diagnosis of keloid and hypertrophic scar[J].Am J Dermatopathol, 2004,26(5):379-384.
[22]Xiao Z,Zhang M,Liu Y,et al.Botulinum toxin type A inhibits connective tissue growth factor expression in fibroblasts derived from hypertrophic scar[J].Aesthetic Plast Surg,2011,35(5):802-807.
[23]Xiao Z,Zhang F,Lin W,et al.Effect of botulinum toxin type A on transforming growth factor beta1 in fibroblasts derived from hypertrophic scar: a preliminary report[J].Aesthetic Plast Surg,2010,34(4):424-427.
[24]Zhibo X,Miaobo Z.Botulinum toxin type A affects cell cycle distribution of fibroblasts derived from hypertrophic scar[J].J Plast Reconstr Aesthet Surg,2008,61(9):1128-1129.
[25]Xiao Z,Zhang F,Lin W,et al.Effect of botulinum toxin type A on transforming growth factor beta 1 in fibroblasts derived from hypertrophic scar: a preliminary report[J].Aesthet Plast Surg,2010,34(1):424-427.
[26]Jeong H S,Lee B H,Sung H M,et al.Effect of botulinum toxin type A on differentiation of fibroblasts derived from scar tissue[J].Plast Reconstr Surg,2015,136(2):171-178.
[收稿日期]2021-03-18
本文引用格式:張亦轩,卫家玉,俞舜,等.瘢痕内注射曲安奈德和A型肉毒毒素治疗增生性瘢痕—一项随机对照试验[J].中国美容医学,2022,31(2):77-81.
3332500589290
