虹鳟肌肉中MS-222麻醉剂残留的HPLC-UV检测方法探究
2022-03-16康玉军康鹏天陈桂花何晶晶施泽强
康玉军,康鹏天,陈桂花,何晶晶,刘 哲,施泽强
(1.甘肃农业大学 动物科学技术学院,甘肃 兰州 730070;2.甘肃省渔业技术推广总站,甘肃 兰州 730030;3.敦煌市金博特种水产养殖有限公司,甘肃 敦煌 736203)
虹鳟是联合国粮农组织向全球推荐的优良鱼类养殖品种之一。因其骨少肉厚,含肉率高,无肌间刺,肌肉中富含不饱和脂肪酸,深受人们的喜爱[1]。然而,虹鳟对水质要求高、应激性强,在其活鱼运输过程中往往因运输胁迫导致鱼体受伤死亡,影响鲜度[2-3]。
合理使用化学麻醉剂能够降低鱼体新陈代谢,减少对鱼体的伤害,从而提高运输存活率,降低运输成本,达到安全有效运输的目的[2]。MS-222(3-氨基苯甲酸乙酯甲基磺酸盐),是目前广泛应用于水产动物中的麻醉剂,因其具有易处理、效力迅速等优点,已获得美国食品及药物管理局(FDA)批准认证[4]。但由于MS-222的渔用药理学研究滞后,缺乏相关研究资料,所以其在水产业中的应用存在较大的盲目性,误用、滥用现象极为普遍,从而使药物使用效果难以保证;更为甚者,药物残留导致水产食品安全问题[5]。
当前,水产品药物残留和食品安全问题日益引起全世界的广泛关注,往往形成我国水产品出口创汇过程中的绿色贸易壁垒,对国内水产食品安全保障也造成巨大阻力[6]。鉴于MS-222在水产品中的应用越来越广泛,因此,虹鳟养殖生产实践中,必须严格执行MS-222休药期,要科学用药,提高虹鳟商品鱼的产品质量,从而提高经济效益和产品竞争力。这些工作的前提是建立MS-222在动物体内残留检测的标准方法,从而形成完备的药效学、药代动力学资料。
目前,国内外对MS-222在水产动物体内残留检测方法均有研究[5,7-9],但尚没有虹鳟体内MS-222残留检测方法。因此,尽快建立MS-222的代谢和残留检测方法非常必要。
本文研究了虹鳟肌肉组织中MS-222残留检测的高效液相色谱-紫外(HPLC-UV)检测方法,旨在建立更加简便、快速、灵敏和实用的检测方法,为进一步研究MS-222在虹鳟体内的残留及其代谢规律提供技术支持。
1 材料与方法
1.1 仪器
福立FL2200高效液相色谱仪,浙江福立分析仪器有限公司。CP214型电子分析天平,奥豪斯仪器(上海)有限公司;TGL-16M高速冷冻离心机,长沙湘仪离心机仪器有限公司。XH-B型旋涡混合器,江苏康健医疗用品有限公司。YQ-3型组织匀浆机,常州国华电器有限公司。KQ5200E型超声波洗涤仪,昆山市超声仪器有限公司。RE-52C型旋转蒸发仪,金坛医疗仪器厂。SHB-III型台式循环水多用真空泵,郑州长城科工贸有限公司。Eppendorf微量可调移液器,德国EPPENDORF公司。Alumina-B碱性氧化铝固相萃取柱(规格:500 mg/3 ml),上海歇阳生物科技有限公司。
1.2 试剂
对照品:MS-222(含量>99.5%),Sigma公司。水:水为符合GB/T 6682规定的二级水;甲醇、乙腈、乙酸为色谱纯,正己烷、正丙醇、无水硫酸钠为分析纯,天津市富宇精细化工有限公司。
1.3 溶液配制
1.3.1 MS-222标准液配制 准确称取MS-222标准品0.10 g置于100 ml容量瓶中,用甲醇溶解并定容,在旋涡混合器上混匀5 min,制成质量浓度为1.0 mg/ml MS-222标准储备液。
1.3.2 Mcllvaine缓冲液配制 Mcllvaine缓冲液由563 ml的0.1 mol/L柠檬酸溶液和437 ml的0.2 mol/L的磷酸氢二钠溶液混合所制。用分析天平称取21.014 g柠檬酸于烧杯中并加水溶解,定容至1 000 ml制得0.1 mol/L柠檬酸溶液;称取35.814 g磷酸氢二钠于烧杯中并加水溶解,定容至500 ml制得0.2 mol/L的磷酸氢二钠溶液。
1.4 样品采集及处理
1.4.1 样品采集 沿着虹鳟背脊取肌肉,去皮后用组织捣碎匀浆机打成肉糜,冷冻备用。
1.4.2 样品处理 称取2.0 g均质后的虹鳟肌肉组织置于50 ml具塞离心管中,加入20 ml体积比为1∶1的Mcllvaine缓冲液(pH=4.4)与甲醇的混合提取液,涡旋震荡5 min使之充分混合。在30 ℃条件下,超声提取20 min后,以3 000 r/min的速度离心8 min,离心后移取上清液至玻璃试管中(重复2次)。随后向50 ml离心管中再加入20 ml体积比1∶1的Mcllvaine缓冲液(pH=4.4)与甲醇的混合提取液,重复提取1次,合并两次提取的上清液。将两次的上清液在50 ℃水浴下旋转减压蒸发至近干,蒸干后加入10 mlMcllvaine缓冲液(pH=4.4)将残渣溶解,溶解液经化学分析定性滤纸过滤后过C18固相萃取柱进行纯化。萃取柱分别先后以3 ml甲醇和3 ml Mcllvaine缓冲液(pH=4.4)进行激活,将过滤后的残渣溶解液转移到其中,然后用2 ml 7.5%的甲醇溶液淋洗,抽至近干后,用2 ml甲醇和1%乙酸溶液的混合液(体积比为1∶1)进行洗脱。洗脱液收集5 ml于离心管中,过0.45 μm微孔滤膜后用甲醇与1%乙酸的混合溶液定容到2 ml容量瓶中,待测。
1.5 色谱条件
安捷伦C18柱(4.6 mm×250 mm,5 μm);进样量:50 μl;流动相:甲醇∶水∶乙酸=6 5 ∶3 5 ∶1(等梯度洗脱);流动相速度:0.6 ml/min;柱温:35 ℃;检测波长:223 nm(紫外线检测)。
1.6 绘制标准曲线
用甲醇将MS-222标准储备液稀释,分别在空白肌肉样品中按25 μg/kg、50 μg/kg、100 μg/kg、200 μg/kg、400 μg/kg、800 μg/kg进行添加,按照1.4、1.5步骤测定,记录峰面积,以MS-222色谱图峰面积为纵坐标、MS-222浓度为横坐标绘制标准曲线。
1.7 方法学考察
1.7.1 灵敏度 将逐步稀释的MS-222对照品加入空白样品后上机测定,以信噪比(S/N)=3时的样品浓度为最低检测限。
1.7.2 精密度 标准储备液重复上机测定6次,计算相对标准偏差RSD。
1.7.3 回收率和变异系数 取空白虹鳟肌肉样品6份,分别准确加入不同浓度的MS-222,之后按上文样品处理方法和色谱条件进行测定,计算加标回收率和变异系数。
2 结果与分析
2.1 色谱图
按1.5步骤对MS-222标准品和加标后的空白虹鳟肌肉样品进行分析,结果见图1。由图1可知,MS-222的HPLC出峰时间为6.1 min左右,目标峰分离良好、峰形尖锐、对称,灵敏度高。
2.2 线性范围和灵敏度
在每个空白肌肉样品中分别添加25 μg/kg、50 μg/kg、100 μg/kg、200 μg/kg、400 μg/kg、800 μg/kg的MS-222,每个浓度设置3个重复。本研究中MS-222的线性范围为25~800 μg/kg。在此线性范围内,y=3.12×104x,相关系数为0.999 8,线性关系良好,定量的准确性高。将MS-222对照品准确加入空白样品后上机测定,依据信噪比(S/N)测得检测限为20 μg/kg。
2.3 精密度
虹鳟肌肉组织中添加不同浓度MS-222的HPLC-UV检测方法精密度见表1。由表1可知,本研究的方法精密度在2.63%~4.74%之间,说明样品前处理方法得当,样品质量较为稳定。
2.4 回收率与变异系数
虹鳟肌肉组织中添加不同浓度MS-222的回收率和变异系数见表2。结果显示:所有加标浓度组的MS-222回收率均>88%,批内变异系数<1.2%,批间变异系数均<5%。结果表明该方法的重复性和重现性好。
3 讨论
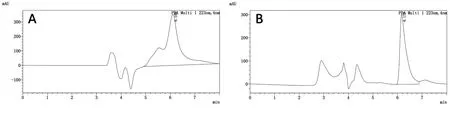
图1 MS-222标准品(A)和空白虹鳟肌肉加标(B)的HPLC-UV色谱图

表1 虹鳟肌肉组织中添加MS-222检测方法的精密度
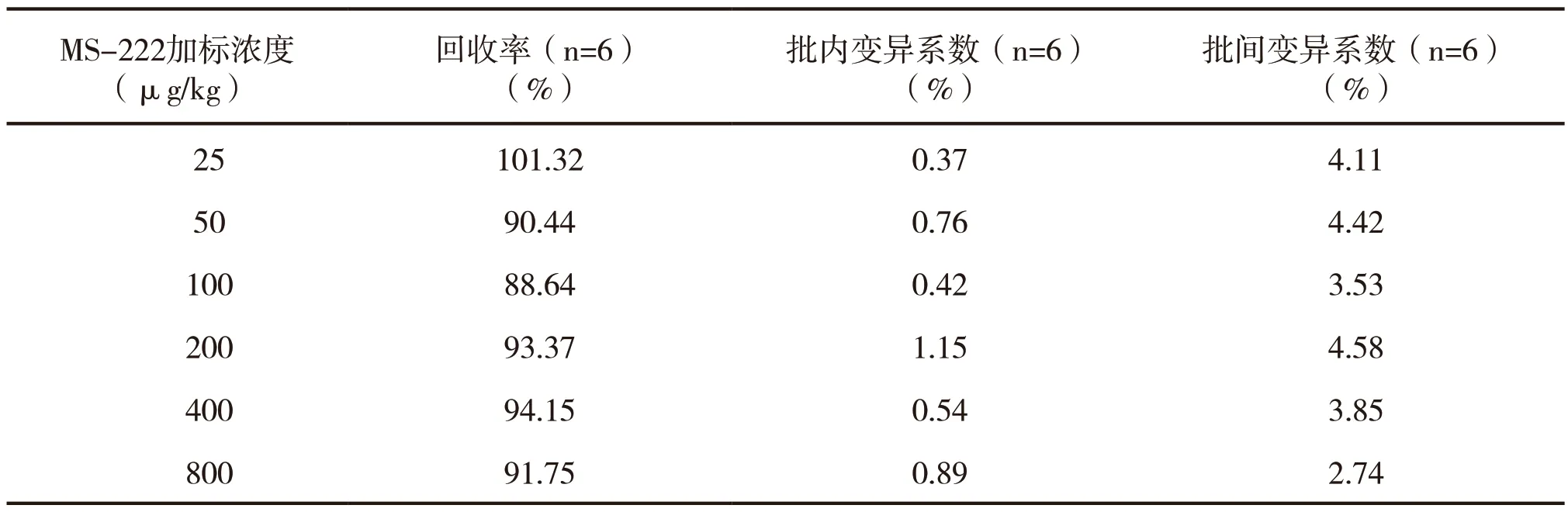
表2 虹鳟肌肉组织中添加MS-222的检测回收率和变异系数
MS-222为白色晶状粉末,其水溶性好,是美国FDA批准的唯一可用于水产品的渔用麻醉剂。MS-222具有良好的镇静安定作用,在活鱼麻醉运输中可提高鱼体的存活率以及上市鲜度[10]。随着人们物质生活水平的不断提高,其对动物源性食品的品质和食品安全问题也越来越关注。然而,对于处在商品流通环节的渔用麻醉剂的规范使用和药物残留问题,目前关注度尚有不足。MS-222的使用剂量往往取决于水产动物的种类、年龄、规格以及水体温度等诸多因素,一般介于25~100 mg/L[11-12]。而生产实践中,销售商往往仅凭借经验掌握MS-222的用量。此外,有研究显示MS-222主要蓄积于鱼体的肝脏和脾脏等部位,在肌肉中的残留量较低,但美国FDA依旧规定MS-222应用于养殖鱼类,需有21 d的休药期[12]。目前我国尚未建立有关MS-222的规范使用和残留限量标准,很多商家出于短期利益考量,并未对相关的商品鱼进行休药暂养,可能存在麻醉剂残留的食品安全风险[5]。因此,尽快建立基于MS-222的代谢和残留检测方法的渔用麻醉剂使用和限量标准迫在眉睫。
MS-222是一种极性化合物,依据相似相溶原理,一般多选用极性较强的提取液,如极性有机溶剂、缓冲溶液/水与有机溶剂的混合溶液等。常见的MS-222提取液有水、甲醇∶水(1∶1)、乙腈∶水(1∶1)、乙酸-乙酸钠缓冲液等[13]。本研究参考已有文献报道,选用Mcllvaine缓冲液(pH=4.4)与甲醇的混合提取液。为了提高MS-222的回收率,采用匀浆和超声波处理相结合的方法,且虹鳟肌肉组织匀浆后超声提取两次。
虹鳟作为典型的冷水性鱼类,肌肉成分复杂,富含油脂[14]。这对于用于HPLC分析的肌肉组织样品制备造成了一定程度的不利影响,如果样品处理不当,易产生过多杂质峰,掩蔽目标峰。因此,样品前处理中的纯化步骤尤为重要。在预试验阶段,本研究对比了C18、C8、苯基、氰基等固相萃取柱的样品纯化效果,最终采用C18萃取柱用进行样品纯化。
本研究中的HPLC分析采用的是C18柱分离,馏分使用223 nm波长的紫外线进行检测,最终计算得到检测限为20 μg/kg。结合文献报道[5,15],紫外检测器对于低浓度样品,存在基质对定性、定量结果影响大的问题,方法的灵敏度尚有提升空间。关于色谱分析过程中的柱温,预实验阶段分别在35 ℃和50 ℃下对MS-222对照品溶液进行HPLC-UV检测,结果显示35 ℃时目标峰的峰型较50 ℃时尖锐,考察保留时间、目标峰与杂质峰的分离程度等方面,两个温度点无显著差异。考虑节能、色谱柱寿命等因素,本研究中选35 ℃作为液相色谱仪的检测温度。参考Scherpenisse[7]、朱敏[10]和黎智广[15]等的研究,本研究中先后采用甲醇∶水∶乙酸=65∶35∶1(流动相1)、0.5%甲酸∶乙腈=60∶40(流动相2)、甲醇∶1%乙酸=75∶25(流动相3)和三种流动相对50.0 μg/ml的MS-222标准品溶液进行了等梯度洗脱。实验结果显示,使用流动相1洗脱所得峰形相对较好,基线平且低,目标峰出峰时间在6.1~6.9 min之间,且在此时间内基本无杂质峰。与已有相关报道的研究结果相比[16-17],该流动相在一定程度上缩短了目标峰的保留时间,且检测加标样品时目标峰分离更好。因而,将甲醇∶水∶乙酸=65∶35∶1的洗脱方式作为最终流动相洗脱梯度。
4 结论
MS-222在虹鳟肌肉中的HPLC-UV残留检测方法具有操作便捷、提取率高、重复性和重现性好等优点,具备良好的检测特异性和精密度,加标回收率>88%,批内变异系数<1.2%,批间变异系数均<5%,方法的重复性和重现性好,满足一般MS-222残留分析的需要,可为进一步研究MS-222在虹鳟体内的残留及其代谢规律提供技术支持。
