碱、盐存在下添加小麦球蛋白对面条加工品质的影响及其机制探讨
2022-03-16张丽丽关二旗李萌萌
张丽丽,关二旗,李萌萌,卞 科
河南工业大学 粮油食品学院,河南 郑州 450001
面条作为东方传统主食的重要组成部分,一直以来广受欢迎。为了提高食用品质和风味,通常在面条中加入盐(NaCl)或碱(Na2CO3或Na2CO3、K2CO3的混合物),也就是俗称的白盐面条和黄碱面条[1]。许多研究认为,盐和碱主要通过影响小麦蛋白赋予面条不同的品质特性[2-3]。根据奥斯本分类,小麦蛋白主要分为两大类,包括面筋蛋白和非面筋蛋白。以往人们关于小麦蛋白与面制品加工关系的研究主要集中于面筋蛋白,然而,在小麦面团的复杂体系中,仅仅面筋蛋白并不能完全解释加工质量[4]。对非面筋蛋白(球蛋白和白蛋白)的结构和功能特性进行研究是必要的[5],对于更好地解释面制品质量的变化至关重要,也有助于全面理解小麦蛋白质与面粉加工之间的关系,有利于提高小麦加工质量[6]。
小麦球蛋白,大部分是单体蛋白并且是具有代谢活性的酶类。和面筋蛋白相似,球蛋白含有丰富的自由巯基和活性二硫键,能够通过SH/SS交换反应或者SH氧化发生聚合[7]。值得注意的是,在小麦胚乳中含有一类聚合球蛋白,被称为类豆球蛋白,具有一定的贮藏功能,并且能够通过二硫键形成多聚体[8]。Shomer等[5]研究认为加热能促使球蛋白固化并作为面包成分间的黏合剂。Wang等[9]认为,在面团混合和加热处理过程中,一些球蛋白分子会与面团基质发生强烈的相互作用,或与面筋分子形成二硫键。Lambrecht等[10]研究认为小麦蛋白在加热诱导下相互聚合,其中球蛋白在蛋白质网络的形成中起着积极的共蛋白作用。添加小麦球蛋白能够提高面团和面条制品的品质, 并且球蛋白能够与面筋蛋白相互作用,参与面筋蛋白网络的形成[6]。这些结果表明,小麦球蛋白在面制品加工过程中的结构和功能特性不容忽视。
Terada等[11]将球蛋白和面筋蛋白经过“Kansui”处理并进行电泳分析发现,球蛋白条带在碱性条件下发生聚合,而面筋蛋白条带没有明显的变化,所以作者推测球蛋白聚合可能是“Kansui”(Na2CO3和K2CO3的混合物)引起面团流变特性以及面条品质变化的主要原因。然而,目前并没有关于碱诱导下球蛋白对面团、面条加工品质影响的研究。此外,关于中性盐离子对小麦球蛋白的聚集影响还没有相关报道,是否会进一步影响面条加工品质也不清楚。
基于团队之前的研究,为进一步挖掘小麦球蛋白在面粉加工中的功能和结构特性,并从球蛋白的角度解释碱、盐对面条制品的作用机制,丰富小麦蛋白与面制品加工关系的学术内容,作者研究了在碱(Na2CO3)和盐(NaCl)存在下添加球蛋白对面条制品以及蛋白网络分子结构的影响。
1 材料与方法
1.1 材料与试剂
QL2122小麦:河南省农业科学院。制粉后水分和蛋白质含量分别为12.5%和13.2%。
氯化钠、碳酸钠、硫酸铵、乙二胺四乙酸四钠(EDTA)、三氯乙酸(TCA)、溴化钾(KBr)、醋酸:天津市科密欧化学试剂有限公司;十二烷基硫酸钠(SDS)、十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳制备试剂盒、8-苯胺萘磺-1-酸盐(ANS)、5,5-二硫代双(2-硝基苯甲酸)(DTNB)、二硫苏糖醇(DTT):北京索莱宝科技有限公司。
1.2 仪器与设备
MLU-202实验磨粉机:瑞士布勒仪器有限公司;5810R高速离心机:德国Eppendorf仪器有限公司;JHMZ-200针式搅拌机、JMTD-168/140半自动压片机:北京东福久恒仪器技术有限公司;TA-XT质构仪:美国Stable Microsystem公司;UV-2000分光光度计:尤尼柯仪器有限公司;Cary Eclipse荧光分光光度计:美国瓦里安公司;Nicolet 6700智能傅里叶红外光谱仪:德国赛默飞世尔科技有限公司。
1.3 方法
1.3.1 球蛋白的提取
采用改良的Osborne方法提取小麦球蛋白[6]。将300 g QL2122小麦粉悬浮在1 500 mL超纯水中,30 ℃下温和搅拌3 h,5 000 r/min离心20 min。除去上清液,对沉淀重复上述步骤。将1 500 mL 0.5 mol/L氯化钠溶液加入沉淀中,在30 ℃下轻轻搅拌。3 h后5 000 r/min离心20 min,上清液中加入固体硫酸铵至半饱和度,搅拌30 min后置于4 ℃冰箱中过夜。收集沉淀,10 000 r/min离心20 min, 然后在4 ℃冰箱中用超纯水透析72 h。经多次超纯水分散沉淀和离心,以确保去除盐离子。将最终收集的沉淀立即用液氮冷冻,用真空冷冻干燥机干燥,研磨并通过100 μm筛网。球蛋白粉密封保存于-20 ℃,备用。
1.3.2 面条的制备
面条配方包括100 g面粉和40 g蒸馏水。基于团队之前的研究,球蛋白添加量(占小麦粉的质量比)为3%。盐(NaCl)添加量为2%,碱(Na2CO3)添加量为0.5%,盐和碱的添加量主要按照制作白盐面条和黄碱面条的常规添加量设定[3]。盐和碱在加入前先溶解在水中。设定3组试验:对照组(空白,3%球蛋白)、加碱组(0.5% Na2CO3, 0.5% Na2CO3+3%球蛋白)和加盐组(2% NaCl, 2% NaCl+3%球蛋白)。
采用针式搅拌机180 r/min搅拌小麦粉7 min,将面团置于塑料袋中,30 ℃静置30 min。然后用半自动压片机进行压片,辊缝依次调整为4.0、3.0、2.0、1.5、1.0 mm,最后切成厚度1.5 mm、宽度2.0 mm的鲜面条。将新鲜面条煮至最佳时间,立即用蒸馏水冷却1 min。面条的测定分为两部分,一部分立即用于面条品质的测定,一部分进行冷冻干燥、研磨,备用。
1.3.3 面条的质构特性测定
根据Guo等[2]的方法采用质构分析仪对面条进行质构特性测定,略有改动。选用HDP/PFS探头进行分析,应变速率0.8 mm/s,应变率75%,压缩间隔时间2 s。试验均在蒸煮后10 min内完成,每组面条重复分析5次。
1.3.4 面条的拉伸特性测定
根据Guo等[2]的方法采用质构分析仪对面条进行拉伸特性测定,略有改动。选用SPR探针进行分析,拉伸距离100 mm,拉伸速率2 mm/s。试验均在蒸煮后10 min内完成,每组面条重复分析5次。
1.3.5 二硫键测定
基于Ai 等[12]的方法,采用Ellman试剂测定二硫键水平,并进行一些修改。测试需要3种缓冲液。缓冲液1 (B1):含有三甘氨酸 (pH 8.0),8 mol/L尿素,1% SDS和4 mmol/L EDTA;缓冲液2 (B2):含有4 mg/mL DTNB;缓冲液3 (B3):与B1相同,但添加2% DTT。将100 mg冻干面条样品倒进10 mL B1中,(25±2) ℃振荡60 min。自由巯基:取5 mL上述混合液,加入0.4 mL B2,25 ℃反应30 min,10 000 r/min离心10 min,随后在412 nm处测定吸光度。总自由巯基:将100 mg冻干面条样品倒进10 mL B3中,(25±2) ℃振荡60 min。然后取2 mL混合液,加入10 mL TCA,振荡1 h。将混合物以10 000 r/min离心10 min,加入TCA洗涤沉淀物2次,并在沉淀物中加入5 mL B1,加入0.4 mL B2后静置30 min。收集上清液,在412 nm处测定吸光度,对照组为B1。所有样本分为3组,结果取平均值。
CSH=73.53×A412×D/C,
式中:CSH为自由巯基或总自由巯基含量,μmol/g;C为样品的质量浓度,mg/mL;D为稀释因子;73.53是由106/13 600 (13 600为Ellman试剂摩尔吸收率)衍生而来。
CSS=(N2-N1)/2,
式中:CSS为二硫键含量,μmol/g;N1为自由巯基含量,μmol/g;N2为二硫键还原后样品总自由巯基的含量,μmol/g。
1.3.6 傅里叶变换红外光谱(FT-IR)分析
利用傅里叶红外光谱进行二级结构的分析。将预干燥KBr与冻干面条样品(2 mg)在红外光灯下于玛瑙研钵中充分研磨,然后压成薄片。在400~4 000 cm-1范围内扫描64次,分辨率4 cm-1。蛋白质的二级结构主要对应于酰胺I区的不同波数范围:α-螺旋、β-折叠、β-转角和随机线圈的波段分别位于1 652~1 660 cm-1、1 605~1 640 cm-1、1 660~1 700 cm-1和1 644~1 652 cm-1[6]。
1.3.7 表面疏水性测定
表面疏水性的测定参照Han 等[13]的方法并稍加修改。将冻干面条样品溶于20 mL 0.5 mol/L醋酸溶液中,20 ℃溶解2 h, 10 000 r/min离心15 min后将所有样品上清液稀释至一系列浓度。将含有8 mmol/L的0.1 mL ANS溶液加入10 mL样品溶液中,在黑暗中孵育20 min。在激发波长390 nm下测试荧光强度,发射波长470 nm,狭缝宽度5 nm。以荧光强度为纵坐标,蛋白质浓度为横坐标作图,借助最小二乘法对曲线进行拟合,将曲线的初始斜率定义为被检测样品的表面疏水性。每个测定都进行3次。
1.4 数据统计与分析
试验结果用平均值±标准差表示。采用SPSS 16.0软件进行单因素方差分析,用Duncan检验比较组间差异具有统计学意义(P<0.05),用Origin 8.5软件制图。
2 结果与分析
2.1 面条质构特性分析
如图1所示,添加0.5% Na2CO3能提高面条的硬度,添加2% NaCl能提高面条的硬度和弹性。在碱、盐存在下,添加球蛋白对面条质构性能的影响如下:在对照组中,单独添加球蛋白后,面条的硬度增大,增加幅度为13.42%,但面条弹性减小;在加碱组中,以单独加碱为对照,在碱存在下添加球蛋白后面条硬度和弹性均显著增加,增加幅度分别为33.71%和8.16%;在加盐组中,与单独加盐比较, 在盐存在下添加球蛋白后面条硬度增加,而弹性无显著变化,总体变化幅度与对照组接近。上述结果表明,在碱存在下,添加球蛋白能够显著增强面条的硬度,且面条的弹性也得到提高;而盐作用下,这种促进作用并不显著。
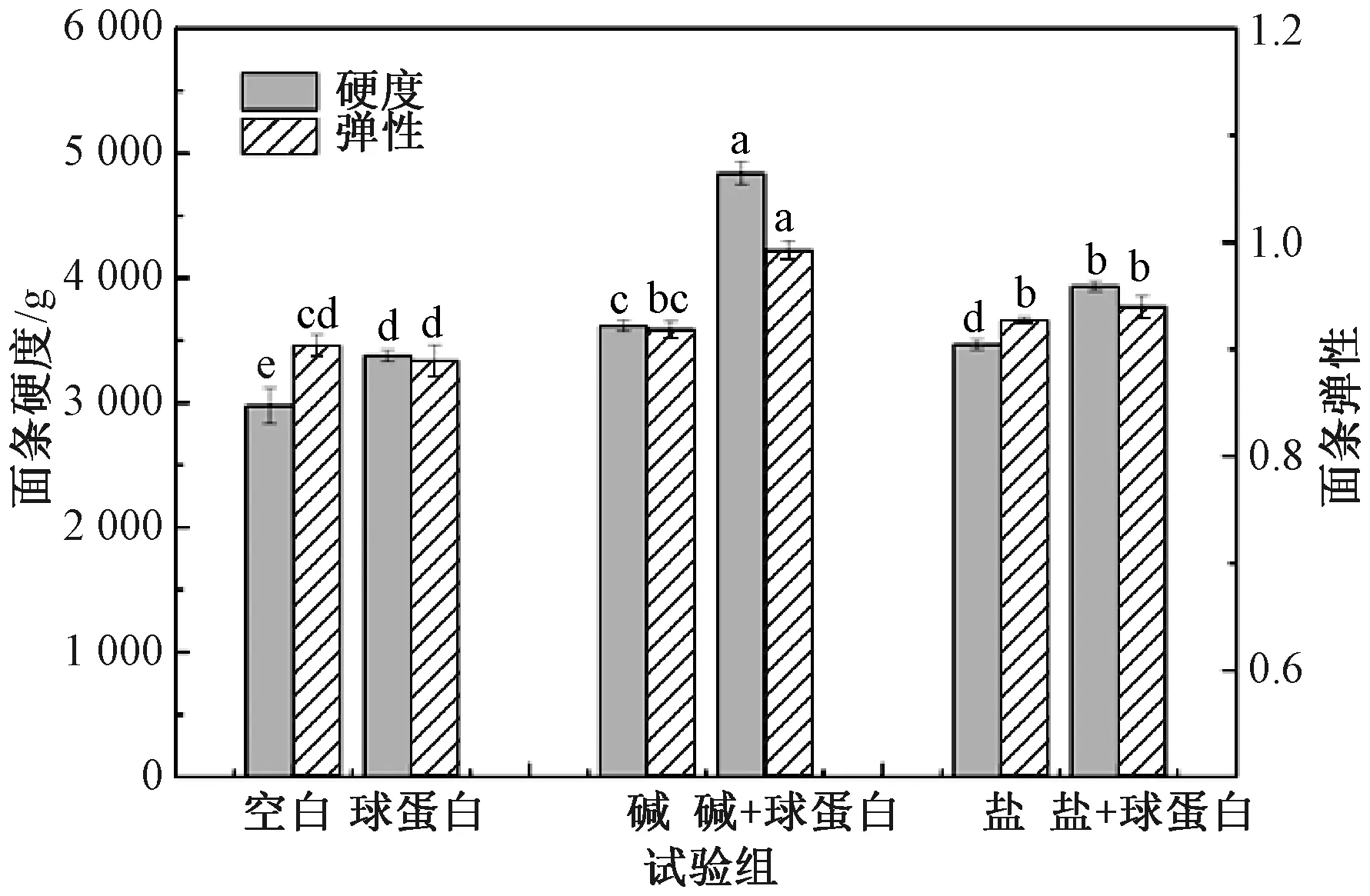
注:不同小写字母表示差异显著(P<0.05)。图2—图5同。
前人研究认为,蛋白网络结构是决定面制品品质的重要因素[13-14]。添加碱可诱导面筋蛋白分子间的非共价相互作用,也可通过SH/SS交换反应或SH氧化引起共价相互作用[15]。然而,球蛋白本身富含自由巯基,在碱性条件下也可发生聚合[11]。因此,可能是碱的存在可以诱导球蛋白的自交联或促进球蛋白通过非共价键/二硫键与面筋蛋白相互作用形成更高的聚合物,从而提高面条的品质。
2.2 面条拉伸特性分析
熟制面条的拉伸性能如图2所示。单独添加0.5% Na2CO3或2% NaCl均能改善面条的最大拉伸阻力和拉伸距离,且添加0.5% Na2CO3时两者的提高程度更大。在碱、盐存在条件下,在对照组中,添加球蛋白后,面条的最大拉伸阻力和拉伸距离分别提高了11.44%和19.29%;在加碱组中,与单独加碱比较,添加球蛋白后最大拉伸阻力和拉伸距离分别升高28.50%和36.33%,升高幅度明显大于对照组,而加盐组仅分别增加10.91%和11.65%。结果表明,在碱存在条件下,球蛋白对面条拉伸特性的改善显著增强,但盐的存在没有明显促进作用,这与面条质构特性的总体变化较一致。
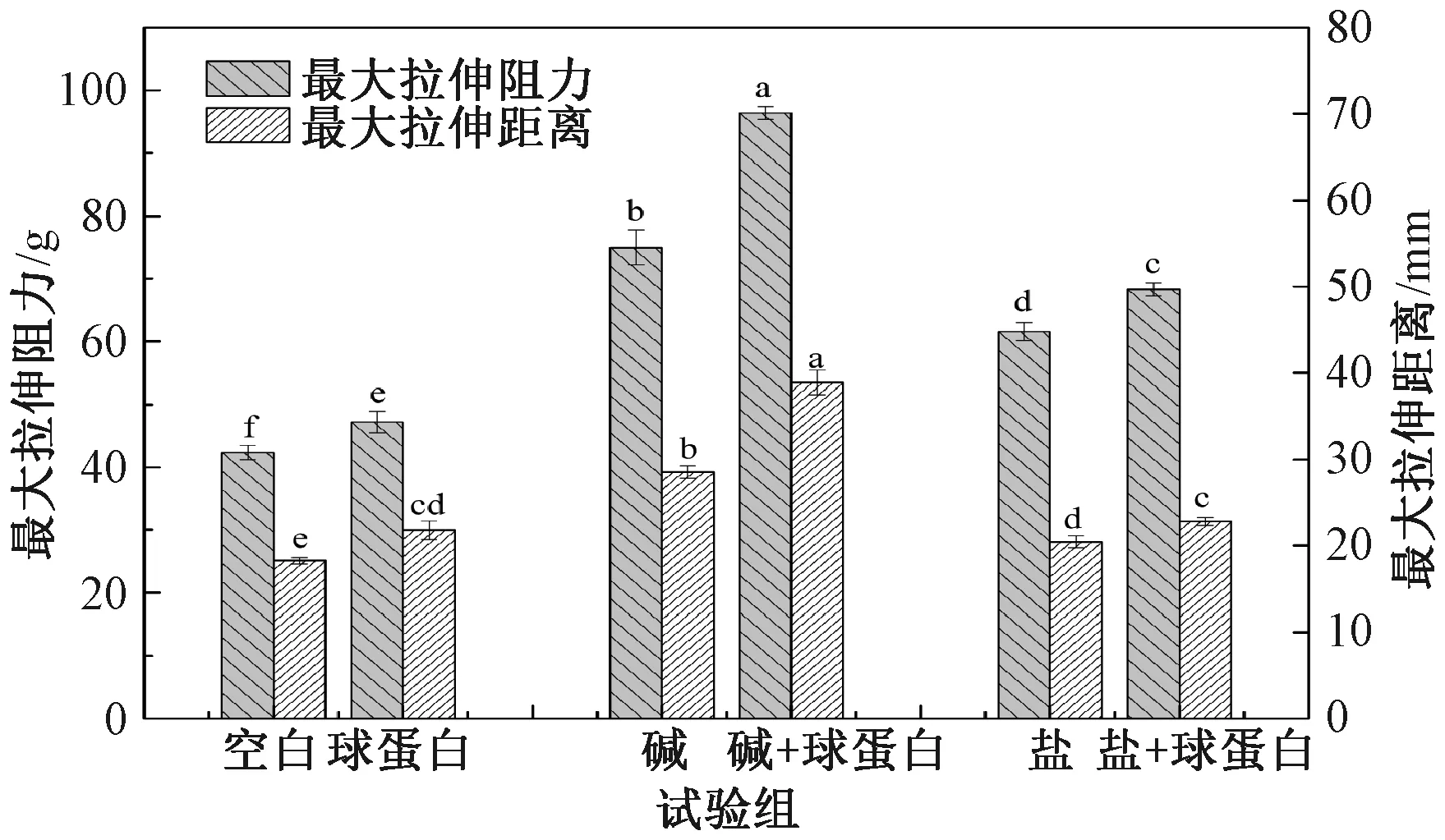
图2 碱、盐存在下添加球蛋白对面条最大拉伸阻力和拉伸距离的影响Fig.2 Effect of globulin addition on the maximum tensile resistance and distance of noodles in the presence of alkali and salt
Rombouts等[15]比较了在添加碱和盐的条件下面团和熟制面条的面筋聚合行为,发现添加碱显著促进了熟制面条的蛋白质交联,而添加盐则降低了蛋白质交联。结合团队之前的研究发现,球蛋白能够参与面筋蛋白网络形成,主要通过面团中的非共价键与面筋蛋白相互作用,形成面筋蛋白-球蛋白复合体[6]。如前所述,在碱、盐条件下添加球蛋白对面条品质的不同影响也可能主要是由于碱、盐诱导球蛋白与面筋蛋白的相互作用行为不同所导致。
2.3 二硫键分析
在面团混合和烹饪过程中,二硫键在蛋白质交联中起着关键作用[16-17]。面条中二硫键的变化如图3所示。在对照组和加盐组中,添加球蛋白后二硫键的含量增加,增加幅度分别为12.73%和13.15%,基于Zhang等[6]的报道,添加球蛋白促进了煮制面条的蛋白分子聚集,说明球蛋白诱导了蒸煮过程中以二硫键形式的蛋白质聚集,而盐对这一过程的促进作用并不明显。在碱添加组中,添加球蛋白后二硫键含量增加了16.52%,增加幅度明显大于对照组。由此说明,在煮熟面条中,球蛋白和碱的协同作用加速了面筋蛋白-球蛋白复合体中二硫键的共价交联。面筋蛋白主要由醇溶蛋白和麦谷蛋白组成,醇溶蛋白通过分子间非共价以及链内二硫键相互作用;而麦谷蛋白含有丰富的自由巯基,由低分子量和高分子量麦谷蛋白亚基通过链间二硫键不断形成大分子聚合体[13, 18]。与麦谷蛋白相似,球蛋白也含有丰富的自由巯基,可通过链间二硫键形成高聚体[7]。由此进一步推测,在煮制面条中,球蛋白分子很可能与面筋蛋白中的麦谷蛋白分子进行二硫键交联。

图3 碱、盐存在下添加球蛋白对面条蛋白二硫键含量的影响Fig.3 Effect of globulin addition on the content of disulfide bonds of noodle protein in the presence of alkali and salt
2.4 二级结构分析
在碱、盐存在下,球蛋白对面条蛋白二级结构的影响如图4所示。在对照组中,仅添加球蛋白时,面条中面筋蛋白复合体的α-螺旋和β-折叠含量均减小,而β-转角含量增加。在碱添加组中,β-折叠含量在添加球蛋白后显著升高(P<0.05);同时,α-螺旋和β-转角含量显著降低(P<0.05)。说明在碱诱导下,添加球蛋白促进了蛋白质构象由α-螺旋、β-转角转化为更高水平的β-折叠。在盐添加组中,添加球蛋白后α-螺旋和无规卷曲含量有所减小,而β-折叠和β-转角含量有所增加,但α-螺旋减小的程度和β-折叠增加的程度均明显小于加碱组。维持蛋白质二级结构的主要作用力是氢键。研究表明,β-折叠表现出蛋白质分子之间强烈的氢键相互作用[12, 19]。在Belton[20]报告的模型中,氢键有助于在蛋白质水合过程中形成“train”结构,从而促进蛋白质的聚集。此外,α-螺旋结构数量的减少与蛋白质三维网络结构的形成相关[12]。因此,与单独添加球蛋白相比,在碱和盐的存在下,添加球蛋白进一步促进了蛋白质之间的聚集,形成更紧密的蛋白质网络结构,特别是在碱存在的情况下。
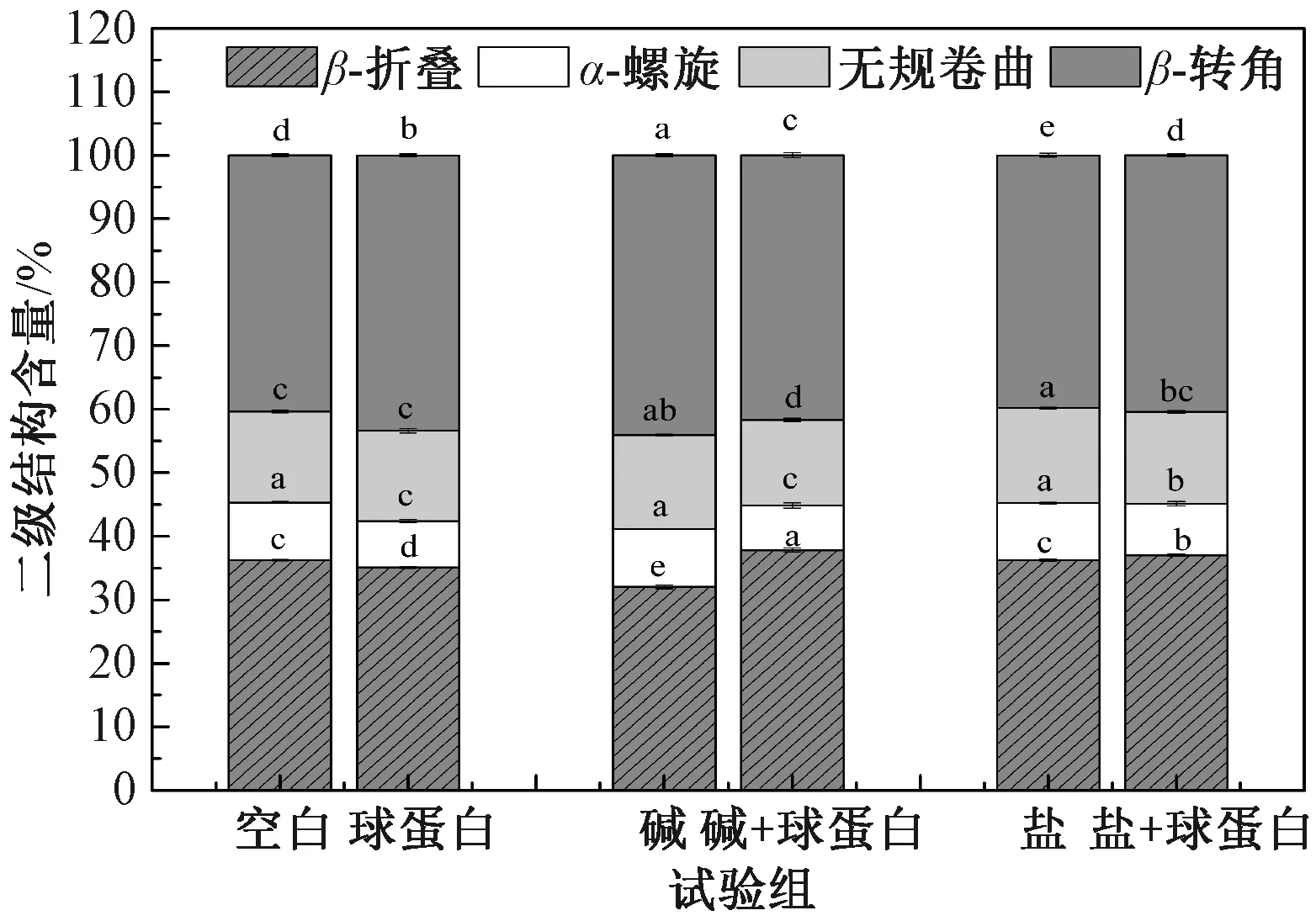
图4 碱、盐存在下添加球蛋白对面条蛋白二级结构的影响Fig.4 Effect of globulin addition on the secondary structure of noodle protein in the presence of alkali and salt
2.5 表面疏水性分析
ANS荧光探针可以测量蛋白质的表面疏水性,反映不同加工条件对蛋白质分子聚集和折叠的影响[13, 21]。添加球蛋白后面条蛋白表面疏水性变化如图5所示。单独添加球蛋白,表面疏水性下降,表明更多的疏水基团包埋于蛋白分子间,球蛋白与面筋蛋白分子间的疏水作用增强。在加碱组中,单独添加碱能明显降低面条蛋白的表面疏水性,这可能是因为碱诱导了明显的蛋白分子聚集,使得大量的疏水基团被包埋;除此之外,碱引起的静电斥力变化也会影响蛋白质的表面疏水性分布[12, 22]。而与单独加碱比较,在碱存在下添加球蛋白后,表面疏水性虽有所下降,但下降幅度明显小于对照组。说明在碱性条件下,球蛋白与面筋蛋白之间的疏水作用进一步减弱。基于Yu等[23, 12]的分析,这可能归因于碱诱导的球蛋白和面筋蛋白复合体系的局部变性和展开,使较少的疏水基团嵌入球蛋白与面筋蛋白分子之间。在加盐组中,单独添加盐对面条蛋白的疏水性并没有显著影响;与单独加盐比较,在盐存在下添加球蛋白后,表面疏水性增加,表明在盐存在下球蛋白与面筋蛋白之间的疏水作用明显减弱。

图5 碱、盐存在下添加球蛋白对面条蛋白表面疏水性的影响Fig.5 Effect of globulin addition on the surface hydrophobicity of noodle protein in the presence of alkali and salt
3 结论
研究了在碱、盐存在下添加小麦球蛋白对面条加工品质的影响,在碱性条件下,添加球蛋白对面条制品的硬度和拉伸距离的提高显著增强,除此之外,面条的弹性也显著提高;而在盐存在下,这种增强效果不如碱条件下显著。通过进一步分析熟制面条中蛋白间的相互作用发现:添加球蛋白后,蛋白间的二硫键和疏水作用增强;在盐存在条件下,添加球蛋白后疏水相互作用进一步减弱,而氢键相互作用得到改善;在碱存在条件下,添加球蛋白后疏水性也有所减弱,而氢键相互作用进一步显著增强,除此之外,球蛋白与面筋蛋白之间发生了明显的二硫键共价作用,这进一步说明碱诱导下,球蛋白与面筋蛋白间的聚集程度显著增强,而这可能是面条品质大幅提升的主要原因。本研究挖掘了小麦球蛋白在面条加工中的结构和功能特性,并从球蛋白的角度进一步解释了碱、盐在面条制品中的作用机制,展现了小麦球蛋白提升面制品加工品质的潜力。下一步可以对球蛋白进行物理、化学改性,深入探究其对面制品加工品质的影响。
