啶虫脒和噻虫嗪对镇海林蛙蝌蚪抗氧化活性的影响
2022-03-16陈姣姣郑金香陈琳慧耿宝荣
陈姣姣,林 玲,郑金香,陈琳慧,耿宝荣
(福建师范大学生命科学学院,福建 福州 350117)
新烟碱类杀虫剂(Neonicotinoid insecticides)是20世纪后期研发出的一类新型杀虫剂[1],是目前全球范围内最重要的一类杀虫剂[2].其作用机制是作为昆虫中枢神经系统的烟碱型乙酰胆碱受体(nAChRs)的选择性激动剂,阻断受体导致昆虫瘫痪和死亡[3].新烟碱类杀虫剂在植株体内具有较好的内吸活性,对刺吸式口器害虫及其他害虫具有较高的杀虫活性,现已在世界各地广泛使用[4].啶虫脒(Acetamiprid)和噻虫嗪(Thiamethoxin)是继吡虫啉之后研发出的新烟碱类杀虫剂的代表,广泛应用于农田害虫防治中,具有较广的发展空间.新烟碱类杀虫剂对非靶生物有不同程度的影响[4-6],但对两栖动物的影响则少见报道[7-8].
两栖类是农田生态系统的重要组成部分,对农作物病虫害的防治起着重要作用.近半个世纪以来,世界范围的两栖类种群衰退引起了各国学者的广泛关注[9-10].研究表明,环境污染是两栖类种群下降的重要原因之一[11].两栖动物因具有特殊的生物学特征和生态学特征,对外界环境的变化极为敏感,一直被作为生态环境监测的重要指示类群[12];而体内抗氧化活性的变化是常用的监测指标[13].正常情况下,当生物体处于逆境环境下,其抗氧化能力在一定程度上会出现应激提高,抵抗外界干扰以免机体损伤.但高强度或长时间的外界干扰则会抑制生物体的抗氧化能力,降低氧自由基的代谢能力,引起细胞损伤,产生一定的毒性效应[14].
本文利用静态-换水法研究了啶虫脒和噻虫嗪对镇海林蛙(Ranazhenhaiensises)蝌蚪的急性毒性,在此基础上,检测了这两种新烟碱类杀虫剂对镇海林蛙蝌蚪的生理毒性,即对蝌蚪抗氧化系统的毒性效应,包括超氧化物歧化酶(Superoxide dismutase,SOD)活性、总抗氧化能力(Total antioxidative capacity,T-AOC)以及丙二醛(Malondialdehyd,MDA)含量等的影响,旨在了解新烟碱类杀虫剂对两栖动物蝌蚪的生理生态毒性效应,为农田生态系统和野生两栖动物资源的保护提供科学数据.
1 材料和方法
1.1 试验动物和试验试剂
试验动物镇海林蛙蝌蚪采自福州市晋安区寿山乡农田,将采来的卵群置于实验室的水簇箱中孵化与培养,孵化和培养蝌蚪所用的水为曝气48 h以上的自来水,每天换水1次,用蛋黄或鱼饲料喂养开食后的蝌蚪.蛙卵与蝌蚪培养过程中,存活率均达90%以上.实验时选取活动性能好、没有机械损伤的28-30期[15]的个体进行试验.
啶虫脒(有效成分20%,EC)由江苏辉丰农化股份有限公司生产;噻虫嗪(有效成分25%,WDG)由上海悦联化工有限公司生产.考马斯亮兰蛋白测试、SOD测试、T-AOC测试以及MDA含量测试等的试剂盒均购自南京建成生物工程研究所.
1.2 试验方法
1.2.1 急性毒性
在水温为15~20 ℃的实验室条件下,采用静态-换水法[16]进行毒性试验.根据预试验所得到的结果,以农药的有效成分浓度为标准,按20 mg·L-1的等质量浓度间距将啶虫脒和噻虫嗪分别设置7个处理组(啶虫脒:160~280 mg·L-1,噻虫嗪:180~300 mg·L-1),另设空白对照组,每组随机放入蝌蚪8只,试验设置4个平行.试验期间不喂食,试验持续96 h.每24 h更换1次试液,并记录蝌蚪在24、48、72、96 h死亡的数量,及时清理出死亡的个体.
1.2.2 生理毒性
染毒:根据急性毒性试验结果,在保证蝌蚪不死亡的条件下,以农药的有效成分浓度为标准,按20 mg·L-1的等质量浓度间距将啶虫脒和噻虫嗪分别设置5个处理组(20~100 mg·L-1),并设1个空白对照组.每组随机投放25尾蝌蚪,染毒期间不喂食,每24 h更换1次试液.
样品制备:暴露24、48、72、96 h后,分别从各处理组及对照组中随机取出5只蝌蚪(每只蝌蚪均单独处理),经冲洗后用滤纸吸干蝌蚪体表的水分,按质量体积比(1∶9)加入生理盐水和适量石英砂,在冰浴条件下迅速充分研磨、静置,然后取上层液体,制备成10%的组织匀浆,在2 500 r·min-1条件下离心10 min,取上清液测定.
测定方法:采用考马斯亮兰法测定蝌蚪体内的蛋白质含量,SOD活性、T-AOC以及MDA含量按照试剂盒中说明书的步骤进行操作.SOD活性定义为每mg组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个活力单位,以U·mg-1表示;T-AOC单位定义为在37 ℃时,每min每mg组织蛋白使反应体系的吸光度(OD值)每增加0.01时为1个单位,以U·mg-1表示;MDA含量以n mol·mg-1表示.
1.3 数据处理
在急性毒性试验中,利用Excel计算半致死质量浓度(ρLC50).将两种农药的质量浓度与蝌蚪死亡百分率进行线性回归分析,得到毒性回归方程;当死亡率为50%,通过回归方程计算得出24、48、72、96 h-ρLC50,安全质量浓度按公式(ρSC)=0.1×96 h-ρLC50计算而求得[17].在生理毒性试验中,数据以平均值±标准误差表示;在同一暴露时间内,各处理组间及各处理组与对照组间的比较采用SPSS 19.0软件包进行LSD多重比较分析,显著性水平设置为α= 0.05.
2 结果与分析
2.1 急性毒性
经不同质量浓度的啶虫脒和噻虫嗪染毒处理后,镇海林蛙蝌蚪的累积死亡数及死亡率见表1.由表1可见,对照组蝌蚪无死亡,各处理组出现不同数量的蝌蚪死亡.经回归分析表明,两种农药的质量浓度与蝌蚪死亡率呈现显著的线性关系,依据急性毒性的回归方程计算可得,啶虫脒和噻虫嗪对镇海林蛙蝌蚪的96 h-ρLC50分别为215.83 mg·L-1和232.43 mg·L-1,ρSC分别为21.583 mg·L-1和23.243 mg·L-1(表2).
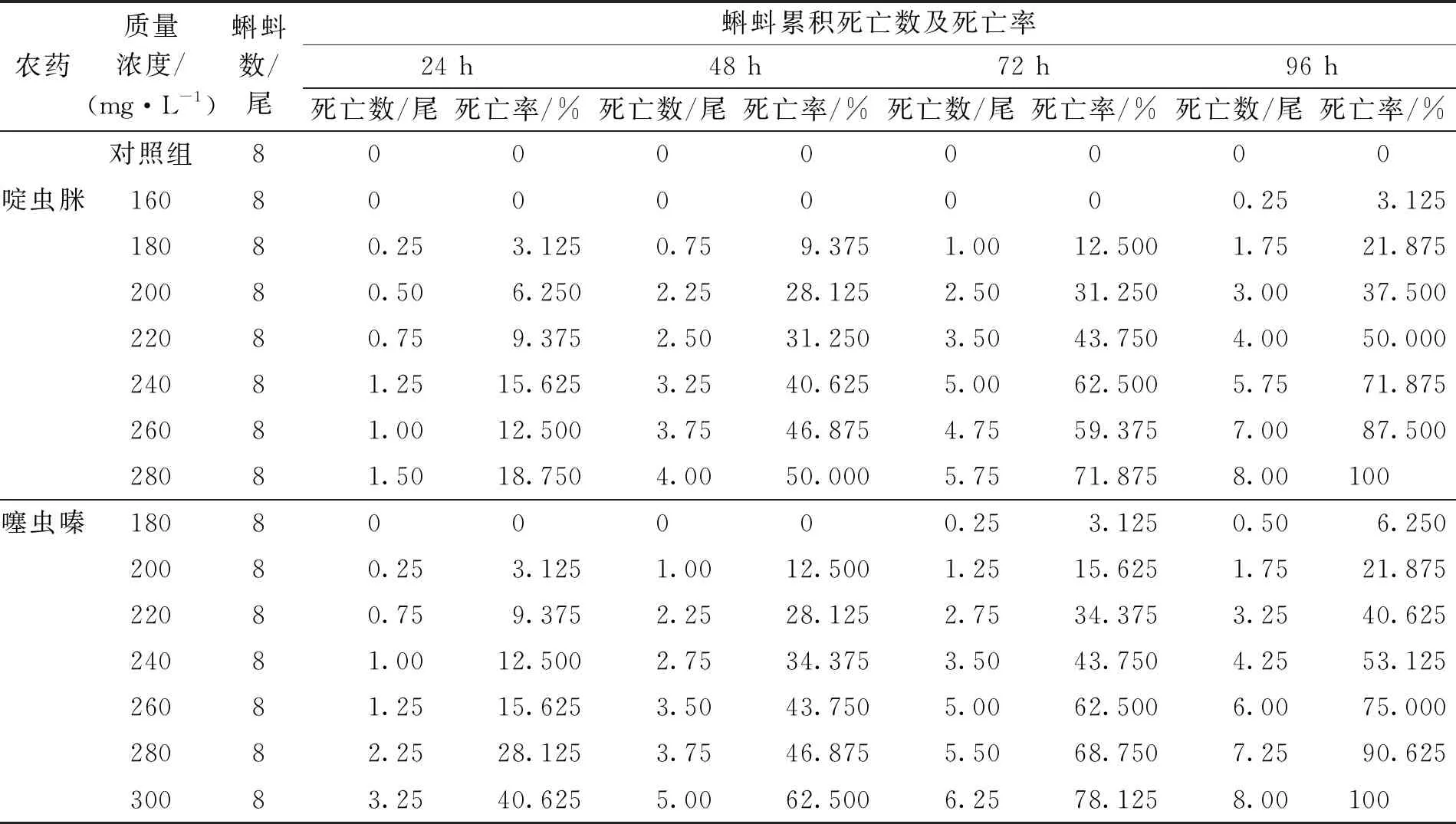
表1 啶虫脒和噻虫嗪处理下镇海林蛙蝌蚪的累积死亡数及死亡率

表2 啶虫脒和噻虫嗪对镇海林蛙蝌蚪毒性影响的回归参数

续表2
2.2 生理毒性
2.2.1 啶虫脒和噻虫嗪对镇海林蛙蝌蚪的SOD活性的影响
经啶虫脒和噻虫嗪暴露48h和96h后,镇海林蛙蝌蚪的SOD活性变化见图1.
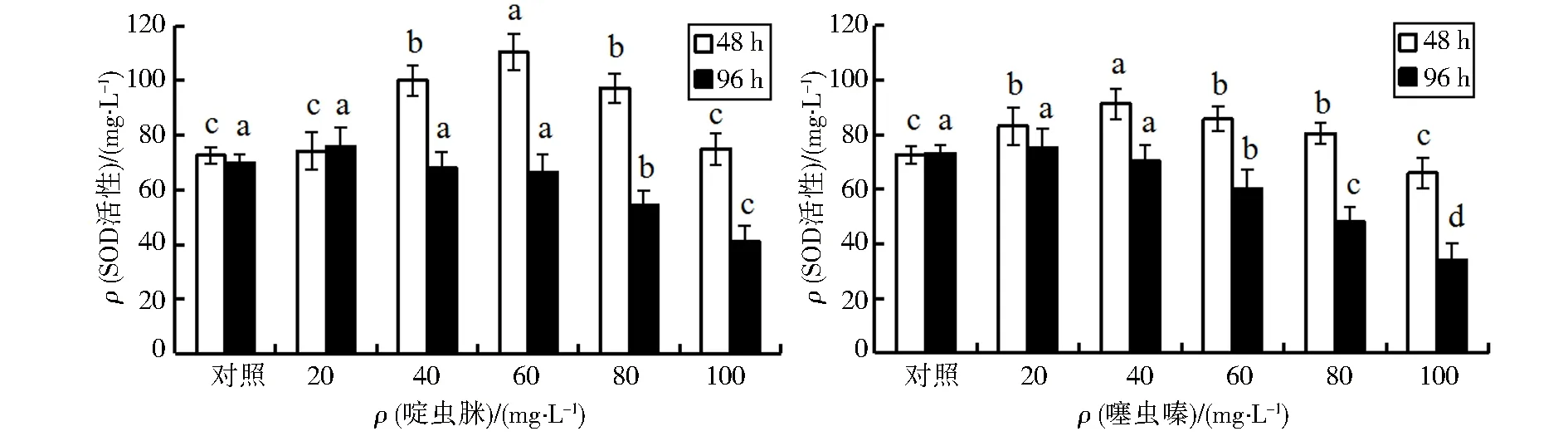
注:同一处理时间中,标注字母不同表示差异有统计学意义,a>b>c>d,P<0.05.下同.
由图1可知,在啶虫脒溶液中暴露48h后,20mg·L-1质量浓度处理组中的镇海林蛙蝌蚪的SOD活性与对照组相比,无统计学差异(P>0.05);而在40、60mg·L-1质量浓度处理组,蝌蚪的SOD活性被诱导而上升,显著高于对照组(P<0.05),峰值出现在60mg·L-1质量浓度组;随着啶虫脒质量浓度的继续增大,蝌蚪的SOD活性逐渐受到抑制而下降,最高质量浓度组(100mg·L-1)蝌蚪的SOD活性降至与对照组相近的水平.暴露96h后,在低中质量浓度处理组中(20、40、60mg·L-1),蝌蚪的SOD活性与对照组相比,无统计学差异(P>0.05);但在高质量浓度处理组中(80、100mg·L-1),蝌蚪的SOD活性则被抑制而下降,显著低于对照组(P<0.05).
在噻虫嗪溶液中暴露48h后,低质量浓度处理组中(20、40mg·L-1),镇海林蛙蝌蚪的SOD活性被诱导而逐渐升高,峰值出现在40mg·L-1质量浓度组;随着噻虫嗪质量浓度的继续加大,蝌蚪的SOD活性被抑制而逐渐下降,最高质量浓度组(100mg·L-1)蝌蚪的SOD活性降至与对照组一致的水平.暴露96h后,低质量浓度处理组(20、40mg·L-1)的SOD活性与对照组无统计学差异(P>0.05),中高质量浓度组的SOD活性被抑制显著低于对照组,最高质量浓度组(100mg·L-1)的SOD活性降至对照组的一半以下.
2.2.2 啶虫脒和噻虫嗪对镇海林蛙蝌蚪的T-AOC的影响
经啶虫脒和噻虫嗪处理48h和96h后,镇海林蛙蝌蚪的T-AOC变化见图2.
由图2可知,在啶虫脒溶液中暴露48h后,最低质量浓度处理组(20mg·L-1)的镇海林蛙蝌蚪的T-AOC与对照组相比,无统计学差异(P>0.05);在40mg·L-1质量浓度处理组,蝌蚪的T-AOC被诱导而上升,显著高于对照组(P<0.05);随着啶虫脒质量浓度的继续增大,蝌蚪的T-AOC逐渐受到抑制而下降,最高质量浓度组(100mg·L-1)蝌蚪的T-AOC降至与对照组相近的水平.暴露96h后,在20mg·L-1质量浓度处理组中,蝌蚪的T-AOC与对照组相比,无统计学差异(P>0.05);但随着啶虫脒质量浓度的增大,蝌蚪的T-AOC则被抑制而下降,最高质量浓度组(100mg·L-1)的T-AOC仅为对照组的40%左右.

图2 啶虫脒和噻虫嗪溶液中镇海林蛙蝌蚪的T-AOC变化
在噻虫嗪溶液中暴露48h后,40mg·L-1质量浓度组的T-AOC被诱导而上升,显著高于对照组(P<0.05);随着噻虫嗪质量浓度的增大,蝌蚪的T-AOC被抑制而逐渐下降,最高质量浓度组(100mg·L-1)的T-AOC显著低于对照组(P<0.05).暴露96h后,低中质量浓度组(20、40、60mg·L-1)的活性与对照组相比,无统计学差异(P>0.05),但高质量浓度组(80、100mg·L-1)则显著低于对照组(P<0.05).
2.2.3 啶虫脒和噻虫嗪对镇海林蛙蝌蚪的MDA含量的影响
由图3可知,在啶虫脒溶液中暴露48h后,在低中质量浓度处理组中(20、40、60mg·L-1),镇海林蛙蝌蚪的MDA含量与对照组无统计学差异(P>0.05),高质量浓度处理组(80、100mg·L-1)中的蝌蚪MDA含量则显著高于对照组(P<0.05).暴露96h后,低质量浓度组(20、40mg·L-1)的MDA含量与对照组相比无统计学差异(P>0.05),中高质量浓度组则高于对照组(P<0.05).

图3 啶虫脒和噻虫嗪溶液中镇海林蛙蝌蚪的MDA含量变化
在噻虫嗪溶液中暴露48h后,低中质量浓度组(20、40、60mg·L-1)的MDA含量与对照组相比无统计学差异(P>0.05),最高质量浓度组(100mg·L-1)的MDA含量则高于对照组(P<0.05).暴露96h后,低质量浓度组(20、40mg·L-1)的MDA含量与对照组相比无统计学差异(P>0.05),中高质量浓度组则显著高于对照组(P<0.05).
由此可知,在啶虫脒和噻虫嗪暴露下,镇海林蛙蝌蚪的SOD活性和T-AOC总体上呈现出基本相同的变化规律,即在短时间内先被诱导而提高,出现应激效应;但随着农药暴露时间的延长,其活性逐渐被抑制而下降,机体的抗氧化能力显著降低.
3 讨论
关于新烟碱类杀虫剂对非靶标生物的急性毒性研究,已有许多报道[2].研究表明,除了对鱼苗毒性为中等级别外,多数新烟碱类杀虫剂对鱼类的急性毒性级别属于低毒性或微毒性[18-19].陈姣姣等[8]发现噻虫嗪对中华蟾蜍(Bufo gargarizans)蝌蚪的急性毒性属低毒级别.本研究表明啶虫脒和噻虫嗪对镇海林蛙蝌蚪的96h-ρLC50分别为215.83mg·L-1和232.43mg·L-1,其毒性级别为低级[20].
SOD是一类可以清除机体内过量超氧自由基的活性蛋白酶,是生物机体内抗氧化酶系中的重要组成部分,SOD活性下降易使机体受氧自由基受损.研究表明,亚致死剂量的吡虫啉、噻虫嗪和烯啶虫胺等新烟碱类杀虫剂短时间内可诱导斑马鱼(Danio rerio)出现氧化应激效应,但长时间的暴露会抑制其活性[21-23].短时间和低质量浓度的噻虫嗪暴露对中华蟾蜍蝌蚪的SOD活性影响不大,但高质量浓度和长时间的暴露则会抑制SOD活性[8].本研究结果表明,较低质量浓度(啶虫脒≤60mg·L-1,噻虫嗪≤40mg·L-1)和较短时间(≤48h)的暴露,镇海林蛙蝌蚪的SOD活性会被诱导而提高,但高质量浓度和长时间的暴露则会抑制蝌蚪的SOD活性,这与前人的研究结果一致.
T-AOC是一项衡量生物有机体抗氧化系统功能状况的综合性指标,可以反映机体清除自由基的能力[24],因其对低浓度的环境污染物较为敏感,故常作为检测和评价环境污染程度的重要生物标志物[25-26].在两栖动物方面,陈姣姣研究了两种新烟碱类杀虫剂对3种两栖类(黑眶蟾蜍Duttaphrynus melanostictus、中华蟾蜍和大树蛙Rhacophorus dennysi)蝌蚪的影响,表明T-AOC的变化趋势是随着药物质量浓度的增加而出现先上升后下降的趋势[27].本研究结果表明,在啶虫脒和噻虫嗪的作用下,镇海林蛙蝌蚪的T-AOC的变化与SOD变化相似,出现先被诱导应激而提高活性,然后受到抑制而降低活性.表明高质量浓度和长时间的暴露对蝌蚪的抗氧化系统有一定的损害作用.
MDA是生物有机体内氧自由基引发的生物膜不饱和脂肪酸过氧化反应的代谢产物,其浓度水平反映了脂质过氧化的程度,即机体细胞受自由基攻击的程度,生物有机体在外界有毒物质作用下,体内MDA含量会积累上升[28].本研究结果表明,在较低质量浓度的啶虫脒和噻虫嗪作用下,机体的抗氧化系统被激活,提高清除氧自由基的能力,MDA含量下降;但随着药物质量浓度的提高和暴露时间的延长,蝌蚪体内抗氧化系统受到损伤,不能及时清除过量的氧自由基,MDA含量则逐渐上升,这与SOD活性和T-AOC的变化是相符的.
综上所述,啶虫脒和噻虫嗪对镇海林蛙蝌蚪的毒性为低级,但两栖动物蝌蚪常栖息于静态的、窄浅的或暂时性水体中,环境污染物容易积累,对蝌蚪仍存在一定的风险性.啶虫脒和噻虫嗪这两种新烟碱类杀虫剂能改变镇海林蛙蝌蚪的抗氧化系统活性,长时间的暴露将对蝌蚪产生不利影响.
