核因子-κB p65和骨桥蛋白在子宫内膜癌组织与细胞中的表达及相关性研究
2022-03-16白治苗刘玉锋郭玉琳
白治苗,刘玉锋,赵 乐,郭玉琳
(榆林市第二医院妇科,陕西 榆林 719000)
子宫内膜癌是围绝经期及绝经后女性常见的三大生殖器恶性肿瘤之一[1-3],主要临床表现为异常阴道流血,治疗主要为手术联合放化疗的综合治疗。近年统计发现其发病率逐年上升,甚至有超过宫颈癌的趋势,对女性身体健康造成了极大危害,因此成为妇科疾病中的主要研究对象。目前该病分子相关发病机制尚不明确,普遍认为其发生是一个复杂、缓慢的过程。由于子宫内膜腺上皮细胞长期并持续地受雌激素刺激,并且缺乏孕激素的反向拮抗,引起子宫内膜腺体增生、迂曲,失去正常形态,最终癌变而形成子宫内膜癌[4-5]。在其发生与发展过程中,可能存在许多癌基因、抑癌基因、错配修复基因及细胞炎症因子等的参与[6-7]。骨桥蛋白(Osteopontin,OPN)是由多种细胞共同分泌的、存在于细胞基质中的一类糖蛋白,其分子结构内含有精氨酸-甘氨酸-天冬氨酸的特殊细胞结合序列[8-9]。有研究[10-11]发现,该特殊序列可通过与其受体整合素结合促进核因子-κB (Nuclear factor kappa B,NF-κB)p65的释放,进而发挥后续生物学效应,该生物学效应主要有免疫调节、促进组织中血管生长、促进损伤后组织修复、调节细胞存活等功能。另有研究[12-14]发现,两者引起的相关因子分泌是导致许多恶性肿瘤如甲状腺癌、肝癌、肺癌、宫颈癌等的重要因素,因此两者有可能是引起子宫内膜腺癌发生的关键。基于此,本研究探讨NF-κB p65和OPN在子宫内膜腺癌组织及细胞中的表达并分析两者的相关性,期望能为该病的靶向治疗提供可靠的理论依据。
1 对象与方法
1.1 研究对象 收集2016年9月至2021年1月于榆林市第二医院妇科因子宫内膜腺癌行全子宫切除术患者35例为子宫内膜腺癌组,其中平均年龄(48.00±3.57)岁;平均体重指数(20.00±2.23 )kg/m2;FIGO分期中,Ⅰa期20例,Ⅰb期10例,Ⅱ期15例。收集同期因术前行诊刮术后经病理检查证实为子宫内膜非典型增生的患者35例为非典型增生内膜组,其中平均年龄(46.00±4.21)岁;平均体重指数(19.50±2.32) kg/m2。收集同期因子宫肌瘤、子宫畸形、不孕症接受手术治疗后经病理检查诊断并排除子宫内膜病变的正常子宫内膜患者35例为正常子宫内膜组,其中平均年龄(43.00±3.86)岁;平均体重指数(20.60±2.46) kg/m2。经过统计学分析,三组患者年龄及体重指数比较差异无统计学意义(均P>0.05)。病例纳入标准:所有患者于术前3个月内均未接受过激素类药物治疗,无生殖道炎症及其他妇科疾病,无慢性肝炎、其他恶性肿瘤等慢性疾病史。所有患者及家属已签署知情同意书。本研究已经通过医院伦理委员会审批。
1.2 主要材料与试剂 子宫内膜癌HEC-1-B细胞购自中国科学院(上海)生物化学和细胞生物学研究所。鼠抗人NF-κB p65(批号:ZA15032,稀释浓度1∶120)购自北京中杉金桥公司;OPN多克隆抗体(批号:716-456-142,稀释浓度1∶100)购自美国Abcam生物公司;DAB显色试剂盒(批号:180704)购自北京中杉生物工程公司;TRIzol、反转录试剂盒、荧光定量试剂购自上海生工生物工程有限公司;RIPA裂解液购自上海碧云天生物技术有限公司。
1.3 研究方法
1.3.1 NF-κB p65及OPN蛋白检测(免疫组化法):所有进入研究的标本均由本院病理科镜下证实,经过福尔马林浸泡过夜,然后经过10%甲醛进行固定后脱水、石蜡包埋,3~4 μm厚度连续切片,65 ℃烤箱烤片12 h后脱蜡,水洗后行抗原修复,一抗滴加过夜,PBS冲洗3次,二抗滴加2 h后滴加显色剂显色,酒精脱水后用二甲苯透明及中性树胶封片,用PBS缓冲液代替一抗作为阴性对照。采用荧光显微镜观察免疫染色结果,两者均以胞质中出现黄色或者棕黄色颗粒视为阳性表达。用Image Pro-Plus 5.0专业图像分析软件进行半定量分析,计算每张切片平均光密度(IOD)值。
1.3.2 细胞培养
1.3.2.1 原代细胞培养:术中刮取正常内膜组织20例于低温箱中带入细胞间,PBS冲洗后置于培养皿中,剪碎至1 mm×1 mm×1 mm的组织块,加入10 ml离心管中,加入5 ml 0.03% Ⅳ胶原酶,在37 ℃条件下反复消化3次,每次8 min。放于离心器中以500 r/min离心30 s。反复离心后显微镜下观察,获得子宫内膜腺上皮细胞,添加细胞培养液混匀,分至80~100 mm培养皿中,放入培养箱中培养,每日更换细胞培养液直至达到90%融合。
1.3.2.2 人子宫内膜癌细胞传代:将从液氮中取出的细胞冻存管投入已经预热(37 ℃)的水浴锅中迅速解冻并不断摇动,1~2 min后取出,用75%酒精擦拭冻存管外壁,带入超净台内。将冻存管内细胞悬液(1 ml)转移到含9 ml培养液的15 ml离心管内混匀,放入离心机中以1000 r/min 离心3~4 min。吸弃上清液,加入10 ml培养液,吹打混匀,制成细胞悬液。将细胞悬液分装入培养瓶内,放入37 ℃含5% CO2的培养箱内,次日换液后继续培养。
1.3.3 NF-κB p65及OPN mRNA相对表达量检测(RT-PCR法):待原代及传代细胞融合至80%~90%,用胰酶消化,收集到离心管中,离心后去上清,PBS冲洗2~3次。将消化后的细胞悬液转移到预冷的DEPC泡过的1.5 ml EP管中,加入TRIzol,然后用枪头吹打混匀5~10 min,室温放置3~5 min,每1 ml TRIzol液加入200 μl氯仿,手摇荡15 s,室温放置2~3 min。置4 ℃离心机中12000 r/min离心15 min,转移上清液至新EP管,加500 μl异丙醇混匀,静置5~10 min。置4 ℃离心机中12000 r/min 离心10 min,可见管底白色沉淀,弃上清,置4 ℃离心机中7500 r/min离心5~10 min。弃上清,室温干燥5~10 min,迅速用20~30 μl DEPC水溶解RNA,混匀后测浓度。cDNA合成:按照试剂盒说明行反转录。PCR反应条件:30 ℃ 10 min,42 ℃ 60 min,85 ℃ 5 min,4 ℃保存。使用Primer Premier 5.0软件设计引物(以β-actin为内参)。基因相对表达量根据2-△△CT计算。
1.3.4 NF-κB p65及OPN蛋白检测(Western blot法):从原代及传代细胞中提取蛋白,制备SDS-PAGE胶后电泳分离蛋白样本,进过转膜,封闭,一抗、二抗孵育(根据说明书,OPN按1∶100稀释)后,于BIO-RAD成像仪中曝光成像并测定各蛋白条带光密度值并计算相应的光密度比值。

2 结 果
2.1 三组患者NF-κB p65蛋白免疫组化染色结果比较 见图1。NF-κB p65蛋白大部分表达在子宫内膜腺上皮细胞的胞质中,少量表达于胞核中,极少量表达于子宫内膜间质细胞中。子宫内膜腺癌组IOD值为1.568±0.236,非典型增生内膜组IOD值为0.628±0.196,正常子宫内膜组IOD值为0.389±0.157,三组患者IOD比较差异有统计学意义(F=5.805,P=0.000)。另外,子宫内膜腺癌组和非典型增生内膜组IOD值高于正常子宫内膜组(t=-5.655、-3.587,均P<0.001),且子宫内膜腺癌组高于非典型增生内膜组(t=-4.988,P<0.001)。
2.2 三组患者OPN蛋白免疫组化染色结果比较 见图2。OPN蛋白大部分表达于子宫内膜腺上皮细胞的胞质中,只有少数表达于间质细胞中。子宫内膜腺癌组IOD值为1.568±0.136,非典型增生内膜组IOD值为0.875±0.158,正常子宫内膜组IOD值为0.458±0.125,三组患者IOD比较差异有统计学意义(F=8.805,P=0.000)。另外,子宫内膜腺癌组和非典型增生内膜组IOD值高于正常子宫内膜组(t=-6.355、-3.687,均P<0.001),且子宫内膜腺癌组高于非典型增生内膜组(t=-4.687,P<0.001)。

A:正常子宫内膜组;B:非典型增生内膜组;C:子宫内膜腺癌组
2.3 两组细胞中NF-κB p65和OPN蛋白与mRNA相对表达水平比较 见表1。Western blot结果显示,NF-κB p65和OPN蛋白在子宫内膜癌HEC-1-B细胞中的相对表达水平明显高于正常内膜细胞(均P<0.05)。RT-PCR结果亦显示,NF-κB p65和OPN mRNA在子宫内膜癌HEC-1-B细胞中的相对表达水平明显高于正常内膜细胞(均P<0.05)。
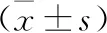
表1 两组细胞中NF-κB p65和OPN蛋白与mRNA相对表达水平比较
2.4 三组患者NF-κB p65和OPN蛋白表达相关性分析 Pearson相关性分析显示,子宫内膜腺癌组和非典型增生内膜组中,NF-κB p65和OPN蛋白表达具有相关性(r=0.78、0.88,均P<0.001),但在正常子宫内膜组中两者蛋白表达无相关性(P>0.05)。
3 讨 论
子宫内膜癌的发生呈逐年上升趋势,其治疗以手术为主,术后放化疗为辅。但因部分患者术后失访,或无法耐受放化疗,故术后复发概率仍高,是妇科医生重点关注的难题之一[15-16]。
近年研究发现,NF-κB p65在许多恶性肿瘤组织的主要细胞中表达明显增强,如恶性程度较高的宫颈癌、前列腺癌、卵巢癌、乳腺癌等[17-19]。研究发现其主要促进细胞过度增殖,抑制细胞凋亡,同时促进恶性组织中的血管生成及转移,进而导致恶性肿瘤的发生与发展。但NF-κB通路在子宫内膜腺癌中的研究甚少,尤其两者因子于细胞分子水平的研究更少。Guo等[20]首次发现OPN与其受体结合后可促进NF-κB p65的释放,进而引起一系列细胞因子释放,最终导致各种恶性肿瘤的发生与发展。
本研究通过免疫组化方法在组织水平上检测正常子宫内膜组织、非典型增生子宫内膜组织及子宫内膜腺癌组织上皮中NF-κB p65与OPN蛋白的表达后,发现两者于子宫内膜癌中的表达明显高于非典型增生的内膜组织,也高于正常子宫内膜组织,差异均具有明显的统计学意义,该结果与既往研究结果[21]相符。本研究于细胞水平通过子宫内膜腺上皮细胞的原代培养检测两者蛋白及mRNA的相对表达水平,通过子宫内膜腺癌细胞传代培养后检测两者蛋白及mRNA的表达,根据结果进行统计学分析,结果均提示两者于子宫内膜癌组织及细胞中的表达增高明显,其差异具有统计学意义。
国内学者于细胞水平抑制NF-κB 后发现子宫内膜腺癌细胞的侵袭性、转移能力明显减弱,且细胞周期明显缩短,进一步说明NF-κB 的高表达可能是导致子宫内膜腺癌的关键因子。国外研究[22]发现OPN与子宫内膜异位症腺上皮细胞的侵袭性、黏附性明显相关。因子宫内膜异位症与子宫内膜癌有着相似的远处转移的生物学性能,因此OPN与子宫内膜癌腺上皮细胞的侵袭性、黏附性是否有着相似的相关性值得深究。如果存在相关性,那么OPN是通过与哪一个受体结合,结合后如何促进NF-κB p65的释放及引起哪些因子的分泌,最终导致子宫内膜癌的发生,有待于后期的实验。例如,子宫内膜癌细胞行质粒导入增强其表达,或行特异性siRNA干扰沉默其表达后检测两者蛋白以及mRNA的表达水平、细胞迁移能力、侵袭性变化等,于子宫内膜腺癌细胞内导入荧光标记,再次行特异增强及减弱两者的表达以进一步证实推测。
综上所述,NF-κB p65和OPN在子宫内膜癌组织及细胞中表达较高,有可能是形成该病的分子通路,为该病的靶向治疗提供了理论依据及重要靶点。但本研究也存在不足之处,如实验样本量过小,后期研究中将尽可能地加大样本量,以增加研究数据及结论的可靠性。
