依普利酮通过靶向微小RNA-192和微小RNA-29a/b/c减轻糖尿病肾病模型大鼠肾损伤机制研究
2022-03-16张渭涛
袁 瑾,赵 灿,张渭涛
(1.西安市第一医院肾内科,陕西 西安 710002;2.西安市第一医院内分泌科,陕西 西安 710002)
糖尿病是一种复杂的代谢性疾病,特点是高血糖和胰岛素功能障碍[1]。糖尿病患者动脉粥样硬化性心血管、外周动脉和脑血管疾病的发生率和风险很高[2]。然而,发生并发症的风险受到许多因素的影响,包括糖尿病持续时间和遗传因素。作为糖尿病的终末阶段,糖尿病肾病(Diabetic nephropathy,DN)是一种进行性肾脏疾病,也是糖尿病患者死亡的主要原因[3]。DN可能导致终末期肾衰竭,其特征是蛋白尿和肾小球滤过率下降,可导致尿毒症[4]。DN的危险因素很多,如尿白蛋白排泄增加、葡萄糖水平升高、血脂异常、肥胖、高龄、肾小球高滤过和遗传因素[5]。DN进展由三个过程组成,即肾小球肥大和高滤过、肾小球和肾小管间质区域炎症以及细胞外基质的积累[6]。肾脏功能和结构的变化是导致终末期肾病的主要因素。因此,有必要更好地了解导致和参与糖尿病并发症的机制,以改进目前对这种多因素和复杂疾病的治疗策略[7-8]。一些研究引入了一个新的内源性小(约22个核苷酸)单链非编码RNA分子家族,称为微小RNA(microRNA,miR),作为仅在人类中的发育调节剂[9]。这些分子通过在转录后抑制基因表达来调节生理和病理过程,并在疾病发展中发挥关键作用。有研究[10]指出,microRNA在DN各个阶段发挥作用,作为早期确定该疾病的生物标志物,强调了microRNA表达水平变化与糖尿病并发症之间的相关性。鉴于microRNA在多种疾病(如糖尿病、肾病、糖尿病肾病等)发病机制中的重要性,研究在DN中发生改变的不同microRNA的表达水平具有非常重要的意义[11]。依普利酮作为醛固酮拮抗剂和抗高血压药物,不仅耐受性良好,还影响尿白蛋白并降低DN患者血压[12]。本研究旨在探讨依普利酮通过靶向miR-192和miR-29a/b/c减轻DN模型大鼠肾损伤的机制,现报告如下。
1 材料与方法
1.1 实验动物 30只成年雄性SD大鼠,鼠龄9周,体重220~250 g,购自西安交通大学实验动物中心,许可证号:SYXK(陕)2020-005。将大鼠圈养在无特定病原体(SPF)级实验室,温度控制在(25±2)℃,12 h光/暗循环,期间大鼠可自由获取食物和水。定期观察体重、食物消耗和饮水量变化,适应环境2周。所有动物研究根据美国国立卫生研究院《实验室动物护理和使用指南》进行。
1.2 主要试剂 抗转化生长因子β1(TGF-β1)(批号:ab92486)、抗Smad家族蛋白3(Smad3)(批号:ab40854)、抗Ⅰ型胶原蛋白(Col Ⅰ)(批号:ab6308)、抗α-平滑肌肌动蛋白(α-SMA)(批号:ab32575)和抗甘油醛-3-磷酸脱氢酶(GAPDH)(批号:ab8245)、IgG二抗(批号:ab6721、ab190475)均购自Abcam公司;依普利酮(批号:DST190124-015)购自成都乐美天医药;硫喷妥钠(国药准字H31021846)购自上海新亚药业有限公司;cDNA合成试剂盒购自高原生物科技有限公司;5%牛血清白蛋白、TRIzol试剂/Light Cycler 480检测系统及SYBR Green染料均购自赛默飞世尔科技有限公司;反转录酶试剂盒购自Takara公司;尿蛋白试剂盒、肌酐测定试剂盒和尿素测定试剂盒均购自南京建成生物工程研究所;Micro BCA蛋白质测定试剂盒购自中国优迪生物技术有限公司。
1.3 实验方法
1.3.1 DN大鼠模型建立、分组及标本收集:将大鼠随机分为对照组、模型组、依普利酮组,每组10只。将新鲜制备的链脲佐菌素(STZ)溶解在0.1 mol/L、pH 4.5的柠檬酸盐缓冲液中,单次腹腔注射剂量为60 mg/kg,以诱导DN大鼠模型。为防止完全破坏胰岛B细胞,在STZ注射液中溶解110 mg/kg烟酰胺。诱导72 h后,若空腹血糖>16.7 mmol/L、尿糖呈强阳性且尿量大于对照组50%,则表示建模成功[13-14]。对照组注射等体积0.9%氯化钠溶液和柠檬酸盐缓冲液。依普利酮组在模型组基础上每天管饲100 mg/kg依普利酮,持续8周。实验结束后,收集大鼠24 h尿液样本,储存于-80 °C,用于实验分析总蛋白和肌酐水平。采用40 mg/kg硫喷妥钠腹腔注射麻醉,心脏穿刺放血,分离样本取上清,分离肾组织,-80 °C储存,用于后续实验。
1.3.2 肾组织基因表达检测:使用TRIzol试剂从大鼠匀浆肾组织中提取总RNA,使用cDNA合成试剂盒合成cDNA,应用Light Cycler 480检测系统和SYBR Green染料进行实时定量PCR(RT-qPCR)以评估microRNA的mRNA表达水平。使用反转录酶试剂盒在37 °C下进行cDNA反转录15 min。热循环条件:在92 °C初始变性4 min,90 °C 15 s和 60 °C 30 s循环40次。应用Primer Express 2.0软件设计引物,GAPDH mRNA和U6小核RNA水平用于标准化,循环阈值分析RT-qPCR数据并表示为相对microRNA或mRNA水平,用2-ΔΔCT方法将其转换为倍数变化值。
1.3.3 生化标志物测定:从大鼠心脏收集血液样本,通过比色法测量血清葡萄糖浓度。使用尿蛋白试剂盒测定尿蛋白水平。采用肌酐测定试剂盒和尿素测定试剂盒测定肌酐和血尿素氮水平。使用酶标仪通过酶联免疫吸附(ELISA)法测定TGF-β1水平。根据肾小球滤过率(GFR)=UCr·V/PCr·1440(U指尿液,Cr指肌酐,P指血浆,V指24 h尿液)测量GFR。
1.3.4 蛋白质印迹分析:采用放射免疫沉淀测定缓冲液中裂解收集的肾组织。应用BCA蛋白试剂盒定量,每个样品上样50 μg,进行电泳。将细胞转移到聚偏氟乙烯(PVDF)膜,用6%脱脂奶粉在37 °C下封闭1 h。依据分子量大小裁剪杂交膜,分别与抗TGF-β1(1∶200)、抗Smad3(1∶1000)、抗Col Ⅰ(1∶500)、抗α-SMA(1∶1000)和抗GAPDH(1∶1000)37 °C条件下孵育2 h,与辣根过氧化物酶偶联羊抗鼠IgG二抗(1∶5000)37 ℃条件下孵育1 h。使用化学发光蛋白质印迹底物检测免疫印迹,可视化后进行抗体孵育。采用Chemi Doc MP Image分析系统扫描和定量蛋白质条带。
1.3.5 肾脏组织学检查:使用含4%多聚甲醛的磷酸盐缓冲液(PBS)室温固定肾组织20 min,石蜡包埋,切成3 μm厚的切片。然后进行苏木精和伊红(HE)染色(室温,20 min),使用Olympus倒置显微镜(×400)观察。
1.3.6 免疫组化分析:将3 μm肾组织切片脱石蜡(二甲苯和梯度乙醇)、再水化后,用微波辐射将其煮沸15 min,在柠檬酸盐缓冲液(0.01 mol/L,pH 6.0)中进行抗原修复。用PBS洗涤切片3次,室温下用5%牛血清白蛋白封闭30 min,加入抗TGF-β1(1∶200)、抗Smad3(1∶1000)、抗Col Ⅰ(1∶500)、抗α-SMA(1∶1000)和抗GAPDH(1∶1000)37 °C条件下孵育2 h,与辣根过氧化物酶偶联羊抗鼠IgG二抗(1∶5000)37 ℃条件下孵育1 h。使用Olympus倒置光学显微镜进行目视分析,计算平均光密度(MOD)。

2 结 果
2.1 三组大鼠肾脏组织microRNA的mRNA表达水平比较 见表1。模型组miR-29a、miR-29b、miR-29c的mRNA表达水平低于对照组,miR-192的mRNA表达水平高于对照组(均P<0.05)。依普利酮组miR-29a、miR-29b、miR-29c的mRNA表达水平高于模型组,miR-192的mRNA表达水平低于模型组(均P<0.05)。
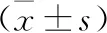
表1 三组大鼠肾脏组织microRNA的mRNA表达水平比较
2.2 三组大鼠体重、空腹血糖及肾脏质量/体重比较 见表2。模型组体重低于对照组,空腹血糖和肾脏质量/体重高于对照组(均P<0.05)。依普利酮组体重高于模型组,空腹血糖和肾脏质量/体重低于模型组(均P<0.05)。
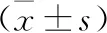
表2 三组大鼠体重、空腹血糖及肾脏质量/体重比较
2.3 三组大鼠生化指标比较 见表3。模型组尿蛋白、肌酐和血尿素氮水平高于对照组,而依普利酮组低于模型组(均P<0.05)。
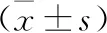
表3 三组大鼠生化指标比较
2.4 三组大鼠GFR比较 对照组、模型组和依普利酮组GFR分别为(33.62±4.58)ml/min、(24.45±2.67) ml/min 和(29.83±3.25)ml/min,三组比较差异有统计学意义(F=11.204,P=0.012)。此外,模型组GFR低于对照组,而依普利酮组高于模型组(均P<0.05)。
2.5 三组大鼠TGF-β1、Col Ⅰ、α-SMA和Smad3蛋白表达水平比较 见表4。蛋白质印迹分析结果显示,模型组TGF-β1、Col Ⅰ、α-SMA和Smad3蛋白表达水平高于对照组,而依普利酮组低于模型组(均P<0.05)。
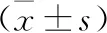
表4 三组大鼠TGF-β1、Col Ⅰ、α-SMA和Smad3蛋白表达水平比较
2.6 三组大鼠肾脏组织HE染色结果比较 见图1。模型组基底膜变薄(蓝色箭头),肾小球萎缩(黄色箭头),近曲小管损伤(绿色箭头)。经依普利酮治疗后,这些病理结构得到改善。

对照组 模型组 依普利酮组
2.7 三组大鼠TGF-β1、Smad3和α-SMA MOD比较 见表5。模型组TGF-β1、Smad3和α-SMA MOD高于对照组,而依普利酮组MOD低于模型组(均P<0.05)。
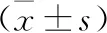
表5 三组大鼠TGF-β1、Smad3和α-SMA MOD比较
3 讨 论
DN是糖尿病主要微血管并发症,也是糖尿病患者病死主要原因。本研究发现依普利酮可以调控miR-192和miR-29a/b/c表达水平并逆转DN大鼠肾损伤。在过去几年中,microRNAs在肾脏疾病中的作用已被深入研究,并且由于其直接靶向细胞外基质基因的miR-29家族(miR-29a、miR-29b和miR-29c),受到了广泛关注。本研究表明,与对照组相比,模型组均质肾组织miR-29a/b/c表达水平降低,而用依普利酮治疗DN大鼠可以显著增加均质肾组织中miR-29a/b/c的表达水平,并降低miR-192的表达水平。miR-29a被引入作为微调胶原蛋白表达的抑制剂。因此,高葡萄糖/TGF-β1引起的miR-29a表达降低可导致近端小管细胞中过量胶原蛋白沉积的风险升高。近端肾小管细胞、原代系膜细胞和足细胞暴露于TGF-β1被证明会降低miR-29a/b/c的表达,其靶向胶原基因表达并增加细胞外基质蛋白的表达。研究[15]发现,高糖条件下2型糖尿病模型db/db小鼠肾内皮细胞和肾小球足细胞中miR-29c的表达增加,而敲除miR-29c可以防止DN进展。本研究结果表明,模型组肾脏组织提取物中miR-192表达水平高于对照组,经依普利酮治疗后miR-192表达显著降低。miR-192的下调有可能减少慢性肾病大鼠模型中Smad3介导的肾纤维化[16]。在体外模型研究中发现,miR-29a通过Smad3依赖性机制负调节一些纤维化基因,包括COL1A1、COL1A2和Ⅳ型胶原蛋白[17]。miR-29a表达在有肾功能障碍风险的患者的肾组织和患有肾纤维化的糖尿病啮齿动物模型中显著降低,提示DN肾组织中miR-29a/b/c表达增加可能通过靶向TGF-β1/Smad信号通路来改善DN。
本研究显示,与对照组相比,模型组肾组织中miR-192表达水平显著增加,而依普利酮治疗可以降低肾组织miR-192表达水平。依普利酮治疗8周后,与模型组相比,体重和肾脏重量均显著升高,血糖降低,肾功能的生化指标(尿蛋白、肌酐、血尿素氮)也得到改善,肾脏病理变化减轻,表明依普利酮对DN具有治疗作用。TGF-β1是一种主要的促纤维化因子,可驱动肾纤维化和DN发展[18]。TGF-β1激活Smad2和Smad3,它们是受Smad7负调控的两个关键下游介质,以执行生物活动。研究表明,阻断TGF-β1/Smad3信号通路是治疗DN的有效方法。此外,已经确定过多的胶原沉积是肾纤维化的主要特征,并且TGF-β1信号在刺激Col Ⅰ表达中起重要作用。在DN进展过程中,由肌成纤维细胞表达的α-SMA位于肾间质并与系膜增殖有关[19]。本研究表明,依普利酮在体内可降低TGF-β1、Smad3、Col Ⅰ和α-SMA蛋白的表达,表明依普利酮可能是一种有效的DN治疗药物,其潜在机制可能为通过TGF-β1/Smad信号通路抑制过度增殖和肾纤维化。研究[20]表明,miR-192与DN的发病机制有关,并且miR-192在实验性糖尿病的系膜细胞、肾小管上皮细胞和肾组织中富集。此外,有报道称miR-192是体外肾纤维化中TGF-β1信号传导的重要介质,且在肾纤维化过程中通过Smad3受到TGF-β1的严格调控。DN模型大鼠中miR-192表达上调,经依普利酮治疗后表达下调,这伴随着DN损伤和纤维化相关蛋白表达的减少,包括TGF-β1、Smad3、Col Ⅰ和α-SMA。有研究表明,TGF-β1可以通过miR-155信号通路阻碍Nephrin蛋白的表达并增强Desmin和Caspase-9的表达,抑制miR-155可减少TGF-β1处理的足细胞中的这些改变并减轻足细胞凋亡。
综上所述,依普利酮通可减轻DN模型大鼠肾损伤,机制与靶向miR-192和miR-29a/b/c表达调控TGF-β1/Smad信号通路有关。
