核苷类似物治疗慢性乙型肝炎至病毒学应答后谷丙转氨酶异常的因素分析
2022-03-16郭玉杰陈丽文张倩华高文军
祝 达 郭玉杰 陈丽文 张倩华 高文军
广东省中山市第二人民医院肝病科,广东中山 528400
我国慢性乙型肝炎(chronic hepatitis B,CHB)患者需抗病毒者较多,因核苷类似物(nucleosides analogues,NA)具备服用方式方便、病毒应答率高、可有效改善肝功能等优势,被广泛应用于临床。但临床上仍有部分患者在病毒应答[乙肝病毒脱氧核糖核酸(deoxyribonucleic acid,DNA)<100 IU/ml]后出现肝功能异常,尤其多见谷丙转氨酶(alanine aminotransferase,ALT)升高[1-2]。有研究提出NA治疗过程中,肝硬化和乙肝病毒DNA水平等因素是ALT升高的独立危险因素[3],但对于非肝硬化、乙肝病毒DNA已应答的CHB患者ALT升高现象的研究,国内文献相对较少,故本研究针对此类患者进行分析,寻找其ALT升高的原因。
1 资料与方法
1.1 一般资料
回顾性收集2017年1月至2020年3月中山市第二人民医院(我院)肝病科收治的CHB患者共685例,最终符合本研究纳入标准的患者共72例。所有患者均符合2015及2019年版《中国慢性乙型肝炎防治指南》的诊断标准及抗病毒指征[4-5]。所有患者均在检验、检查、用药前进行知情谈话并签署知情同意书。
1.2 纳入及排除标准
纳入标准:①乙肝表面抗原阳性> 6个月;②初次接受NA治疗并坚持规律用药;③治疗至乙肝病毒DNA水平低于检测下限(100 IU/ml),即实现病毒学应答。排除标准:①合并其他病毒性肝炎(甲肝、丙肝、丁肝、戊肝)或其他病毒感染(巨细胞病毒、EB病毒、HIV病毒)者:②合并自身免疫性肝病或妊娠期妇女;③既往有NA或干扰素治疗史者;④抗病毒治疗后仍然嗜酒(乙醇量:女性> 20 g/d、男性>30 g/d,或2周内有大量饮酒史,折合酒精量>80 g/d)[6]或使用肝损害药物者;⑤在抗病毒治疗后进行剧烈运动或合并心脏病、肌病者;⑥乙肝病毒DNA转阴时同时使用甘草酸类、联苯双酯等降酶药物者;⑦肝硬化、肝癌或其他恶性肿瘤者。
1.3 方法
患者在符合抗病毒治疗指征并签订抗病毒治疗知情同意书后,接受以下两种方案之一:恩替卡韦片(entecavir,ETV)(中美上海施贵宝制药有限公司,国药准字H20052237,规格:0.5 mg×7片/盒)治疗,每日空腹服用1次,每次0.5 mg。富马酸替诺福韦二吡呋酯片(tenofovir axetil,TDF)[Aspen Port Elizabeth(Pty)Ltd,国药准字H20130589,规格:300 mg×30片/盒]治疗,每日服用1次,每次300 mg。
1.4 观察指标
①记录患者抗病毒治疗前的年龄、性别、高血压史、糖尿病史、既往饮酒史、既往药物史、ALT、谷草转氨酶(aspartate aminotransferase,AST)、血白蛋白、总胆红素、碱性磷酸酶、胆汁酸、凝血酶原时间、凝血活动度、国际标准化比值、血肌酐、尿素氮、尿酸、二氧化碳结合力、白细胞、中性粒细胞比值、血红蛋白、血小板、甲胎蛋白(alphafetoprotein,AFP)、乙肝病毒DNA(lg)、肝硬度值。②超声声像图是否有脂肪肝、脾大,是否有胆道系统炎症或结石。
1.5 分组标准
患者每1~3个月回访一次,并进行肝功能及乙肝病毒DNA检测,记录HBV DNA转阴后的血清ALT水平。根据ALT是否大于正常值(40 U/L)分为ALT异常组及ALT正常组。
1.6 检验及检查设备
肝肾功能检测使用西门子全自动生化分析仪(ADVIA 1800);AFP检测使用西门子化学发光免疫分析仪(CENTAUR XP),凝血功能检测使用全自动血凝仪(CA-1500及STAGO STA Compact Max);血常规检测使用希森美康全自动血液分析仪(XN-10);血清乙肝病毒DNA检测使用达安公司乙型肝炎病毒核酸测定试剂,采用PCR-荧光探针法,检测下限(100 IU/ml)。所有检验均在我院检验中心完成。超声设备为HITACHI HI VISION Preirus,肝硬度检测设备为FIBROSCAN 502,操作医师为从事超声工作5年以上者。
1.7 统计学方法
数据采用SPSS 19.0统计学软件进行分析处理,计数资料以[n(%)]表示,采用列联表χ2检验;符合正态分布的计量资料以均数±标准差()表示,采用单因素ANOVA检验,不符合正态分布的计量资料以中位数(四分位间距)[M(P25,P75)]表示,组间比较采取非参数检验(Mann-Whitney检验);单因素分析差异有统计学意义的指标,进行logistic回归分析,筛选ALT异常的高危因素。以P< 0.05为差异有统计学意义。
2 结果
2.1 患者一般资料
入选患者年龄22~55岁,平均(36.43±7.24)岁。男63例(87.50%),女9例(12.50%)。28例(38.89%)选择ETV抗病毒治疗,44例(61.11%)选择TDF抗病毒治疗。病毒学应答后,有18例(25.00%)ALT异常,另54例(75.00%)ALT正常。
2.2 ALT异常组和ALT正常组临床资料比较
两组患者在性别比例、年龄、有无高血压史、有无糖尿病史、有无饮酒史、有无肝损害药物史、ALT、AST、总胆红素、碱性磷酸酶、胆汁酸、凝血酶原时间、凝血活动度、国际标准化比值、血肌酐、尿素氮、尿酸、二氧化碳结合力、中性粒细胞比值、血红蛋白、血小板、AFP、乙肝病毒DNA(lg)、肝硬度值、有无脾大、有无胆道系统炎症或结石、抗病毒药物的选择方面,差异无统计学意义(P> 0.05)。病毒应答后两组ALT水平比较,差异有统计学意义(P< 0.05)。ALT异常组血白蛋白、白细胞水平及合并脂肪肝的比率均高于ALT正常组,差异有统计学意义(P< 0.05)。见表1。

表1 ALT异常组和ALT正常组临床资料比较
2.3 影响病毒应答后ALT异常的危险因素分析
以是否存在病毒应答后ALT异常为因变量,以可能的影响因素(包括血白蛋白、白细胞、合并脂肪肝)为自变量,并进行赋值。进行logistic回归分析(引入和剔除标准分别为P< 0.05和P> 0.10),结果显示合并脂肪肝是CHB患者病毒学应答后ALT异常的危险因素(OR=14.013,P< 0.05)。见表2~3。

表2 赋值表
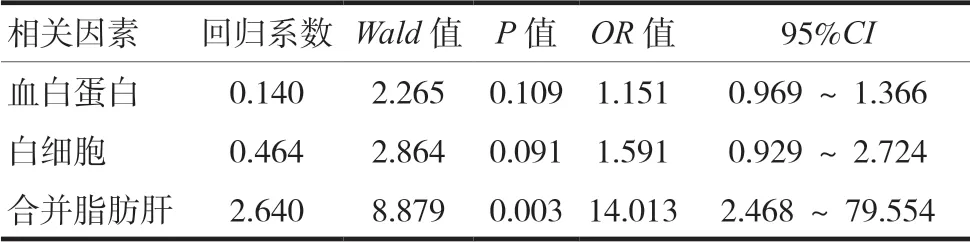
表3 影响病毒应答后ALT异常的相关因素
3 讨论
在肝炎的诊治过程中,ALT一直作为一项经典的指标来评估肝脏炎症[7],CHB的发生与病毒的活动密切相关,抗病毒治疗后,尤其是控制乙肝病毒DNA后可有效减轻甚至消除肝脏炎症[8-9],表现为ALT的降低及复常,多项研究均报道CHB患者使用NA后,乙肝病毒DNA的应答与ALT的降低呈正相关[10-11]。所以ALT复常率是抗病毒治疗后评估CHB控制的重要指标[5]。
但在一些研究中[12-13],CHB患者在使用NA抗病毒治疗后,48周ALT复常率约为54%~90%,针对这种现象,吴元凯等[3]研究认为肝硬化是其主要影响因素之一。本研究针对排除肝硬化的CHB者的多项数据进行分析,发现血白蛋白水平、白细胞水平及是否合并脂肪肝与ALT不能复常存在相关性,本研究结果提示病毒学应答后ALT不能复常的危险因素是合并脂肪肝,风险是无脂肪肝患者的14.013倍。由于本研究已经排除了饮酒、丙肝、肝损害药物因素,故此处的危险因素更指向合并代谢相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD)。
MAFLD在CHB患者中的患病率较高,在我国一项3477例CHB临床研究[14]和一项209例男性CHB肝活检研究[15]中,MAFLD患病率分别为24.1%和57.9%,目前亚洲国家CHB患者的MAFLD患病率在13.5%~56.0%[16]。本研究中合并脂肪肝患者占总人数的13.89%,符合亚洲国家患病率范围,同时在ALT异常组中,合并脂肪肝患者占该组的44.44%,提示病毒学应答后近一半的患者存在MAFLD可能。
早在2007年,土耳其一项对乙肝病毒DNA阴性却存在ALT异常人群的研究[17]发现,MAFLD是此类患者ALT升高的最常见原因;2012年我国一项接受ETV初始抗病毒治疗的CHB前瞻性研究[18]发现,合并肝脂肪变性的CHB患者,其ALT复常率在24周和48周时明显降低,这些与本研究的结论一致。由于MAFLD,尤其是代谢相关脂肪性肝炎(metabolic steatohepatitis,MASH)与ALT升高密切相关,且MASH可进一步导致肝纤维化及肝硬化[19],需要我们在诊治CHB的过程中评估ALT升高的原因,并高度重视排查MAFLD。
本研究结果显示,ALT异常组有更高的血白蛋白水平和白细胞水平,这可能与脂肪肝患者具备更高的营养状态及更高的炎症水平有关。本研究由于纳入住院患者,故转氨酶水平较高,可能导致数据结果偏倚,未来会进行更大样本量的研究。
综上,CHB患者经NA治疗至病毒学应答后,ALT异常的原因可能是合并脂肪肝。
