胰高血糖素样肽-1受体激动剂对改善2型糖尿病伴代谢相关脂肪性肝病患者糖脂水平及肝脏脂肪含量的影响
2022-03-16曾炼坤陈丹丹熊静妮刘雪芳夏碧文吴学敏
曾炼坤 陈丹丹 熊静妮 蒋 婵 刘雪芳 夏碧文 吴学敏
1.广州医科大学附属第四医院内分泌科,广东广州 511300;2.广州中医药大学深圳医院 (福田)内分泌科,广东深圳 518000
2型糖尿病(type 2 diabetes,T2DM)已成为困扰中老年群体的主要疾病之一,其发病机制源于机体胰岛素分泌不足或不敏感,导致血糖持续性升高[1]。发展至后期会出现各种并发症,代谢相关脂肪性肝病(metabolism-related fatty liver disease,MAFLD)便是其中一种,其是以肝细胞弥漫性脂肪变为主要病理特征的进展性肝病,对肝脏损伤较大,发展至后期甚至会出现肝硬化肝癌等问题[2]。因此有效地改善患者糖脂水平及肝脏脂肪含量是治疗此类疾病的根本[3]。本研究以广州医科大学附属第四医院及广州中医药大学深圳医院(福田)2019年1月至2020年1月收治的90例T2DM伴MAFLD患者为研究对象分析胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)受体激动剂对相关治疗的影响。现报道如下。
1 资料与方法
1.1 一般资料
选取2019年1月至2020年1月广州医科大学附属第四医院及广州中医药大学深圳医院(福田)收治的90例T2DM伴MAFLD患者为研究对象,随机分为研究组与对照组,每组各45例。研究组男24例,女21例,年龄37~81岁,平均(59.29±8.14)岁,体重52~82 kg,平均(65.82±6.77)kg,病程1~15年,平均(5.43±1.30)年;对照组男23例,女22例,年龄38~80岁,平均(59.01±7.78)岁,体重51~82 kg,平均(64.96±6.78)kg,病程1~16年,平均(5.39±1.45)年。两组一般资料比较,差异无统计学意义(P> 0.05),具有可比性。纳入标准:①以《中国2型糖尿病防治指南》为标准诊断,患者患T2DM同时伴MAFLD;②患者及家属对研究内容明确,并签字同意。排除标准:①患者患有其他功能障碍性疾病;②患者无法有效表达,不利于后期跟踪研究;③有高血压等其他类型并发症;④研究期间服用其他影响结果的治疗类药品。本研究已通过医院医学伦理研究会完成备案及审核。
1.2 治疗方法
①对照组口服盐酸二甲双胍片(中美上海施贵宝制药有限公司,国药准字H20023370)进行治疗,初始250 mg/次,2~3次/d,可以根据患者的治疗情况进行药量调整,每日总剂量可调整至1000~1500 mg,最多不可超过2000 mg。
②研究组使用利拉鲁肽注射液[诺和诺德(中国)制药有限公司,国药准字J20110026]进行治疗,皮下注射,1次/d,根据患者情况选择腹部、大腿、上臂等部位,时间可任意选择,但每日时间需固定,在改变注射部位和时间时无需进行剂量调整。起始剂量0.6 mg/d,至少1周后可调整剂量至1.2 mg/d。预计一些患者可能会将剂量从1.2 mg增加至1.8 mg,但每日剂量不可超过1.8 mg。
两组治疗疗程共90 d。
1.3 观察指标及评价标准
①对比分析两组患者治疗前后血糖变化,采用葡萄糖氧化酶法测定FPG、2 h PBG(检测均使用美国Beckman Coulter Au5800全自动生化分析系统),美国伯乐公司(Bio-RAD)离子交换高压液相糖化血红蛋白分析系统Bio-RAD VARANT及Bio-RAD公司配备的试剂盒测定HbA1C;②对比分析两组患者治疗前后血脂变化情况[4]:采用酶比色法测定TG、TC,可溶法测定LDL-C、HDL-C;③对比分析两组患者治疗前后的肝脏脂肪含量差异:研究采用美国GE 3.0T超导磁共振,无创定量诊断肝脏脂肪含量的金标准氢质子磁共振波谱法(1H-MRS)对患者肝脏进行扫描检测,并应用GE SAGE分析软件处理数据;④疗效评价:治疗后HbA1C降低1%以上或FPG降低超过30%,TG、TC或LDL-C下降25%,HDL-C升高25%视为显效;治疗后HbA1C降低0.5%~1%或FPG降低10%~30%,TG、TC或LDL-C下降15%,HDL-C升高15%视为有效;治疗后HbA1C降低少于0.5%或FPG降低10%以下,TG、TC或LDL-C下降10%,HDL-C升高10%视为无效。治疗有效率=(显效+有效)例数/总例数×100%。
1.4 统计学方法
使用SPSS 19.0统计学软件进行数据分析,计量资料用均数±标准差()表示,行t检验,计数资料用[n(%)]表示,行χ2检验,P< 0.05为差异有统计学意义。
2 结果
2.1 两组患者疗效比较
研究组总有效率高于对照组,差异有统计学意义(P< 0.05)。见表1。

表1 两组患者疗效比较[n(%)]
2.2 两组患者治疗前后FPG、2 h PBG、HbA1c情况比较
两组患者治疗前后FPG、2 h PBG以及HbA1C的比较,差异无统计学意义(P> 0.05);两组患者治疗后均降低,差异有统计学意义(P< 0.05),两组患者治疗后比较,差异无统计学意义(P> 0.05)。见表2。
表2 两组患者治疗前后FPG、2 h PBG、HbA1c情况比较(±s)
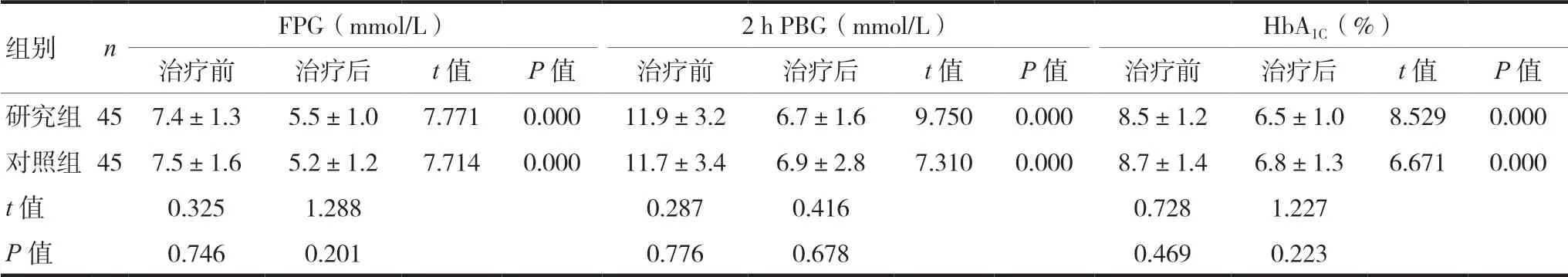
表2 两组患者治疗前后FPG、2 h PBG、HbA1c情况比较(±s)
注 FPG:空腹血糖;2 h PBG:餐后2 h血糖;HbA1C:糖化血红蛋白
组别 n FPG(mmol/L) 2 h PBG(mmol/L) HbA1C(%)治疗前 治疗后 t值 P值 治疗前 治疗后 t值 P值 治疗前 治疗后 t值 P值研究组45 7.4±1.3 5.5±1.0 7.771 0.000 11.9±3.2 6.7±1.6 9.750 0.000 8.5±1.2 6.5±1.0 8.529 0.000对照组45 7.5±1.6 5.2±1.2 7.714 0.000 11.7±3.4 6.9±2.8 7.310 0.000 8.7±1.4 6.8±1.3 6.671 0.000 t值 0.325 1.288 0.287 0.416 0.728 1.227 P值 0.746 0.201 0.776 0.678 0.469 0.223
2.3 两组患者治疗前后血脂变化情况比较
两组患者治疗前TG、TC、LDL-C、HDL-C比较,差异无统计学意义(P> 0.05);治疗后研究组TG、TC、LDL-C均低于对照组,HDL-C高于对照组,差异有统计学意义(P< 0.05)。见表3。
表3 两组患者治疗前后血脂变化情况比较(mmol/L,±s)
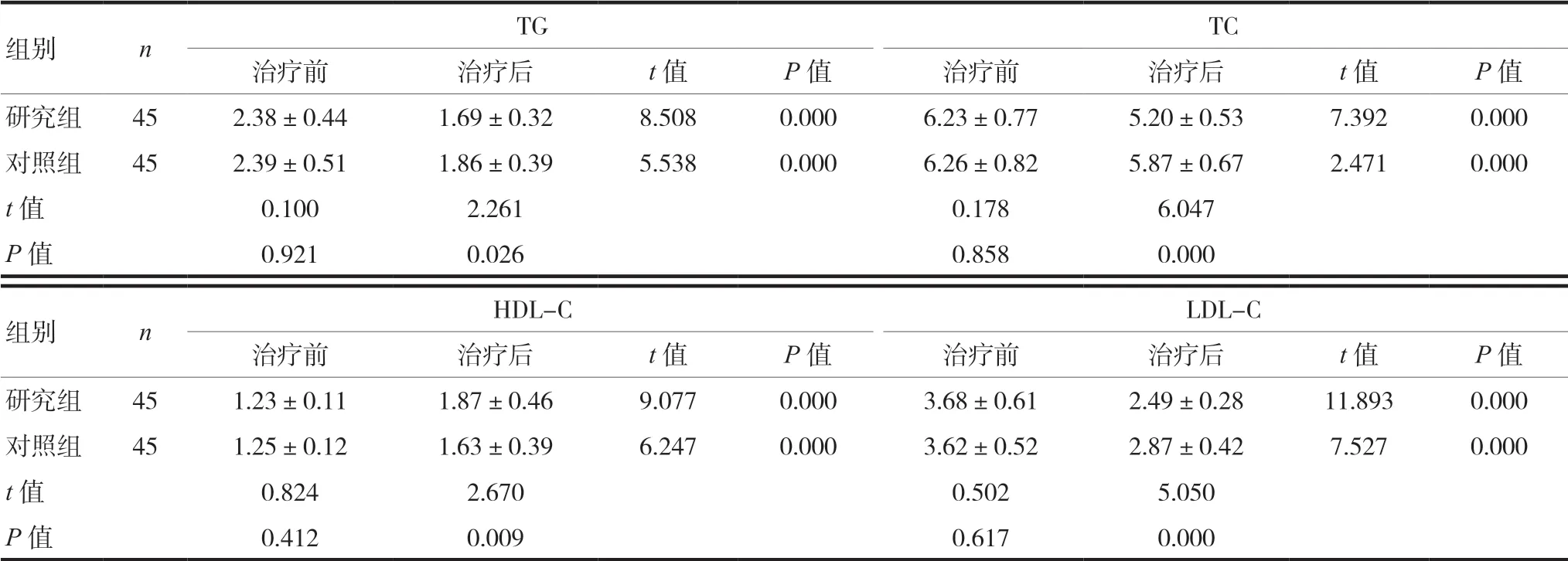
表3 两组患者治疗前后血脂变化情况比较(mmol/L,±s)
注 TG:甘油三酯;TC:总胆固醇;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇
2.4 两组患者肝脏脂肪含量比较
治疗前两组患者肝脏脂肪含量比较,差异无统计学意义(P> 0.05);治疗后研究组低于对照组,差异有统计学意义(P< 0.05)。见表4。
表4 两组患者肝脏脂肪含量比较(±s)
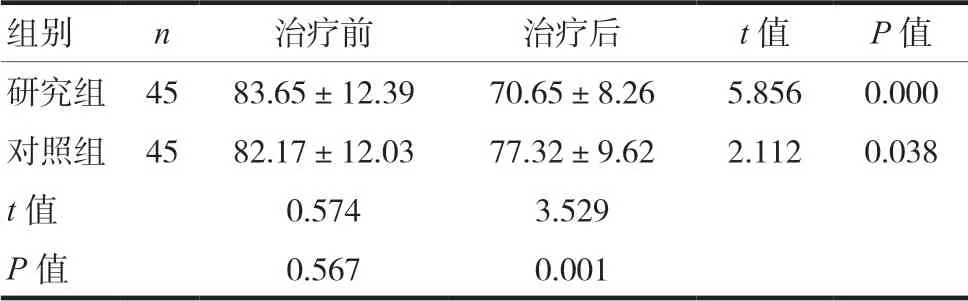
表4 两组患者肝脏脂肪含量比较(±s)
组别 n 治疗前 治疗后 t值 P值研究组 45 83.65±12.39 70.65±8.26 5.856 0.000对照组 45 82.17±12.03 77.32±9.62 2.112 0.038 t值 0.574 3.529 P值 0.567 0.001
3 讨论
T2DM会引发多种并发症,尤其是全身性、终生性症状,严重降低了患者的生活质量[5]。而伴代谢相关脂肪性肝病(又称非酒精性脂肪性肝病,NAFLD),则会进一步加重患者负担,两种疾病存在一定的发病关联性。MAFLD除引发脂肪性肝炎外还可以加重或诱发胰岛素抵抗,加重糖尿病的发病情况。有效的治疗方案至关重要[6-7]。
二甲双胍是各大指南推荐T2DM患者降糖治疗的一线降糖药物,患者使用后可以增加周围组织对胰岛素的敏感性,促进胰岛素介导对于葡萄糖的利用效率。同步状态下,非胰岛素依赖的组织利用葡萄糖的效率也会更高,尤其是一些高消耗机体部位如脑、肾髓质、肠道等,从而减弱肝糖输出,降低肠壁细胞葡萄糖摄入率[8-10],从而在降低血糖的同时避免过度的脂肪摄入。利拉鲁肽作为一种GLP-1类似物,与人GLP-1比较,两者有97%的序列同源性,相当于内源性肠促胰岛素激素,可以使得胰腺β细胞根据葡萄糖浓度来调节分泌胰岛素[11]。经皮下注射给药后,会增加环磷酸腺苷(cAMP)的含量,有效调节胰高糖素分泌,血糖高时抑制分泌,低时促进分泌。GLP-1改善MAFLD机制的探讨为目前的研究热点,鼠和人的肝细胞均存在GLP-1受体的表达,GLP-1可通过激活人肝癌细胞上的GLP-1受体使cAMP升高,经胰岛素信号通路改善人肝癌细胞脂肪沉积[12]。在非肥胖MAFLD小鼠模型肝脏细胞上的GLP-1受体的表达均下降,使用GLP-1受体激动剂通过结合GLP-1受体,使其活化能抑制肝细胞内脂肪合成基因的表达,从而促进脂肪酸氧化,逆转肝细胞内脂肪沉积[13-14]。同时利拉鲁肽能够有效延长胃排空时间,通过减轻饥饿感和能量摄入降低体重和体脂量的作用[15-16]。
本研究结果显示,对照组与研究组治疗后FPG、2 h PBG及HbA1C均能有效降低,但两组在治疗后降糖疗效两两比较差异不显著。TG、TC、LDL-C、HDL-C是检验脂肪肝患者肝功能的有效表征,研究组血脂降幅较对照组更优,说明利拉鲁肽对于肝脏脂类代谢有一定的促进作用,而研究组肝脏脂肪含量更低,更进一步证明了此结论。本研究提示,GLP-1受体激动剂除降糖作用外,还有降低血脂改善MAFLD的作用,其机制可能是通过其受体,抑制肝细胞内脂肪合成基因的表达,从而在临床上起到有效改善T2DM伴MAFLD患者的糖脂水平及降低肝脏脂肪含量的作用,有较好的临床应用价值。
