荧光假单胞菌SlyB的原核表达、抗原性分析及抗血浆杀菌作用
2022-03-14简思杰
孙 薇, 荣 娜, 简思杰, 晁 嘉, 刘 祥,2*, 丁 锐, 陈 锐
(1.陕西理工大学 生物科学与工程学院, 陕西 汉中 723000;2.陕西理工大学 中德天然产物研究所, 陕西 汉中 723000)
荧光假单胞菌(Pseudomonasfluorescents)为革兰氏阴性菌,广泛分布于水体和土壤中,是危害鱼类和水产软体动物的常见病原菌,可感染鲤鱼(Cyprinuscarpio)、鲫鱼(Rassiusaumtus)、草鱼 (Ctenopharyngodonidellus)、青鱼(Mylopharyngdonpiceus)等多种淡水鱼类引发败血病和赤皮病[1];病鱼的主要症状为口鼻出血,鳞片脱落并伴有血丝;解剖可见其肝脏肿大、出血,肾脏和肠道充血等症状[2]。目前,该病原菌的治疗主要依赖于抗生素,而抗生素滥用易导致细菌耐药性提高、药物残留和水体污染[3-4]。疫苗是抵御该菌感染的有效途径,然而该菌的亚单位疫苗尚未开发。
外膜蛋白位于细菌的最外层,在疾病的诊断和疫苗的开发上有重要作用[5],同时也是细菌在复杂环境中生存和致病不可或缺的毒力因子;感染途径主要为细菌定殖、入侵、逃避宿主防御和影响宿主免疫系统等,直接参与病原菌的多种致病机制[6]。研究显示,荧光假单胞菌的OprE和OprQ孔蛋白可以调节细胞膜的渗透性,增强细菌适应环境的能力[7];重组的外膜蛋白TdrA免疫比目鱼(Flounder),能够激发比目鱼的特异性和非特异性免疫功能,从而有效抵御荧光假单胞菌感染[8]。SlyB蛋白是革兰氏阴性细菌的一个主要外膜脂蛋白,与菌体细胞膜的完整性有关[9]。目前,对于荧光假单胞菌SlyB蛋白的免疫保护功能尚未见报道。
本研究选取荧光假单胞菌主要外膜脂蛋白SlyB为研究对象,原核表达、纯化SlyB蛋白,探究其最佳诱导表达条件,免疫小鼠制备多克隆抗血清并探究SlyB抗血清与嗜水气单胞菌、荧光假单胞菌和溶藻弧菌的相互识别作用,以及抵抗鱼血浆杀菌的作用,结合SlyB生物信息学分析,为荧光假单胞菌SlyB亚单位疫苗的研究提供理论参考。
1 试验
1.1 材料
1.1.1 菌株及供试动物
荧光假单胞菌ATCC 13525、嗜水气单胞菌、溶藻弧菌、Escherichiacoli(E.coli) DH5α、BL21菌株及pET-32a质粒由陕西理工大学中德天然产物研究所保存;4~5周龄昆明鼠购自西安交通大学医学部,实验前饲养一周,每日定量喂食供水。
1.1.2 主要试剂
rTaq聚合酶、T4-DNA连接酶、内切酶BamH Ι和XhoΙ来自TaKaRa公司;细菌基因组提取、质粒提取试剂盒购自上海生工公司;IPTG、TMB显色液购自西安赫特生物科技有限公司;HRP标记山羊抗小鼠IgG购自Sigma公司;引物合成、基因测序由天润奥科生物公司提供。
1.2 方法
1.2.1 生物信息学分析
从NCBI数据库获取不同种类的细菌的SlyB蛋白序列相关信息如表1所示。通过GeneDoc软件和MEGA软件序列比对和构建发育树;采用ProParam数据库预测SlyB的氨基酸数、分子量大小、等电点、稳定指数等参数,并从ProScale analysis数据库中获取亲水性图谱;采用软件TMHMM 2.0和Signal P3.0预测SlyB的跨膜区域和信号肽位置,并利用软件SOPMA和SWISS-MODEL分别进行二级结构和三维结构预测。最后使用STRING软件在线构建SlyB与其他蛋白的相互作用关系网络。

表1 不同细菌SlyB蛋白的信息
1.2.2 重组菌株的构建

1.2.3 重组蛋白的诱导表达及纯化
挑取SlyB表达菌单菌落于试管中过夜培养,以1∶100转接培养至OD600为0.6,加入0.1 mol/L的IPTG,摇床诱导6 h,取1 mL菌液收集菌体,加入300 μL 2×SDS吹打混匀,高温变性蛋白5 min,离心取上清10 μL进行SDS-PAGE电泳检测SlyB的表达情况,结合包涵体洗涤和SDS-PAGE蛋白电泳切胶法纯化SlyB蛋白。
1.2.4 重组蛋白表达条件的优化
以L9(34)模型(表2)进行SlyB的最佳诱导表达条件研究。以1∶100将过夜培养的SlyB饱和菌液转接至600 mL培养液中,37 ℃、200 r/min培养至设定的不同OD600值,按照不同试验组合要求加入不同终浓度的IPTG并在规定条件下诱导,每个组合进行3组重复。收取1 mL诱导菌液,沉淀加入300 μL 2×SDS,高温变性蛋白5 min,样品通过SDS-PAGE电泳获得不同诱导条件下SlyB蛋白的表达图谱。使用软件Phoretix 1D和SPSS 13.0分别进行表达图谱光密度和不同因子的显著性分析。

表2 SlyB表达条件试验的因子与水平
1.2.5 蛋白免疫小鼠抗血清的制备及特异性检测
利用蛋白免疫小鼠制备多克隆抗血清。选取昆明鼠试验组和对照组各5只,试验组每只取纯化的SlyB蛋白100 μg混合100 μL弗氏完全佐剂,腹腔注射免疫小鼠。14 d后,等量蛋白混合100 μL弗氏不完全佐剂,二次免疫小鼠。7 d后,进行第三次免疫;对照组免疫PBS。第三次免疫7 d后眼球取血,静置待血清自然析出后于4 ℃、3 000 r/min离心10 min,收集抗血清于-80 ℃保存备用。
Western blotting验证SlyB抗血清特异性。SDS-PAGE电泳嗜水气单胞菌全蛋白,恒压80 V转NC膜1 h,NC膜充分封闭2 h后与不同稀释倍数(1∶1600、1∶3200、1∶6400、1∶12 800)的SlyB抗血清于37 ℃轻摇孵育40 min,对照为阴性抗血清。用TNT缓冲液冲洗3次,再与1∶3000倍稀释的二抗于37 ℃轻摇孵育1 h,洗涤后通过DAB显色法确定SlyB抗血清的特异性。
1.2.6 体外模拟蛋白抗血清与鱼类主要病原菌的相互作用
ELISA方法检测蛋白抗血清与嗜水气单胞菌、荧光假单胞菌和溶藻弧菌的相互作用:培养嗜水气单胞菌、荧光假单胞菌和溶藻弧菌分别至OD600约1.0,菌体用体积分数1%的甲醛生理盐水85 ℃灭活,生理盐水调整菌液OD600=0.2,分装为1 mL/管(菌量108cfu),小管菌分别与100 μL不同稀释倍数的蛋白抗血清(1∶400、1∶800、1∶1600、1∶3200、1∶6400)孵育90 min,对照为阴性血清,再与200 μL 1∶3000倍稀释的二抗孵育1 h,洗涤菌体并混合20 μL PBS至酶标板中,加入200 μL TMB显色液,避光显色10 min,加入终止液2 mol/L H2SO450 μL,450 nm读数。
1.2.7 SlyB蛋白抵抗鱼血浆的杀菌作用
荧光假单胞菌经30 ℃过夜培养,以1∶100转接至100 mL新培养液中,培养至OD600为0.5,菌体用质量分数0.85%的生理盐水洗涤并调整OD600为1.0,收取8管1 mL菌液离心获取菌体,小管菌分别与600 μL不同稀释倍数的鱼血浆(未稀释血浆,与生理盐水按体积比1∶2、1∶4、1∶8、1∶16、1∶32、1∶64稀释,生理盐水)于30 ℃、200 r/min孵育5 h。孵育后菌体用生理盐水洗涤3次,SDS-PAGE分离全蛋白并转NC膜,NC膜充分封闭后依次与一抗、二抗孵育,通过DAB显色液进行显色。对比特异性条带的亮度,分析SlyB的差异表达以评价其抵抗鱼血浆的杀菌作用。
2 结果与分析
2.1 生物信息学分析
2.1.1 SlyB同源性与系统发育分析
通过GeneDoc软件绘制不同细菌SlyB氨基酸同源性分析(图1A),结果显示,SlyB蛋白在假单胞菌属、杆菌属间同源性较好。利用MEGA软件构建系统发育树(图1B),发现鱼类主要致病菌(荧光假单胞菌、鲑鱼气单胞菌、副溶血性弧菌)的亲缘关系较近。可见,SlyB免疫动物产生的抗体可能对不同种类的鱼类致病菌具有交叉免疫保护作用。

图1 同源性分析与系统发育树
2.1.2 SlyB理化性质、结构与蛋白互作预测
ProtParam数据库分析显示:SlyB含有308个氨基酸,分子质量为32 331.53 u,等电点为9.33,半衰期大于10 h,不稳定指数为34.88,归类为稳定蛋白;亲水性图谱分析得出SlyB亲水性平均值为-0.353,属于亲水性蛋白(图2A);跨膜结构预测图谱(图2B)显示,分别在7-29、44-66、87-109存在跨膜区域,表明全序列中预测到的跨膜域可信度较高,该蛋白属于外膜蛋白;信号肽预测结果(图2C)显示,SlyB的N端1-29位氨基酸组成了信号肽序列,29-30位氨基酸之间存在切割位点,可信度达到0.655;SOPMA软件二级结构预测显示,α-螺旋占全序列57.47%,延伸链占全序列5.84%,无规则卷曲占36.69%(图2D);SWISS-MODEL软件预测结果显示,SlyB的三维结构为异二聚体(图2E);通过STRING数据库构建蛋白互作网络,发现有5种蛋白可与SlyB相互作用,其中蛋白gloA和ompX与ExbB作用关系最为紧密(图2F)。

A.亲水性预测; B.跨膜结构预测; C.信号肽预测; D.二级结构预测; E.三级结构预测; F.蛋白互作网络
2.2 SlyB重组质粒的构建及蛋白表达纯化
利用引物F-SlyB、R-SlyB扩增slyB基因,电泳显示在约900 bp处存在单一条带(图3A),大小与理论值927 bp相符。重组质粒pET-32a-slyB经BamH Ⅰ和XhoⅠ双酶切,获得一条约900 bp的条带,大小符合预期(图3B)。目的基因经测序比对后与NCBI数据库公布的slyB基因序列一致,成功构建重组质粒。重组质粒转化至E.coliBL21获得SlyB表达菌,经IPTG诱导后,电泳显示目标蛋白成功表达,分子量大小约54 kDa;利用包涵体洗涤和SDS-PAGE电泳切胶法纯化获得SlyB蛋白(图3C)。

A.PCR扩增slyB基因; B.重组质粒pET-32a-slyB双酶切; C.SlyB蛋白表达纯化 M1.DNA Marker; M2.蛋白Marker; 1.slyB基因; 2.重组质粒pET-32a-slyB;3.BamH Ⅰ和Xho Ⅰ双酶切; 4.未诱导菌株; 5.诱导菌株; 6.纯化的SlyB蛋白
2.3 SlyB蛋白表达条件的优化
利用L9(34)正交试验优化SlyB蛋白诱导表达条件。诱导菌经SDS-PAGE获得不同诱导条件下SlyB的表达量存在差异,如图4所示。图谱光密度值见表3,所得极差和方差分析见表4、表5。从表4可得出,在诱导SlyB菌株表达时,最佳组合为A3B2C3D2,即在菌液OD600为1.0的时候加入终浓度为0.3 mmol/L的IPTG,32 ℃诱导12 h。表5分析结果显示,不同诱导条件下均未达到显著性,表明菌液OD600值、IPTG浓度、诱导温度和诱导时间对于SlyB蛋白的高效表达影响不大。

表3 SlyB蛋白表达图谱光密度分析

A、B、C为3次重复; M.蛋白marker; 1.未诱导菌株; 2—4.OD600值为0.5,诱导温度分别为28、37、32 ℃;5—7.OD600值为0.8,诱导温度分别为28、32、37 ℃; 8—10. OD600值为1.0,诱导温度分别为37、32、28 ℃

表4 SlyB表达图谱光密度数值的极差分析
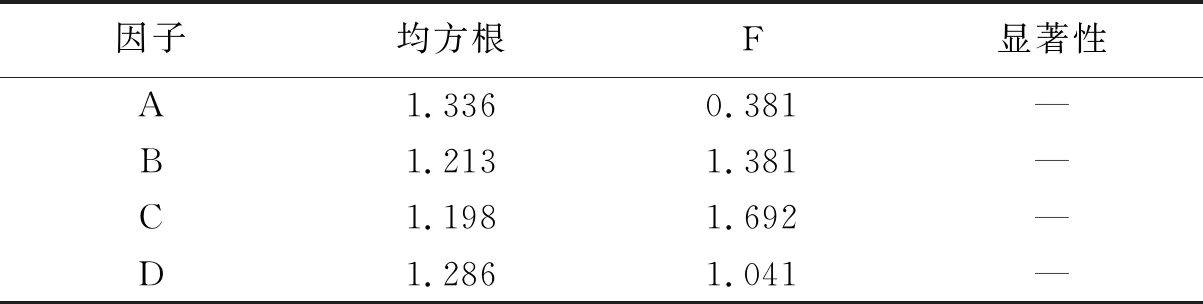
表5 SlyB表达图谱光密度数值的方差分析
2.4 SlyB蛋白抗血清的特异性与效价检测
Western blotting结果显示SlyB抗血清与SlyB蛋白特异性结合,呈现出明显的单一条带,阴性对照无条带,表明SlyB具有良好的免疫原性,效价达到1∶12 800(图5)。

M为蛋白Maker; 1—4.抗血清稀释倍数分别为1∶1600、1∶3200、1∶6400、1∶12 800; 5.阴性血清(1∶1600倍稀释)
2.5 体外模拟蛋白抗血清与鱼类主要病原菌
ELISA体外模拟SlyB抗血清与鱼类主要病原菌——嗜水气单胞菌、荧光假单胞菌和溶藻弧菌的免疫识别作用。结果为随着抗血清稀释倍数的增大,SlyB抗血清与嗜水气单胞菌、荧光假单胞菌和溶藻弧菌的结合能力逐渐减弱,当抗体滴度达1∶12 800时,仍可检测到SlyB抗血清与3种菌的相互作用(图6)。可见,SlyB抗血清与嗜水气单胞菌、荧光假单胞菌和溶藻弧菌存在体外相互作用,表明SlyB具有良好的抗原性。

(a)SlyB抗血清与嗜水气单胞菌 (b)SlyB抗血清与荧光假单胞菌
2.6 SlyB蛋白抵抗鱼血浆的杀菌作用
采用Western blotting方法检测SlyB与鱼血浆作用后的差异表达情况,体外模拟SlyB抵抗鱼血浆对荧光假单胞菌的杀菌作用。结果显示,试验组与对照组SlyB均检测到特异性条带,而随着血浆浓度的降低,SlyB的表达呈下调趋势(图7),推测SlyB蛋白对抗血浆杀菌具有一定的作用。

M.蛋白Marker;1.未稀释血浆; 2—7.血浆稀释倍数分别为1∶2、1∶4、1∶8、1∶16、1∶32、1∶64;8.阳性对照(生理盐水)
3 结论与讨论
荧光假单胞菌主要引起热带鱼、鲑科鱼类和多种鱼类的败血病和赤皮病,多是鱼类体表受伤后在损伤之处产生溃疡性红斑,进而诱发疾病的发生,死亡率大,发病后期难以治愈[10]。外膜脂蛋白是外膜蛋白中重要的一类蛋白,在疾病的诊断和蛋白疫苗开发上有重要的作用[6,11]。本研究对SlyB的理化参数、保守功能域、信号肽、亚细胞定位、亲/疏水性、蛋白质结构、系统进化等进行了生物信息学分析。结果发现,SlyB蛋白为稳定的亲水性蛋白,并且存在3个跨膜结构区域,二级结构主要以α-螺旋为主。α-螺旋区负责与脂质和蛋白质分子的结合,从而促进了膜结构的完整性,极有可能成为B细胞抗原表位的优势区域[12-13]。同源性分析显示SlyB蛋白在假单胞菌属、杆菌属间同源性较好,系统发育树发现鱼类主要致病菌(荧光假单胞菌、鲑鱼气单胞菌、副溶血性弧菌)的亲缘关系较近。由此推测,SlyB免疫动物产生的抗体可能对不同种类的鱼类致病菌具有交叉免疫保护作用。通过分子克隆、原核表达及纯化,成功构建SlyB蛋白表达菌株,将纯化获得的蛋白免疫小鼠制备多克隆抗体。
目前多克隆抗体的制备因操作简单、灵敏度高被广泛应用[14]。吴钢涛等[15]采用A族毒素人工抗原3-Ac-NEOS-HS-BSA免疫新西兰长耳白兔,分离血清制备A型单族毒素多克隆抗体。徐逍等[16]以Balb/C小鼠为受免动物,采用优化的免疫抗原和检测抗原合成技术及免疫方式获得高滴度、强特异性和高亲和力的多克隆抗体。本研究采用SlyB蛋白免疫小鼠制备多克隆抗体,Western blotting测定效价为1∶12 800,为SlyB的免疫功能研究奠定基础。
进一步优化发酵条件,以实现目的蛋白的高效表达。荣娜等[17]利用分子克隆构建P5表达菌株并确定其最佳诱导表达条件:诱导时菌液浓度OD600=1.0,IPTG浓度0.5 mmol/L,32 ℃诱导8 h;Chen C等[18]探究溶藻弧菌FlaC蛋白的最佳表达条件包括菌株OD600值0.8,IPTG浓度0.1 mmol/L,28 ℃诱导8 h。刘祥等[19]通过构建大肠埃希菌外膜蛋白OmpA原核表达载体,优化其表达条件:菌OD600值达0.5时加入终浓度0.3 mmol/L的IPTG,37 ℃诱导12 h。本研究以荧光假单胞菌外膜蛋白SlyB为研究对象,对其发酵条件进行优化,得出最佳诱导条件为在菌液OD600为1.0时加入终浓度为0.3 mmol/L的IPTG,32 ℃诱导12 h,为后续的大批量发酵实验提供技术支持以及SlyB的功能研究奠定基础。
酶联免疫吸附测定法(ELISA)具有良好的敏感性、特异性、准确性以及简便等特点,在免疫学试验中广泛运用[20-21]。赵凯等[14]通过小麦蛋白单抗、多抗及双抗夹心ELISA快速定性检测技术的研究,检测限最低达到10 ng/mL,满足食品中微量过敏原的检测需求;HUET等[22]介绍了一种基于免疫化学的多残留筛选方法(ELISA)的开发,测定食品中的(氟)喹诺酮残留。实验室前期使用免疫酶联法模拟P5抗血清对嗜水气单胞菌的体外识别,证实存在识别作用;LIU Xiang等[23]使用ELISA检测发现CM-TEP抗体与金黄色葡萄球菌、大肠杆菌和链球菌之间的相互作用,结果发现存在直接的相互作用。本实验在使用ELISA检测发现SlyB抗血清与嗜水气单胞菌、荧光假单胞菌和溶藻弧菌存在体外免疫识别作用,表明SlyB蛋白对这3种菌的感染可能具有免疫保护作用。此外,前期通过体外模拟嗜水气单胞菌P5蛋白抵抗鱼血浆对嗜水气单胞菌的杀菌作用,结果显示P5蛋白的表达呈上调趋势;本实验通过体外模拟鱼血浆杀菌作用,发现随着血浆浓度的降低,SlyB蛋白的表达呈下调趋势,表明SlyB蛋白对抗血浆杀菌可能存在一定的作用。
本研究获得荧光假单胞菌SlyB蛋白表达菌株,纯化SlyB蛋白,制备SlyB多克隆抗血清,检测其特异性,优化发酵条件,并综合其抗血清与菌体外识别作用以及抗血浆杀菌作用。结果获得特异性较好的抗血清,并与嗜水气单胞菌、荧光假单胞菌和溶藻弧菌存在体外识别作用,而且可能抵抗鱼血浆对荧光假单胞菌的杀菌作用。因此,SlyB蛋白的研究有望为荧光假单胞菌免疫功能学奠定基础。
