小鼠双光子激光扫描显微镜活体成像窗口构建技术
2022-03-14李娟关苑君梁翠莎张岚岚吴珏珩
李娟,关苑君,梁翠莎,张岚岚,吴珏珩
中山大学中山医学院,广东广州 510080
前言
双光子激光扫描显微镜结合了激光扫描共聚焦显微镜和双光子激发技术,以红外飞秒激光作为光源,使用高能量脉冲激光器,具有高峰值能量和低平均能量的特点,可深入组织内部非线性地激发荧光,成像不需针孔,非焦平面外荧光分子不被激发,成像亮度和信噪比高,且光漂白只在焦平面产生。此外,因采用长波长激发,散射较小,易穿透样本;且近红外光对细胞毒性小。双光子显微镜基于组织器官穿透性深、光漂白及光毒性低等独特优势,相比单光子显微镜更适用于厚标本及活体组织的观察和成像,目前已成为生命科学各领域的重要研究工具[1]。
目前小动物双光子活体光学成像在神经科学、神经药理学、肿瘤治疗、免疫学、干细胞应用等研究领域中有广泛应用。在神经系统的发育,感知觉、行为、学习、记忆等认知活动以及疾病损伤相关研究中,大量实验在细胞和亚细胞水平上对神经细胞结构形态[2-6]、离子浓度[7-10]、细胞运动[11-12]、分子相互作用[13-15]等生理现象和过程进行成像监测、神经-胶质-血管构成的网络通讯成像[16-17]以及光漂白[18]、光刺激[19]、光损伤[20]等光学操纵。在癌症诊断与病理学研究中,很多相关实验通过多色双光子活体光学成像技术动态监测肿瘤在体内的生长和转移,并对治疗中癌细胞的变化进行实时观测和评估[21-23]。在免疫学研究领域,双光子活体成像技术在免疫细胞的运动监测[24-25]、免疫细胞间的相互作用[26-27]、免疫应答分子细胞机制研究[28-30]等方面有广泛的应用。应用双光子成像技术进行干细胞研究主要集中在监测干细胞的移植,示踪干细胞在体内的分布和迁移等[31-33]。此外,双光子活体成像技术也应用于小鼠其他组织如皮肤[34]、眼睛[35]、肌肉[36]、胃肠[37]等的活体观察成像以及斑马鱼胚胎发育监测[38]等方面。
对于双光子光学活体成像,由于光散射,目前成像深度≤1 mm[39]。器官的可视化仅限于浅表组织如皮肤,其他脏器的在体成像则一般需手术暴露成像部位。而暴露器官成像需要进行侵入性手术,并从解剖位置操作器官,这些操作使实验的持续时间限制在36 h内[40]。然而,大多数的生理和病理过程发生在更长时间内。需连续几天或更长时间内对同一只动物多次成像。因此双光子活体成像除了荧光标记技术,待观察组织的暴露及固定技术非常重要。此外,正置双光子显微镜配置红外专用水镜,物镜角度不可调节,小鼠活体成像过程中会因稳定性不足发生抖动,样品与物镜间的水缺失以及活体动物自身的呼吸和心跳等影响因素也会造成图像成像焦面的丢失。因此对于动物成像部位的维持与固定有非常高的要求,固定装置不能对动物有太大的损伤,既要保证能够得到清晰的图像,还要保证动物生命体征正常。
目前已有多项研究通过构建和使用双光子活体成像窗口,实现对不同脏器进行固定和长期成像。其中脑部颅骨薄窗成像技术较为成熟,因其位置优势,前处理和固定相对较容易,结合荧光标记物已广泛应用于脑神经科学相关研究。腹部器官如肝脏、淋巴组织、肠、脾脏和肾等都很软且血管密布,由于解剖位置不同,缺乏可以固定成像窗的骨骼结构,给窗口适配器的固定增加了难度;而且腹部脏器普遍离心脏较近,拉伸距离有限,更需要较好的固定和麻醉来抵抗心跳造成的图像抖动。因此腹部器官的活体成像更具挑战性。
除了小鼠头部固定适配器器已有商业化产品,其他固定适配器均需根据具体实验自制或定制。商业化的头部固定适配器,如Narishige 成茂公司的MAG-2 Head Holding Device,成本较高。目前自制的各种双光子活体成像窗口维持与固定装置,通过多次活体动物成像实验表明,稳定性与适用性均达到科研要求,并且成本低廉,使用方便,具有更强的通用性和拓展性,可广泛应用于各相关研究领域。
1 脑活体成像的薄颅窗
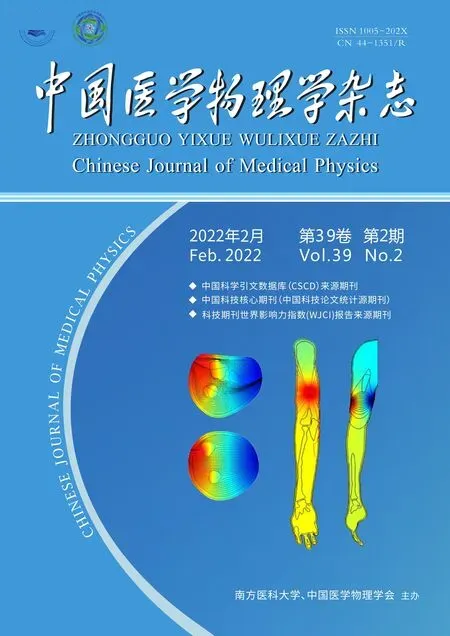
小鼠大脑中的神经元、胶质细胞和脉管系统的活体成像已广泛应用于神经生物学相关研究。Yang等[41]建立活鼠颅骨薄窗活体成像方案,通过创建一个颅骨厚度为20 μm 的薄颅颅窗来对皮层的荧光标记结构进行成像(图1)。手术可在30~45 min 内完成,术后可立即成像,几天至数月中可重复多次成像。颅骨薄窗成像避免了脑膜和皮质的暴露,为研究正常和病理条件下活脑细胞的结构和功能变化提供了一种微创方法。该技术通过胶水将成像区域固定在定制的颅骨固定器的内部开口上,形成闭合水槽[42]。在解剖镜下,用颅骨钻打磨成像圆形区域(直径为0.5~1.0 mm),获得中心约20 μm 厚度的成像区域(直径约200 μm)。利用双光子显微镜对颅骨进行自荧光成像,可直接测量颅骨厚度。若二次成像,则刮除成像区域上重新生长的结缔组织,或使用刀片仔细刮除颅骨直到获得清晰图像。
图1 活鼠颅骨薄窗成像Figure 1 Thinned-skull cranial window imaging for live mice
颅骨薄化技术的难度主要在于颅骨厚度和均匀度,均匀地达到最佳厚度需要大量的手术实践。不均匀的颅骨厚度可能导致球面像差,从而导致深处结构的双光子激发减弱和畸变。同时,要确保在颅骨变薄区域下的表层皮层没有发生手术引起的皮质损伤,打磨区域过大(面积直径>300 µm)、厚度过薄(<15 µm)可能会导致神经结构混乱、激活免疫细胞等。轻微脑外伤或出血会引起炎症和神经结构破坏,影响后续成像质量和实验结果。
除薄颅骨技术外,还可以通过开颅骨窗观察皮质[43]。不过相对于薄颅骨法,颅骨摘除更容易引起明显的炎症反应。此外,Zhao 等[44]研发了可逆的颅骨透明化技术,在颅骨表面涂抹光透明剂,颅骨可在数分钟内变得透明,形成可观测颅窗;生理盐水擦洗及干燥处理即可恢复原态。
双光子活体成像技术能够实现在深层组织细胞水平上的形态和生理学监测。然而,组织散射将最大成像深度限制在小鼠大脑皮质层,目前成像皮质下结构需要移除覆盖的脑组织[45]或插入光纤[46-47],或采用结合了更长激发波长和高阶非线性激发的三光子荧光显微镜,从而实现小鼠海马内的血管和神经元非侵入性的高分辨率成像[48]。
2 肝脏活体成像的腹部成像窗
由于腹部器官的解剖位置不同,较皮肤、颅骨等部位的成像,其成像窗口的设计和需考虑的因素更复杂。Tanaka 等[49]设计了肝脏环状吸盘,用可逆胶水固定肝脏来进行双光子活体成像。侧面用夹子固定住环状吸盘,同时嘴部可进行吸入式麻醉,此方法只适用于正置显微镜,也有血液溢出、组织发炎问题等,同时环状吸盘固定后能够连续采集24 h,但是较难重复多次采集。
Ritsma 等[50]利用钛合金建立腹部窗口式模型(图2),实现低损伤长时间观察肝脏,长达5~6周。腹部成像窗由一个钛环组成,侧面有一个1 mm 的凹槽,顶部有玻璃盖玻片用胶水固定,便于更换。手术将腹部成像窗植入皮肤和腹壁,用隐藏在腹部成像窗环槽内的荷包缝线固定,并将缝线隐藏在凹槽内,以防止老鼠撕扯。

图2 腹部成像窗尺寸图Figure 2 Dimensions of abdominal imaging window
由于肝脏的解剖位置位于胸腔下方并附着在膈肌上,通过腹部成像窗进行肝脏成像和减少呼吸运动需要额外的手术步骤。首先,切除胸骨剑突,切开镰状韧带,操纵肝脏到尾部腹侧的位置,将其固定在腹部成像窗上,减少呼吸运动。其次,在横膈膜和肝脏之间的空间中放置无菌棉纱卷,以进一步吸收呼吸运动并使肝脏稳定在其尾部位置。最后,用胶水将肝脏牢固在成像窗后的位置。
由于重力等原因,该腹部成像窗在长时间观察时肝脏可能依然会有位移。因此该成像窗更适合倒置型双光子显微镜的活体成像,通过在老鼠腹部贴上胶带,将腹部成像窗固定在物镜上方的成像盒子中间的空隙处。在倒置显微镜下,重力有助于将器官固定在合适的位置,并减少呼吸作用下的组织运动,同时实现吸入式麻醉、保持恒温、重力暴露窗口和固定组织的综合作用。该腹部成像窗技术也可实现肝脏、胰脏、小肠和脾脏活体长时间观察成像。
3 肺活体成像的负压胸吸窗
带血管的器官中,细胞的实时成像需在维持完整生理特性的同时优化图像分辨率。这一问题在肺中尤为突出,对于活体成像,肺部自主呼吸和心脏搏动将严重影响观察区的稳定,在吸气-呼气循环中,由于心脏收缩、脉动血流导致大范围的组织运动,使肺的活体成像难度较大。此外,肺有丰富的毛细血管网,物质交换频繁,生命活动旺盛。肺组织质地疏松薄弱,极易受损。任何对肺的气-液界面完整性的扰动都可能产生破坏性的后果,导致肺血管泄漏和气体交换受损。
之前的肺成像方案依赖于诸如活体肺隔离和再灌注[51]、夹住通气[52]或在肺呼气末或机械通气[53]停止后捕捉图像等方法。尽管这些方法都对肺成像有用,但这些方法不适用于研究生理气体交换和血液流动下高速、三维细胞动力学等相关实验。
Lamm 等[54]构建了小鼠肺活体成像胸窗(图3),中空的凹槽内径6 mm,底部粘有18 mm 的玻璃盖玻片,该装置的特点是真空通过成像区域附近的沟槽循环,使用20~25 mmHg可逆真空负压吸力轻拉肺组织进入盖玻片的浅锥形区域。然后轻轻固定肺。

图3 肺活体成像负压胸窗Figure 3 Negative pressure chest window in in vivo lung imaging
Looney 等[55]在Lamm 等[54]构建的胸窗基础上,修改凹槽内径为4 mm,并优化了一种温和稳定系统,该系统可以限制组织运动,同时允许血液流动,并提供连续吸入气体,可用来观察稳态生理和肺炎症以及损伤模型下的免疫细胞循环和细胞运动。
负压胸吸窗不涉及伴随肺血管收缩反应的通气中断,也不涉及人工灌注。血流速率与从其他器官推测的值相似。该技术也保留了通风,但不妨碍成像。局限性在于:成像在正压通风而不是在自主呼吸状态下;成像深度在胸膜表面以下125µm处,仅扫描胸膜下血管和肺泡。但通常认为胸膜下和深层实质微血管网络在血管调控方面相似。
4 脊髓活体成像窗
动物的心脏和肺与脊柱的紧密接近导致由心跳和呼吸运动产生的伪影,显著阻碍了从活体小鼠脊髓成像获得稳定的图像。Misgeld等[56]建立了一种脊髓活体成像技术,这种方法需结合温度控制灌注系统和动物插管的多个连续层切除术,在图像采集过程中通过中断动物的呼吸以及广泛的图像后处理来去除失焦帧。
此后,Davalos 等[57]建立了另一种稳定和重复成像的简化方法,通过结合定制的脊柱稳定装置和深度麻醉方法,利用全身悬吊和局部夹紧脊髓以减少呼吸和心跳引起的剩余运动伪影。可在没有动物插管或呼吸控制的情况下对精细细胞结构进行活体成像,并在较长时间内维持一个稳定的生理窗口。但Davalos 等[57]建立的方法为实现多次成像,每次成像完后需缝合,下次成像时再打开,重新暴露脊髓节段,存在增加动物感染风险、造成脊髓局部损伤、激活脊髓局部的免疫反应、对动物造成长期疼痛等问题。
Farrar 等[58]建立了一种小鼠脊柱脊髓固定观察装置,通过将观察窗口植入小鼠腰段脊柱,在暴露的脊髓节段上涂生物硅胶,用玻璃片封闭装置,从而使小鼠能够长期携带观察装置生存,避免了重复手术对成像带来的干扰(图4)。每次成像时,将小鼠麻醉后固定到定制的手术和成像平台上,从而稳定脊柱并将小鼠从手术台上抬起,以允许在吸气过程中胸腔自由扩张,从而减少运动伪影。

图4 小鼠脊柱脊髓固定观察装置Figure 4 An imaging chamber for mouse spinal cord
5 肿瘤活体成像窗
肿瘤细胞的侵袭性迁移和进入循环是肿瘤的共同特征,是转移级联的关键早期步骤。而肿瘤在动物模型和患者中都是异质性的。能够在体观察肿瘤细胞行为对于理解转移机制及微环境的定义等都至关重要。
通过皮瓣法可对单个细胞进行数小时的跟踪,但仅限于单次成像,且存在组织脱水、体温调节控制受损的问题。另一种广泛使用的动物成像方法是背侧皮肤褶皱腔。背部皮褶腔模型已应用于血管生成、肿瘤微环境和治疗反应[59-60]。背窗室技术包括通过外科手术植入一个钛框架来支撑一个透明的窗户[61]。将小鼠的背部皮肤向上折叠成框架,在直径约1 cm 的圆形区域内切除一侧皮肤。此外,圆形盖玻片放置在开口上,从而实现高分辨率显微镜检查。对于肿瘤微环境的研究,在窗口植入过程中,肿瘤细胞被注射到下面的皮肤组织中。肿瘤将在窗口中生长,能够对肿瘤的开始和生长进行纵向成像。但这种技术的缺点是背侧窗室要求肿瘤在皮下生长,而不是在原位生长;其次,受窗室大小的限制,只能监测小肿瘤;而且,因为背部皮褶的弹性随着时间的推移而降低以及炎症反应等,窗口观察和成像仅能在不超过2周的观察期内重复进行。
为了对正位肿瘤进行高分辨率多重成像,Keedrin等[62]开发了一个适用于倒置双光子显微镜的乳腺肿瘤成像窗口,成像窗底座由两个粘在一起的塑料环组成,较小环的内径9 mm/外径10 mm,较大环的内径9 mm/外径14 mm(图5)。较大环上有便于缝合皮肤的孔。小环顶部粘有8 mm 玻璃盖玻片。根据肿瘤的大小和形状,成像窗可以组装成扁平(图5a)或解剖弯曲(图5c),放置在可触及肿瘤的顶部(直径4~10 mm),也可在乳腺上方加入肿瘤细胞。该成像窗适用于原位小鼠异种移植、转基因小鼠或注射到乳腺脂肪垫的瞬时转染细胞。成像时间最长可达21 d。为了将成像窗固定在合适的位置,并减少呼吸引起的组织运动,同时实现吸入式麻醉,Keedrin等[62]同时设计了成像盒进行适当的窗口定位,成像窗口被固定在盒子底部的缝隙间,物镜位于缝隙下方,便于成像。
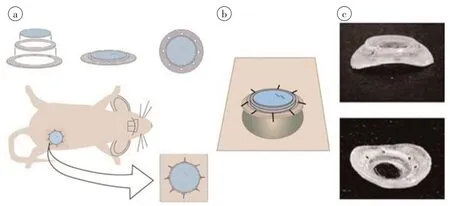
图5 肿瘤成像窗组件Figure 5 Components of tumor imaging window
6 总结
双光子激光扫描成像技术以其组织器官穿透性强、光漂白及光毒性低等独特优势,成为小鼠高空间分辨率活体成像的重要工具,广泛应用于癌症病理、神经疾病及脑功能成像等相关研究。正置双光子显微镜因镜下空间较大,更适合小鼠等模式动物的活体成像,尤其身体上方的部位,如头部和背部,适合用正置水镜观察。倒置双光子显微镜主要应用于细胞层面上的研究,如在纳米领域、双光子荧光探针领域以及与双光子相结合的细胞通路相关实验,也适用于一些身体下方如腹部软组织的活体观察,如肾脏、肝脏、肠、淋巴结、肿瘤等,重力有助于将器官固定在合适的位置,并减少呼吸作用下的组织运动,提高成像画质。对于3D类器官、细胞微球等标本,用倒置双光子成像也相对更方便。
双光子活体成像的实验步骤大概分为:样品处理手术、样品固定、仪器操作和图像处理。仪器操作相对简单,用户经过培训一般可独立操作。难度较大的是样品处理和固定,尤其腹腔内的组织需要进行较大的外科暴露手术,并需要利用金属环、金属支架等进行固定,在进行开窗的外科手术中,容易感染,导致炎症细胞浸润,从而影响实验结果。对于需数天甚至更长时间观察成像的实验,对手术操作的要求则更严苛。手术中动物死亡、流血、窗口脱落、感染及组织轻微抖动等问题的出现使成像实验的失败率很高。
除了合适的暴露手术,还需选择合适的固定方式,尽量减少抖动对成像的影响。脑部由于远离心脏,且颅骨位置相对其他脏器较容易固定和成像;而脊髓位于躯体深处,易受到呼吸及心跳的影响。腹部脏器的成像难度更大,除了肠之外,往往无法拉出脏器盖上盖玻片观察;即使拉出脏器,盖上盖玻片后由于倾斜问题,使用正置水镜较难保留水分。因此合适的成像固定适配器至关重要。此外,成像时需保证动物始终处于良好的麻醉效果,有利于抑制小鼠肢体运动和呼吸频率,提高成像质量。另外,动物载物台的温度等细节对于保证动物生理机能处于正常水平以及活体成像观察数据的准确性也非常重要。
软组织,如肝脏、肺、脂肪、淋巴结、肠、脾脏、肾脏等,在体成像时,因呼吸和心跳导致的图像抖动问题尤其明显,解决这个问题有几个思路,首先,选择合适的固定器稳定标本,除了上述的脏器适配器,真空负压吸窗通过负压吸附固定组织,无需使用胶水,吸力连续可调,且可定做适合不同器官的多种规格吸盘,可广泛用于各类软组织成像。但是负压固定器的调节也并非一步到位,需要通过摸索,找到最稳定的状态。其次,在不影响数据收集的前提下,可尽量提高拍照速度,调节双光子图像采集频率,使其与呼吸心跳节奏一致。最后,不同帧图像因抖动产生的位移可以借助软件解决,如Image J插件Running Z Projector等。小鼠双光子活体成像应用广泛,解决前期样品处理和固定问题,将更有利于实验的顺利开展。