下调髓系白血病细胞系K562细胞中乳腺癌缺失因子1表达对其DNA损伤反应的作用初探
2022-03-13田晓雪梁爱斌
董 林 田晓雪 梁爱斌
白血病是一种常见的血液系统肿瘤,目前,化学治疗(简称化疗)是治疗白血病的主要方法。白血病细胞对抗癌药物的耐药是白血病化疗失败和疾病复发的主要原因。在白血病的常规治疗中,大多数化疗药物(如蒽环类抗生素等)主要通过损伤白血病细胞DNA达到治疗目的[1],白血病细胞应对DNA损伤的高效修复能力是造成其耐药的主要因素[2]。因此,研究白血病细胞DNA损伤修复机制对于白血病的有效治疗具有重要意义[3]。
DNA损伤应答(DNA damage response,DDR)是真核生物识别细胞DNA损伤,并根据损伤的严重程度进行DNA损伤修复,最终促进细胞衰老或凋亡的复杂过程。当细胞遭受内源性或外源性因素刺激后,会造成一定程度的DNA损伤。单链或双链DNA损伤被特定的感知复合物所识别,进而招募下游激活蛋白,如:共济失调毛细血管扩张RAD3相关蛋白(ATR)或共济失调毛细血管扩张突变蛋白(ATM),诱导其定位到损伤位置,随后组蛋白H2A变体(H2AX)发生磷酸化,下游一系列DDR信号通路被激活。在正常情况下,机体可通过直接修复(direct repair,DR)、碱基切除修复(base excision repair,BER)等5种修复方式修复损伤的DNA链;然而严重的DNA损伤可造成细胞毒性,细胞无法通过以上方式修复DNA,将出现周期停滞、老化或凋亡[4]。
乳腺癌缺失因子1(deleted in breast cancer 1, DBC1)又称为细胞周期和凋亡调节蛋白2(cell cycle and apoptosis regulator protein 2,CCAR2),是小GTP酶类Rho家族的非典型成员[5]。研究[6]结果表明,DBC1在细胞生长过程中与多种物质相互作用,参与调节细胞的衰老、代谢、凋亡和应激反应等多种生理活动。同时,DBC1可以结合并调节多种DNA损伤反应因子,如沉默信息调节因子同源类似物1(silent mating type information regulation 2 homolog 1,SIRT1)[7],组蛋白去乙酰化酶3(histone deacetylase 3, HDAC3)[8]等,这提示DBC1间接参与到细胞的DDR中。研究[9]报道,在紫外线照射、γ-射线照射或依托泊苷(etoposide,vp16)处理后,DBC1可通过ATM/ATR-DBC1-SIRT1-p53这一信号途径参与细胞DDR。另有研究[10]发现,DBC1可通过同源重组(homologous recombination, HR)修复途径参与DNA修复机制的激活,而下调DBC1可导致细胞周期的停滞。因此,DBC1在细胞DDR中发挥重要作用。
既往关于DBC1的研究主要集中在实体瘤,如肝癌[11]等,其表达与临床分期、预后相关。但DBC1在血液肿瘤,特别是其在白血病DDR中的作用还不明确。因此,设计以下实验拟探究DBC1在白血病细胞DNA损伤修复中的作用,以期发现抗白血病细胞耐药的新方法。
1 材料与方法
1.1 试剂与仪器 单核细胞白血病细胞系THP1、髓系白血病细胞系K562、Kasumi和KG1、急性早幼粒细胞系NB4、T淋巴细胞白血病细胞系Jurkat、B淋巴细胞白血病细胞系Nalm6、Burkitt淋巴瘤细胞系Namalwa 共8种白血病及淋巴瘤细胞系均为同济大学附属同济医院血液学实验室保存。RPMI-1640培养基、IMDM培养基、胎牛血清(FBS)均购自美国Gibco公司; RNA提取试剂盒、逆转录试剂盒、实时荧光定量(qRT)-PCR试剂盒均购自日本TaKaRa公司;蛋白质裂解液、上样缓冲液、蛋白质标志物均购自上海雅酶生物科技有限公司;质粒大量提取试剂盒购自德国Qiagen公司;快速质粒小量提取试剂盒购自北京天根生化科技有限公司;凋亡检测试剂盒购自美国eBioscience公司;细胞周期检测试剂盒、凋亡试剂盒购自美国BD公司;DBC1抗体、c-MYC抗体、乳腺癌易感基因1(BRAC1)蛋白质抗体、DNA依赖性蛋白激酶催化亚基(catalytic subunit of the DNA-dependent protein kinase, DNA-PKcs)抗体、β-actin抗体均购自美国Abcam公司;γ-H2AX抗体、抗鼠二抗、抗兔二抗均购自美国Cell Signaling Technology公司;荧光显微镜购自日本Olympus公司;单细胞凝胶电泳分析试剂盒和单细胞凝胶电泳仪均购自美国Trevigen公司;荧光定量PCR仪(LightCycler 96)购自美国罗氏公司;流式细胞仪(cyto FLEX LX)购自美国BD公司。
1.2 细胞系的常规培养 K562细胞系采用IMDM培养基,添加10% FBS、100 U/mL青霉素和100 mg/L链霉素,置于37 ℃、含体积分数为0.05的 CO2培养箱中培养。THP1、Kasumi、KG1、NB4、Jurkat、Nalm6和Namalwa细胞系均采用RPMI-1640培养基,添加10% FBS、100 U/mL青霉素和100 mg/L链霉素,置于37 ℃、含体积分数为0.05的CO2培养箱中培养。每2 d更换1次培养基,取对数生长期细胞用于实验。
1.3 DBC1在白血病及淋巴瘤细胞系中表达的检测
1.3.1 qRT-PCR检测DBC1 mRNA表达 检测8个细胞系中DBC1 mRNA的表达。应用日本TaKaRa公司的RNA提取试剂盒抽取细胞RNA并逆转录成cDNA,随后应用LightCycler 96进行qRT-PCR检测。采用两步法行DNA扩增,95 ℃ 5 s变性,60 ℃ 34 s退火延伸,循环40次。实验重复3次。所用引物序列:DBC1正向引物5’-ATG TCC CAG TTT AAG CGC CAG-3’,反向引物5’-CCC AAA GTA GTC ATG CAA GCT G-3’。GAPDH正向引物5’-AAC ATC ATC CCT GCC TCT ACT-3’,反向引物5’-CCG ACG CCT GCT TCA C-3’。
1.3.2 蛋白质印迹法(Western blot)检测DBC1蛋白质的表达 检测8个细胞系中DBC1蛋白质的表达。在待测细胞中加入蛋白质裂解液,提取细胞蛋白质,采用BCA法测定细胞蛋白质浓度。加入上样缓冲液制备蛋白质样品,配置电泳浓缩胶和分离胶。上样后90 V、2 h电泳,220 mA、2 h转膜,经5% 牛血清白蛋白(BSA)封闭、对应蛋白质一抗孵育、二抗孵育后使用Amersham Imager 600显影,Image J 15.3进行蛋白质条带灰度分析。
1.4 慢病毒构建及K562细胞转染 采用RNA干扰(RNAi)技术构建稳定的DBC1基因沉默细胞系。DBC1核心干扰序列参照文献[12],短发夹RNA(shRNA)具体序列见表1。合成好的序列经退火融合成双链,连接至PLVX-shRNA 慢病毒质粒载体(日本TaKaRa公司)。经纯化、测序鉴定后获得目的质粒。将PLVX-shRNA慢病毒质粒与2种辅助质粒 VSVG、delta 89按10∶5∶7的比例混合后滴于融合度约为60%的293T细胞悬液中,48 h及72 h后收取病毒液,获得阴性对照(SCR)病毒和DBC1干扰(DBC1-sh1和DBC1-sh2)病毒。根据感染复数计算所需病毒量,在处于对数生长期的K562细胞中分别加入适量SCR病毒(SCR组)、DBC1-sh1病毒(DBC1-sh1组)、DBC1-sh2病毒(DBC1-sh2组)。采用2 000 r/min,离心半径7.6 cm,离心2 h,转染K562细胞。蛋白质印迹法检测3组细胞DBC1表达,验证下调效率。
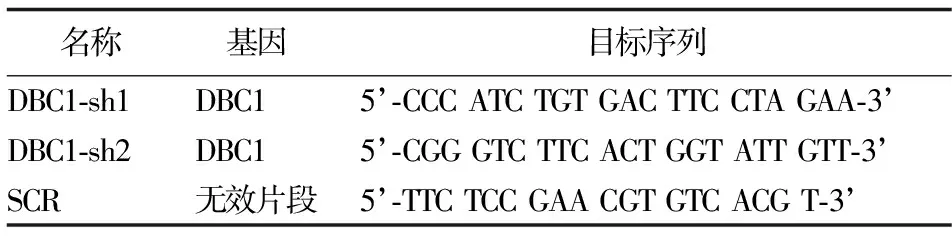
表1 shRNA序列
1.5 药物处理造成细胞DNA损伤 收集对数生长期SCR组、DBC1-sh1组和DBC1-sh2组细胞,PBS洗涤2次后,用细胞培养基调整细胞浓度至1×106/mL。按1 mL/L剂量在细胞悬液中加入浓度为20 mmol/L的vp16。混匀后,将细胞悬液加至6孔板或24孔板中,每组细胞3个复孔,常规培养4 h。并进行以下实验。
1.5.1 溴脱氧核苷尿嘧啶(BrdU)核酸掺入实验检测细胞周期分布 在vp16处理前后分别检测各组细胞的细胞周期。将培养48 h的细胞密度调整至1×106/mL,每组3个复孔,按照1∶1 000加入3 mg/L BrdU,培养2 h后收集各组细胞。边涡旋边滴入70%的乙醇重悬细胞,-20 ℃孵育过夜。次日用染色缓冲液[含1%FBS的PBS,0.09%三氮化钠(NaN3)]洗涤2次后将细胞重悬于2 mL 2 mol/L HCl和0.5% Triton X-100中,室温孵育30 min。染色缓冲液洗涤后加入500 μL 0.1 mol/L的四硼酸钠(Na2B4O7)重悬细胞2 min,洗涤后用100 μL染色缓冲液重悬,加入抗-BrdU-异硫氰酸荧光素(FITC)5 μL,室温避光孵育45 min。加入5 μL碘化丙啶(PI),室温避光孵育5 min。加入400 μL 染色缓冲液重悬后使用流式细胞仪检测,使用FlowJo v10分析各组细胞周期。
1.5.2 克隆形成实验检测细胞增殖能力 在vp16处理前后,分别将SCR组、DBC1-sh1组和DBC1-sh2组细胞稀释至1×105/mL。将2×RPMI-1640培养基、FBS和1.2%软琼脂按照3∶2∶5的比例混合配制下层胶,将2×RPMI-1640、FBS、1.2%软琼脂和无菌水按照6∶4∶5∶5的比例混合配制上层胶备用。在6孔板中每孔加入1.5 mL下层胶,4 ℃冰箱中放置15 min。然后将1 mL上层胶和100 μL细胞悬液混匀,加入到6孔板中,37 ℃培养箱中放置30 min,4 ℃冰箱中放置15 min后转移至37 ℃培养箱中培养,观察1周左右。每组细胞3个复孔,实验重复2次。期间,每3 d补充适量新鲜培养液。7~10 d后于显微镜下观察集落形成情况,细胞数>50/集落则为阳性集落。各组细胞克隆形成能力的差异即为各组细胞增殖能力的差异。
1.5.3 流式细胞术检测细胞凋亡水平 在vp16处理前后分别进行此实验。每组至少收集1×105个细胞,用结合缓冲液洗涤2次后加入100 μL重悬。在细胞悬液中加入5 μL膜联蛋白V (Annexin V),室温避光10 min,加入5 μL PI,室温避光5 min后加入400 μL结合缓冲液重悬,使用流式细胞仪检测,FlowJo v10分析各组细胞凋亡水平。
1.5.4 DNA损伤相关和非同源性末端接合(non-homologous end joining,NHEJ)途径关键蛋白质的检测 γ-H2AX 的形成是 DNA 双链断裂的标志,在vp16处理前后,采用蛋白质印迹法检测各组细胞γ-H2AX 的表达水平。在vp16处理后采用蛋白质印迹法检测BRAC1、DNA-PKcs、c-MYC的表达水平。使用Image J 1.53进行蛋白质条带灰度分析。
1.5.5 单细胞凝胶电泳实验检测vp16处理后细胞DNA损伤程度 在vp16处理后,将各组细胞浓度调整为1×105/mL。在沸水中溶解低熔点琼脂糖,将50 μL 溶解后的低熔点琼脂糖和10 μL细胞悬液混合,轻弹混匀后加在玻片圆槽处。将玻片放入4 ℃冰箱凝固30 min,放入裂解缓冲液中4 ℃过夜。将玻片浸入50 mL 解螺旋液漂洗2次,随后浸入预冷的解螺旋液中1 h。电压21 V,电泳30 min。将玻片用无菌水漂洗2次后放入70%乙醇中浸没5 min。将玻片置于37 ℃烘箱晾干10~15 min。每个圆槽加入100 μL SYBR Gold,避光染色30 min。短暂沥水后,将玻片放置在37 ℃烘箱内完全晾干。使用荧光显微镜拍照,细胞损伤越严重,电泳拖尾越明显,尾部DNA含量越高。应用Comet Assay Ⅳ软件分析每组细胞DNA损伤程度。
1.6 Kaplan-Meier生存分析 髓系白血病患者中DBC1的mRNA表达情况,以及患者生存信息均经癌症基因组图谱(TCGA) 肿瘤数据库 (https://cancergenome.nih.gov/)及其分析门户网站(http://www.cbioportal.org/) 检索下载。

2 结 果
2.1 DBC1在白血病细胞系尤其是K562细胞高表达 qRT-PCR发现,以DBC1 mRNA相对表达量最低的THP1细胞为对照,THP1、Namalwa、Jurkat、Nalm6、NB4、KG1、Kasumi和K562细胞的DBC1 mRNA相对表达量分别为1.00±0.00、2.47±1.03、3.31±1.61、4.48±2.53、5.71±1.68、9.10±1.10、9.83±0.42、10.84±0.78。DBC1 mRNA在髓系白血病细胞系KG1、Kasumi、K562中相对表达量均显著高于THP1细胞(P值均<0.05),且在K562细胞系中表达量最高。蛋白质印迹法检测THP1、Namalwa、Jurkat、Nalm6、NB4、KG1、Kasumi和K562细胞的DBC1蛋白质,其相对表达量依次为0.28±0.05、0.49±0.04、0.51±0.07、0.63±0.02、0.68±0.15、1.00±0.01、1.10±0.12、1.73±0.02。KG1、Kasumi、K562细胞的DBC1相对表达量均显著高于THP1细胞(P值均<0.05)。见图1。
泳道 1 THP1 2 KG1 3 Nalm6 4 Jurkat5 Namalwa 6 K562 7 Kasumi 8 NB4图1 蛋白质印迹法检测各血液肿瘤细胞系中DBC1蛋白质表达情况
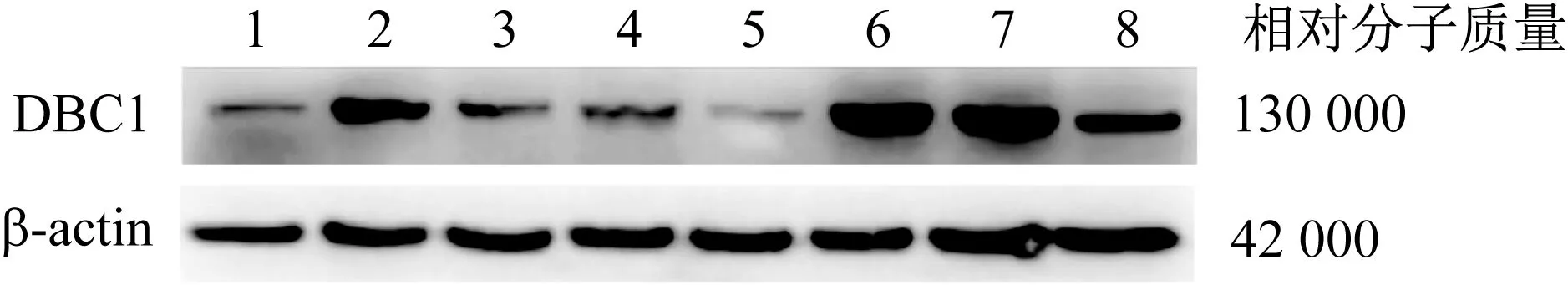
2.2 DBC1表达与髓系白血病患者生存率的关系 检索TCGA肿瘤数据库,获得173例髓系白血病患者DBC1表达水平与生存情况数据。绘制生存曲线,通过log-rank检验分析DBC1 与总体生存率(overall survival, OS) 的关系,DBC1高表达的患者生存率显著低于低表达的患者 (P=0.012 2),见图2。
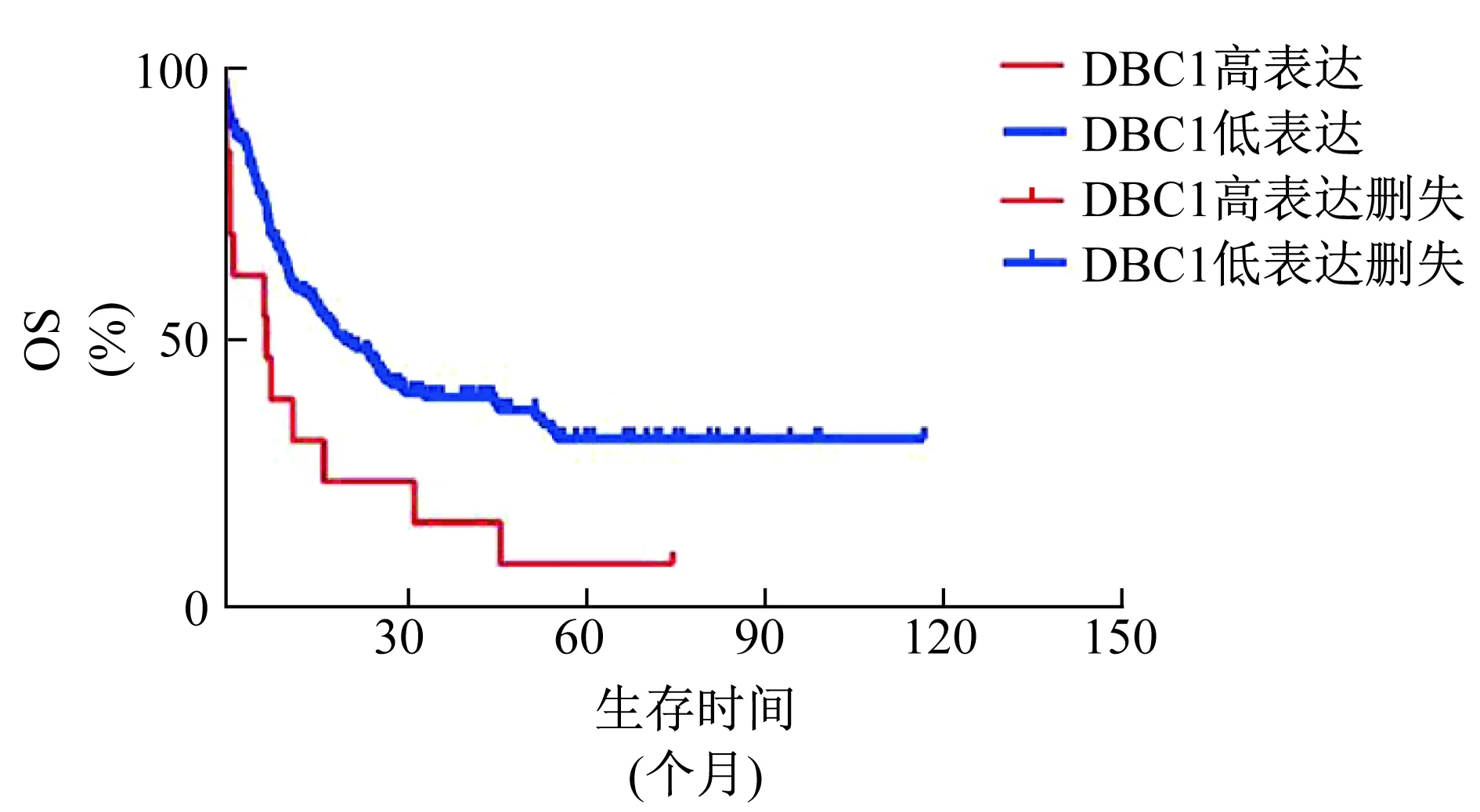
图2 生存曲线分析TCGA肿瘤数据库中DBC1表达水平与髓系白血病患者OS之间的关系
2.3 慢病毒转染K562并验证下调效率 为进一步研究DBC1基因在髓系白血病细胞中的生物学功能,本实验选择DBC1表达较高的髓系白血病细胞K562构建DBC1基因的shRNA的干扰载体。SCR组、DBC1-sh1组和DBC1-sh2组的DBC1相对表达量分别为0.77±0.05、0.07±0.01和0.30±0.13,两干扰组的DBC1相对表达量均显著低于对照组(P值均<0.05)。见图3。表明成功建立了稳定下调DBC1的髓系白血病细胞株。
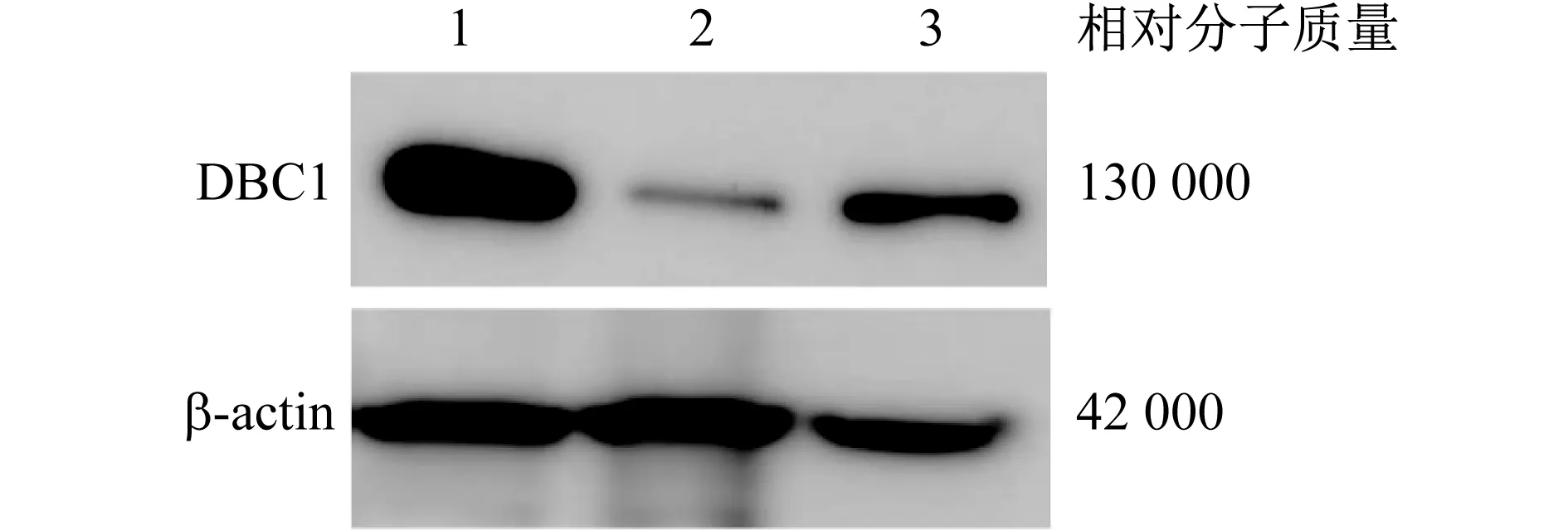
1 SCR 2 DBC1-sh1 3 DBC1-sh2图3 蛋白质印迹法检测shRNA DBC1慢病毒感染后DBC1蛋白质表达情况
2.4 下调DBC1表达后,药物处理对 K562细胞细胞周期的影响 vp16处理前,DBC1-sh1组和DBC1-sh2组与SCR组细胞的细胞周期停滞的差异均无统计学意义(P值均>0.05)。而用vp16处理4 h造成细胞DNA损伤后,DBC1-sh1组和DBC1-sh2组的S期细胞百分比均显著高于SCR组(P值均<0.05),G2/M期细胞百分比均显著低于SCR组(P值均<0.05)。见图4和表2。
2.5 下调DBC1表达后,药物处理对K562细胞的克隆形成能力的影响 vp16处理前,DBC1-sh1组、DBC1-sh2组与SCR组形成的克隆大小均无明显差异, 而vp16处理造成细胞DNA损伤后,DBC1-sh1组和DBC1-sh2组细胞形成的克隆大小较SCR组明显减小,见图5。vp16处理前,SCR组、DBC1-sh1组和DBC1-sh2组的克隆形成数目分别为(108±8)、(96±5)和(92±4)个,差异均无统计学意义(P值均>0.05);vp16处理后,SCR组的克隆形成数目为(58±8)个, DBC1-sh1和DBC1-sh2组分别为(13±2)和(24±2)个,两干扰组克隆数目均显著少于对照组(P值均<0.05)。

表2 K562细胞各vp16处理前后细胞周期细胞百分比比较
2.6 下调DBC1后,药物处理对K562细胞凋亡的影响 vp16处理前,DBC1-sh1、DBC1-sh2和SCR组凋亡细胞百分比差异均无统计学意义(P值均>0.05)。vp16处理4 h造成细胞DNA损伤后,DBC1-sh1组凋亡细胞百分比为(38.37±0.20)%,显著高于SCR组凋亡细胞百分比[(35.21±0.58)%,P<0.05]。DBC1-sh2组凋亡细胞百分比为(35.78±0.55)%,与SCR组差异无统计学意义(P>0.05),见图6。
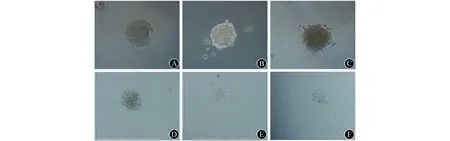
A、B、C依次为vp16处理前SCR、DBC1-sh1、DBC2-sh2组 D、E、F依次为vp16处理4 h后SCR、DBC1-sh1、DBC2-sh2组图5 各组vp16处理前后细胞克隆形成情况示意图
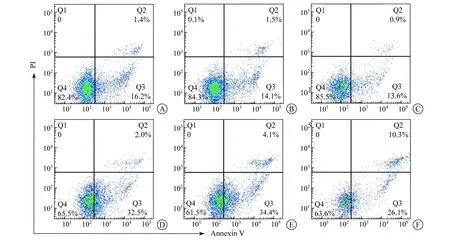
A、B、C依次为vp16处理前SCR、DBC1-sh1、DBC2-sh2组 D、E、F依次为vp16处理4 h后SCR、DBC1-sh1、DBC2-sh2组(Q2与Q3的百分数之和为凋亡细胞百分比)图6 流式细胞术检测各组细胞凋亡情况代表图
2.7 DBC1对K562细胞DNA损伤程度的影响
2.7.1 DNA损伤相关蛋白质的比较 vp16处理前,SCR、DBC1-sh1、DBC1-sh2组细胞γ-H2AX相对表达量分别为0.80±0.28、1.51±0.24和1.10±0.06;DBC1-sh1组细胞DNA损伤较SCR组加重(P<0.05)。vp16处理后,SCR、DBC1-sh1和DBC1-sh2组细胞γ-H2AX相对表达量分别为1.30±0.05、2.00±0.04和1.32±0.22;DBC1-sh1组细胞DNA损伤程度显著重于SCR组(P<0.01)。见图7。
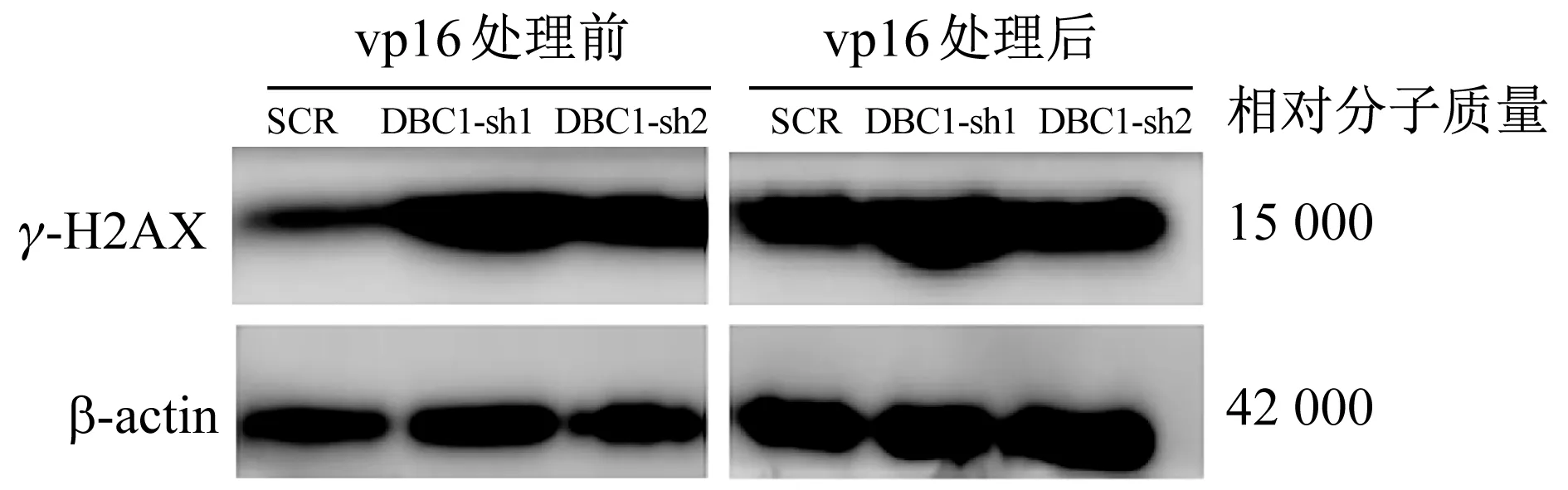
图7 vp16处理前后K562细胞γ-H2AX表达水平
2.7.2 单细胞凝胶电泳实验结果 vp16处理后,SCR、DBC1-sh1和DBC1-sh2组细胞彗尾DNA含量百分比分别为(20.21±6.65)%、(54.64±11.21)%和(39.09±15.36)%;DBC1-sh1组细胞DNA损伤程度显著重于SCR组(P<0.01)。见图8。提示下调DBC1表达的K562细胞DNA损伤修复能力明显降低。
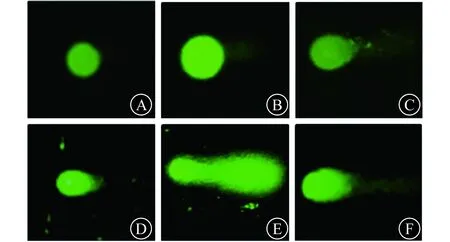
A、B、C依次为vp16处理前SCR、DBC1-sh1、DBC2-sh2组,D、E、F依次为vp16处理后SCR、DBC1-sh1、DBC2-sh2组图8 单细胞凝胶电泳实验结果
2.8 下调DBC1对K562细胞NHEJ途径关键蛋白质表达水平的影响 SCR、DBC1-sh1和DBC1-sh2组细胞的c-MYC相对表达量分别为0.79±0.00、2.00±0.04和1.36±0.17;DNA-PKcs相对表达量分别为0.26±0.04、0.55±0.16和0.48±0.07。两干扰组c-MYC和DNA-PKcs相对表达量均显著高于对照组(P值均<0.05)。DBC1-sh1和DBC1-sh2组的BRAC1相对表达量(0.29±0.13和0.31±0.12)均显著低于SCR组(0.74±0.07,P值均<0.05)。见图9。这提示下调DBC1表达影响了K562细胞NHEJ修复途径。
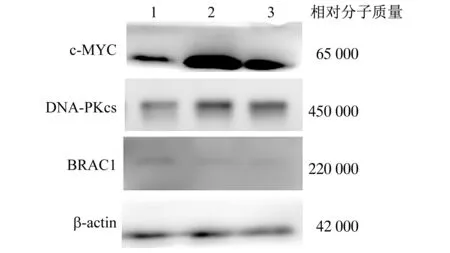
1 SCR 2 DBC1-sh1 3 DBC1-sh2图9 蛋白质印迹法检测NHEJ途径关键蛋白质表达情况
3 讨 论
DBC1在不同肿瘤中的表达存在多样性,如在肝癌[11]、胃癌[13]中呈低表达,在乳腺癌[14]、结直肠癌[15]等癌症中呈高表达。因此,DBC1在肿瘤形成和发展中的作用十分复杂。本研究通过查询数据库,利用Kaplan-Meier生存分析发现,DBC1在髓系白血病患者中异常高表达,且高表达者预后不良。这提示DBC1可能作为促癌基因参与髓系白血病,并且是潜在的独立预后因子。
白血病细胞在受到DNA损伤时常具有较强的修复能力,这使得细胞对化疗药物耐受。有效地干预白血病细胞DNA修复系统,可在很大程度上改善白血病常规化疗的疗效和疾病的预后,这也是目前白血病DDR研究的热点。本研究采用DBC1高表达的髓系白血病细胞系K562,构建DBC1表达下调的慢病毒稳定转染细胞株。结果发现,在经化疗药物vp16处理造成细胞DNA损伤后,K562细胞周期被阻滞于S期,细胞增殖能力下降,凋亡增加。单细胞凝胶电泳实验表明,下调DBC1的K562细胞DNA损伤程度显著重于对照组细胞。蛋白质印迹法显示,DNA损伤标志物γ-H2AX表达上调。这提示DBC1下调后,细胞的DNA损伤修复能力减弱。
细胞NHEJ修复直接通过将DNA双链断裂末端连接来介导修复,发生在整个细胞周期。哺乳动物体内的DNA双链断裂的修复以NHEJ方式为主[16]。Ku蛋白[17]、DNA-PKcs[18]、BRAC1[19]、c-MYC[20]等多种蛋白因子参与NHEJ修复途径[21]。为了探究DBC1对K562细胞NHEJ修复通路的影响,本研究采用蛋白质印迹法检测了NHEJ关键蛋白的表达水平变化。为了探究DBC1是否会影响细胞NHEJ修复,本研究采用蛋白质印迹法检测了NHEJ关键基因转录的蛋白质表达情况。结果显示,BRAC1在DBC1下调组表达显著降低,DNA-PKcs、c-MYC表达显著升高。表明下调DBC1降低了K562细胞NHEJ修复能力。
综上所述,本研究证实DBC1参与髓系白血病细胞系K562的DDR,初步明确了其作用机制,为提高白血病的化疗效果提供了潜在靶点和新思路。尽管本文初步阐释了DBC1在K562细胞系DDR中的作用,然而髓系白血病中与DBC1直接或间接作用的分子尚不清楚,有待进一步研究。
