清肝化瘀颗粒对不同性别大鼠的长期毒性研究
2022-03-13朱晓燃索菲娅杨振寰姚树坤
朱晓燃,索菲娅,杨振寰,姚树坤
(1. 北京中医药大学,北京 100029;2. 中日友好医院,北京 100029)
原发性肝癌(简称肝癌)是世界范围内第六大常见癌症,其恶性程度较高,年发病率居我国恶性肿瘤发病率的第4位,死亡率已上升至第2位[1]。肝癌起病隐匿,大多数患者在发现时已进展至中晚期,失去手术机会,又因肝功能或免疫功能差无法耐受放疗或化疗,故治疗效果与预后均不理想,因此,继续探索与研发有效的肝癌治疗策略很有必要。传统中医药治疗癌症具有独特的优势,可有效缓解患者临床症状,提高治疗效果,减轻放化疗的毒副反应,改善生活质量,延长生存期等[2]。因此,当下探寻一种疗效可靠稳定、可耐受的中药复方制剂让更多患者受益至关重要。清肝化瘀颗粒组方是姚树坤教授根据多年临床经验,从肝癌的发病及病因病机特点出发创制的有效经验方,主要由黄芩、苦参、半枝莲、白花蛇舌草、三棱、莪术、白术和甘草组成,具有清热解毒、祛瘀散结、健脾益气等功效,本课题组前期实验明确了该方主要有效组分是氧化苦参碱类、黄芩苷类、莪术醇类,对各类肿瘤均具有明确的抗肿瘤、抑制细胞增殖作用[3-5]。本课题组综合利用现代制药新技术、新设备、先进的分离纯化手段,优选了最佳提取方案及制剂成型工艺,制备了稳定、可靠的清肝化瘀颗粒干膏粉[6],为使该制剂更好地投入于临床,笔者进行了长期毒性实验研究以评价其长期使用的安全性,现将结果报道如下。
1 实验材料与方法
1.1实验动物 160只SPF级SD大鼠,4周龄,体重70~90 g,雌雄各半,均由北京维通利华实物动物技术有限公司提供,动物合格证编号:11400700309512,饲养于中国中医科学院中药研究所动物房,屏障环境,温度20~26 ℃,相对湿度40%~70%。本实验经中国中医科学院中药研究所实验动物福利伦理委员会审查批准(20181006)。
1.2药物 清肝化瘀颗粒干膏粉由中日友好医院药学部提供(批号:20170731,含量:4.472 g生药/g干膏粉),使用时用实验动物饮用水配置成黄棕色混悬液,现用现配。
1.3仪器 德国Sartorius BSA323S-CW电子天平,德国Sigma 3-18K高速冷冻离心机,德国Siemens CLINITEK Status,德国SIEMENS ADVIA 2120全自动血液分析仪,日本东芝40FR全自动生化测试仪,美国EasyLyte PLUS Na+/K+/Cl-analyzer,北京普利生Precil C2000-4血凝仪,英国Shandon Excelsior ES全自动脱水机、Shandon Histocentre 3石蜡包埋机,Shandon Finesse 325切片机,Shandon Varistain Gemini全自动染色机,日本OLYMPUS BX51显微镜及图像分析系统等。
1.4实验方法 适应期结束称重进行分组,分性别按体重分层随机分为4组,每组40只,雌雄各半。前期实验表明清肝化瘀颗粒干膏粉可配制的最高浓度为0.86 g/mL干膏粉;急性毒性试验LD50为69.9 g/kg生药,95%可信限为63.5~81.0 g/kg生药。本实验清肝化瘀颗粒低、中、高剂量组分别给予1.95 g/kg、3.90 g/kg、7.80 g/kg(相当于人临床剂量的13,26,52倍)清肝化瘀颗粒灌胃,给药体积15 mL/(kg·次),对照组给予等体积实验动物饮用水灌胃, 每天8:00—12:00间灌胃1次,连续干预6个月(雄鼠182 d、雌鼠183 d),停药后进行1个月的恢复期观察。
1.5观察及检测指标
1.5.1一般状态 给药期内每次给药时观察大鼠的一般状况,包括毛色、活动、步态、神态、饮水、进食、大便、尿液等,观察有无中毒症状发生及发生的时间和持续时间、恢复情况,记录死亡或濒死情况;恢复期每天观察1次。实验及恢复期间每周称1次未进食大鼠体重并记录。
1.5.2尿液检查 分别在给药中期(第91天)、给药末期(雄鼠第182天、雌鼠第183天)及恢复期(灌胃结束后第28天),每组随机选取1/4、2/3及剩余1/3的大鼠(雌雄各半)进行检测。将待测大鼠单只放入代谢笼中,禁食,自由饮水,收集15~16 h尿液,观察尿液的颜色和澄清度,检测尿pH、尿比重、尿蛋白、尿糖、尿隐血、尿胆原、尿酮体、尿白细胞数。
1.5.3血液常规及血清生化学指标 各组大鼠尿液收集完毕后,将大鼠取出,称禁食体重,用0.8%戊巴比妥钠生理盐水溶液以6 mL/kg腹腔注射进行麻醉,腹主动脉采血检测血液常规及血清生化学指标。血液常规指标包括红细胞计数(RBC)、血细胞比容(HCT)、平均红细胞容积(MCV)、血红蛋白(Hb)、平均红细胞血红蛋白(MCH)、平均红细胞血红蛋白浓度(MCHC)、血小板计数(Plt)、白细胞计数(WBC)、淋巴细胞百分比(LYM%)、中性粒细胞百分比(NEUT%)、嗜酸性粒细胞百分比(EOS%)、嗜碱性粒细胞百分比(BASO%)、单核细胞百分比(MONO%)、网织红细胞计数(RET)、凝血酶原时间(PT)和活化部分凝血活酶时间(APTT)。血清生化学指标包括天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、肌酸磷酸激酶(CK)、尿素(UREA)、肌酐(Cr)、总蛋白(TP)、白蛋白(ALB)、血糖(GLU)、总胆红素(TBil)、总胆固醇(TC)、三酰甘油(TG)、γ-谷氨酰转肽酶(GGT)及钠离子(Na+)、钾离子(K+)、氯离子(Cl-)。
1.5.4脏器系数及组织病理学观察 腹主动脉采血后处死各组大鼠,肉眼观察脑、甲状腺、肺及支气管、心脏、肝脏、脾脏、肾脏、肾上腺、睾丸、附睾、卵巢、子宫、胃、十二指肠、小肠、大肠、膀胱等是否有异常情况。摘取心、肝、脾、肾、肾上腺、胸腺、脑、卵巢、子宫、睾丸、附睾等主要脏器[称重后计算脏器指数(g脏器/100 g体重)]及所有大体观察到异常的组织、组织肿块,迅速置于10%福尔马林溶液中固定,石蜡包埋,切片,苏木精-伊红(HE)染色后光镜下观察。本实验先进行对照组及清肝化瘀颗粒高剂量组的病理检查,如果清肝化瘀颗粒高剂量组的上述脏器切片检查未见与受试物毒性有关的病理变化,则清肝化瘀颗粒中、低剂量组的上述器官和组织只用10%福尔马林固定,以保留标本;如果清肝化瘀颗粒高剂量组某脏器出现了与受试物毒性有关的病理变化,则进行相应脏器清肝化瘀颗粒中、低剂量组的病理检查。

2 结 果
2.1各组大鼠一般状况、体重变化 给药期及停药后恢复期,各组大鼠均无死亡,其饮水、进食、活动、步态等均基本正常,鼻、眼无异常分泌物,未见呼吸困难等异常改变,未见呕吐、腹泻等胃肠道反应。清肝化瘀颗粒各组雄性大鼠体重在给药期及恢复期虽较对照组有所降低,但仅清肝化瘀颗粒高剂量组在给药7 d明显低于对照组(P<0.05),其余时间各组组间比较差异均无统计学意义(P均>0.05),见表1;清肝化瘀颗粒各组雌性大鼠体重在给药期和恢复期与对照组比较差异均无统计学意义(P均>0.05)。
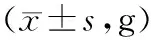
表1 对照组和清肝化瘀颗粒各组雄性大鼠给药期间及停药后恢复期体重比较

续表
2.2各组大鼠尿液指标变化 给药期及恢复期,各组大鼠的尿量均正常;清肝化瘀颗粒各组给药期间可见个别大鼠尿液颜色加深,停药后恢复。给药第91天,清肝化瘀颗粒高剂量组雄性大鼠尿酮体较对照组明显升高(P<0.05),清肝化瘀颗粒中剂量组雌性大鼠尿蛋白量较对照组明显降低(P<0.05);给药末期,清肝化瘀颗粒低剂量组雄性大鼠尿酮体、尿蛋白量及清肝化瘀颗粒低、高剂量组雄性大鼠尿白细胞计数均较对照组明显降低(P均<0.05);灌胃结束后第28天,各组大鼠尿液指标均正常。各组大鼠给药第91天和给药末期尿液指标见表2~4。
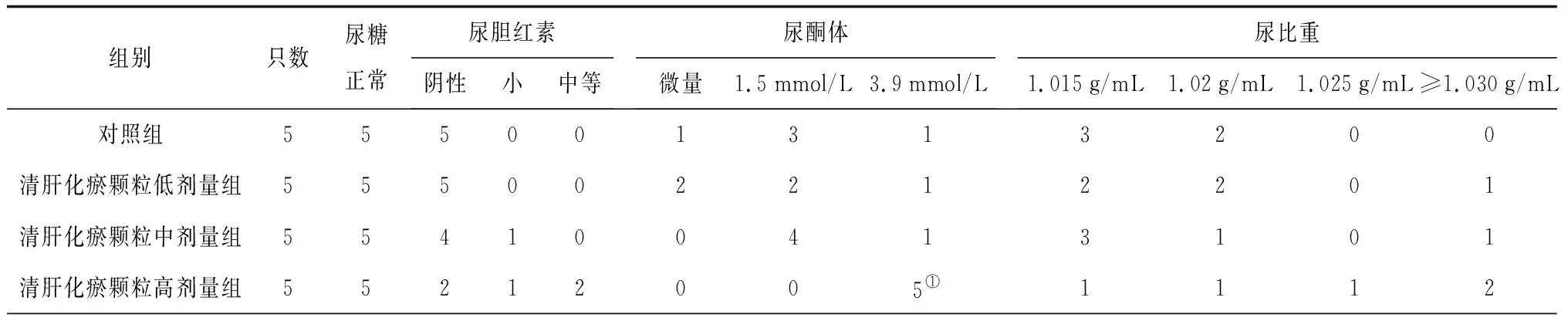
表2 对照组和清肝化瘀颗粒各组雄性大鼠给药第91天尿液指标比较 只
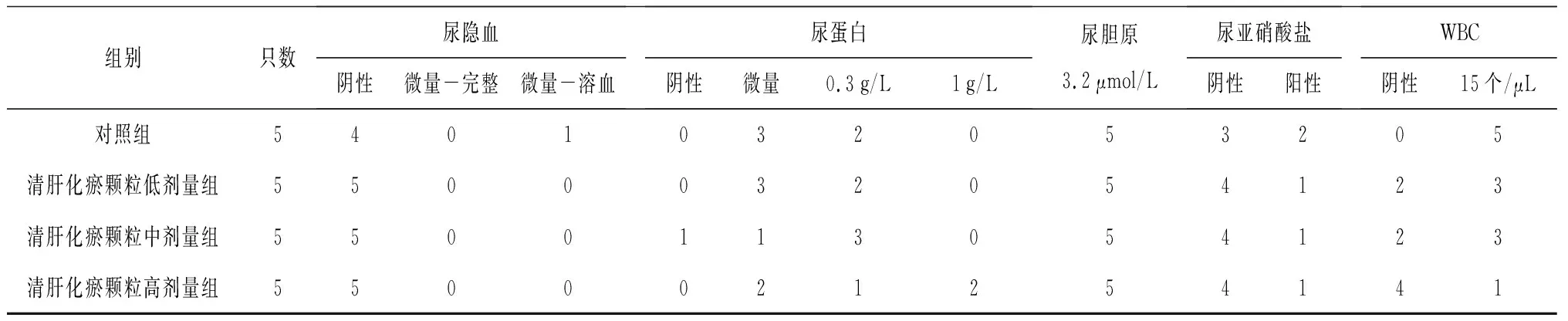
组别只数尿隐血阴性微量-完整微量-溶血尿蛋白阴性微量0.3g/L1g/L尿胆原3.2μmol/L尿亚硝酸盐阴性阳性WBC阴性15个/μL对照组5401032053205清肝化瘀颗粒低剂量组5500032054123清肝化瘀颗粒中剂量组5500113054123清肝化瘀颗粒高剂量组5500021254141

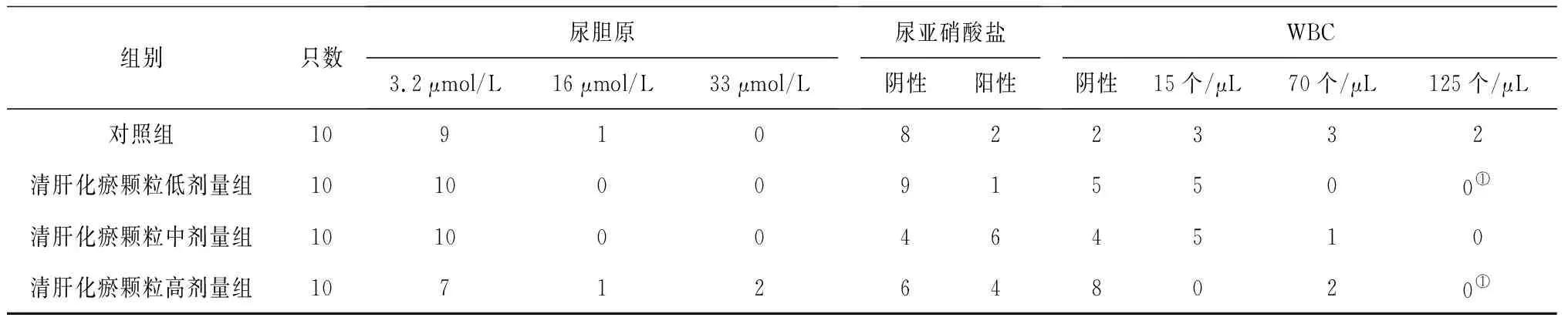
表3 对照组和清肝化瘀颗粒各组雄性大鼠给药末期尿液指标比较 只
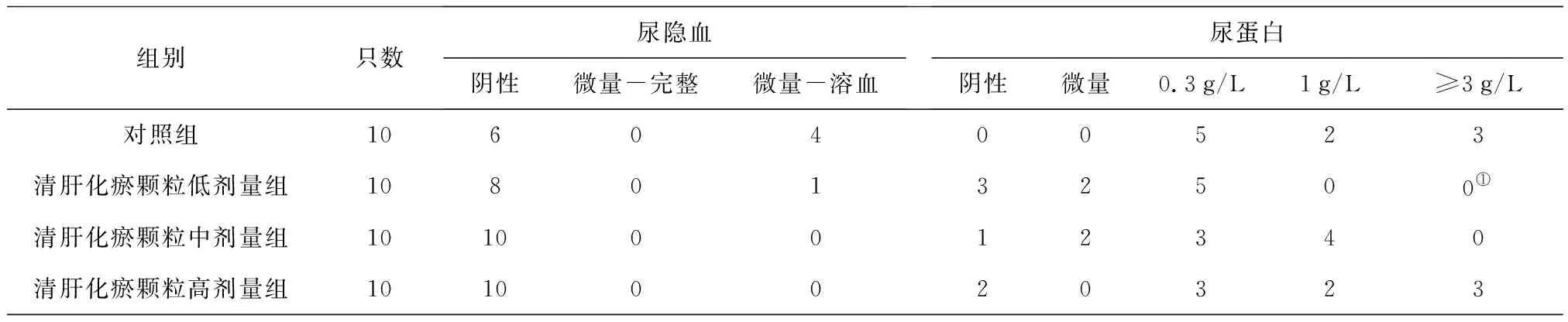
组别只数尿隐血阴性微量-完整微量-溶血尿蛋白阴性微量0.3g/L1g/L≥3g/L对照组1060400523清肝化瘀颗粒低剂量组1080132500①清肝化瘀颗粒中剂量组10100012340清肝化瘀颗粒高剂量组10100020323
续表

表4 对照组和清肝化瘀颗粒各组雌性大鼠给药第91天尿液指标比较 只
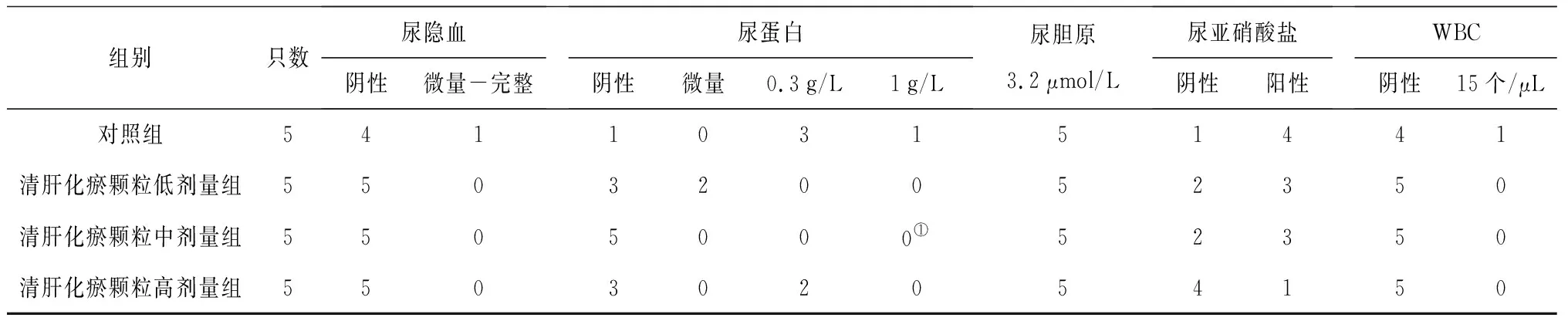
组别只数尿隐血阴性微量-完整尿蛋白阴性微量0.3g/L1g/L尿胆原3.2μmol/L尿亚硝酸盐阴性阳性WBC阴性15个/μL对照组541103151441清肝化瘀颗粒低剂量组550320052350清肝化瘀颗粒中剂量组5505000①52350清肝化瘀颗粒高剂量组550302054150
2.3各组大鼠血液常规指标变化 给药第91天和灌胃结束后第28天,各组大鼠血液常规指标均正常。给药末期,清肝化瘀颗粒低、中剂量组雄性大鼠RBC计数、清肝化瘀颗粒中剂量组雄性大鼠HCT和Hb水平、清肝化瘀颗高剂量组雌性大鼠RBC和Hb水平均明显低于对照组(P均<0.05),清肝化瘀颗高剂量组雌性大鼠MCV明显高于对照组(P<0.05)。见表5及表6。

表5 对照组和清肝化瘀颗粒各组雄性大鼠给药末期血液常规指标比较
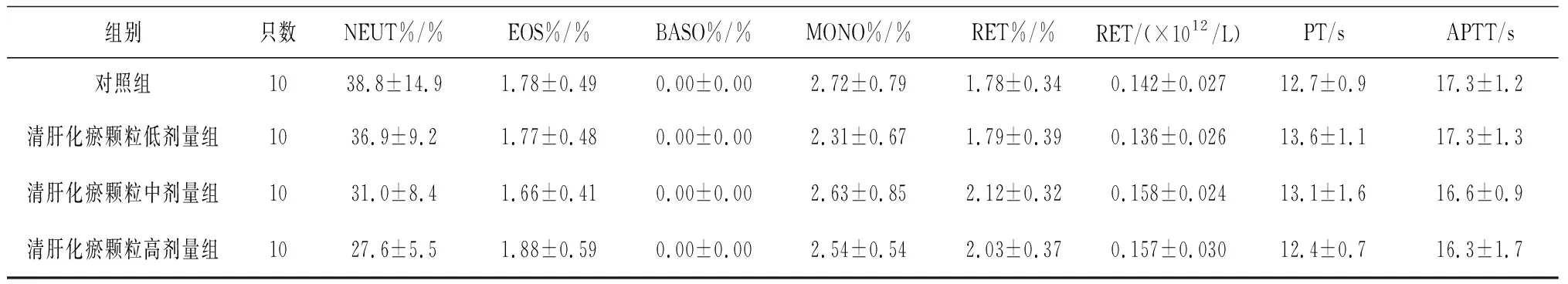
组别只数NEUT%/%EOS%/%BASO%/%MONO%/%RET%/%RET/(×1012/L)PT/sAPTT/s对照组1038.8±14.91.78±0.490.00±0.002.72±0.791.78±0.340.142±0.02712.7±0.917.3±1.2清肝化瘀颗粒低剂量组1036.9±9.21.77±0.480.00±0.002.31±0.671.79±0.390.136±0.02613.6±1.117.3±1.3清肝化瘀颗粒中剂量组1031.0±8.41.66±0.410.00±0.002.63±0.852.12±0.320.158±0.02413.1±1.616.6±0.9清肝化瘀颗粒高剂量组1027.6±5.51.88±0.590.00±0.002.54±0.542.03±0.370.157±0.03012.4±0.716.3±1.7

表6 对照组和清肝化瘀颗粒各组雌性大鼠给药末期血液常规指标比较
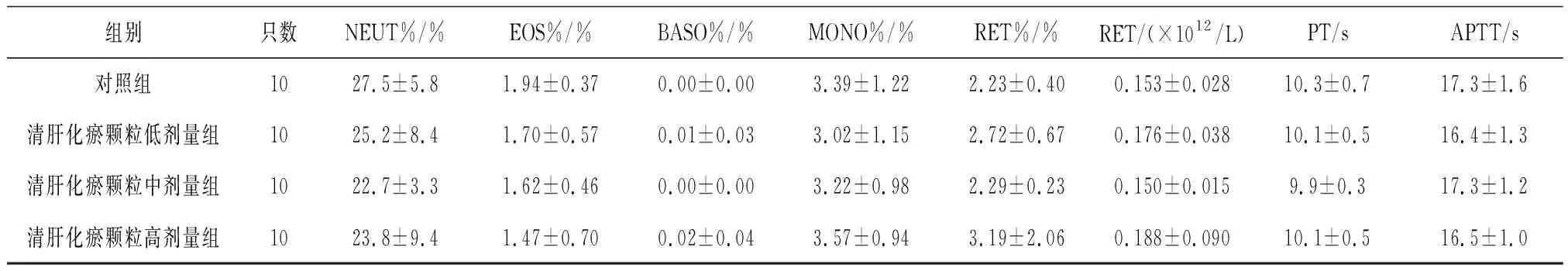
组别只数NEUT%/%EOS%/%BASO%/%MONO%/%RET%/%RET/(×1012/L)PT/sAPTT/s对照组1027.5±5.81.94±0.370.00±0.003.39±1.222.23±0.400.153±0.02810.3±0.717.3±1.6清肝化瘀颗粒低剂量组1025.2±8.41.70±0.570.01±0.033.02±1.152.72±0.670.176±0.03810.1±0.516.4±1.3清肝化瘀颗粒中剂量组1022.7±3.31.62±0.460.00±0.003.22±0.982.29±0.230.150±0.0159.9±0.317.3±1.2清肝化瘀颗粒高剂量组1023.8±9.41.47±0.700.02±0.043.57±0.943.19±2.060.188±0.09010.1±0.516.5±1.0
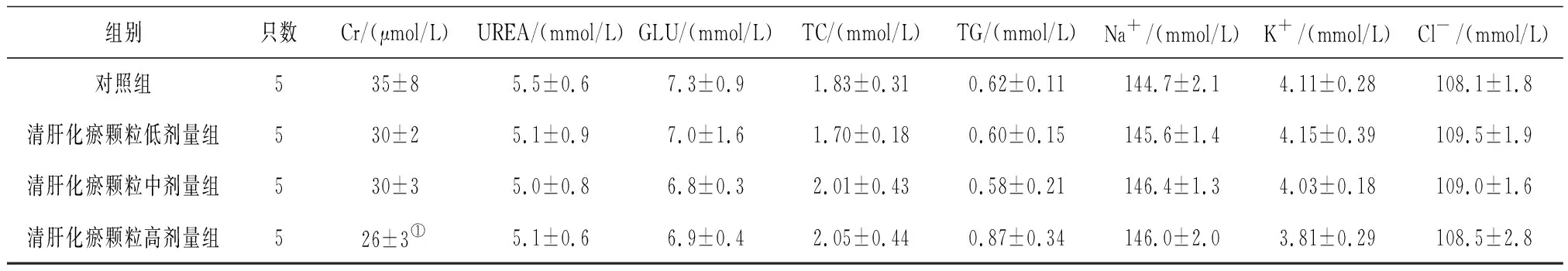
2.4各组雄性大鼠血清生化学指标变化 给药第91天,清肝化瘀颗粒各组大鼠血清Cr水平和清肝化瘀颗粒中、高剂量组大鼠Cl-水平均明显低于对照组(P均<0.05),清肝化瘀颗粒高剂量组大鼠血清TC水平明显高于对照组(P<0.05),见表7;给药末期,清肝化瘀颗粒中、高剂量组大鼠血清Cr、Na+水平和清肝化瘀颗粒低、中剂量组大鼠GLU水平均明显低于对照组(P均<0.05),清肝化瘀颗粒高剂量组大鼠血清ALB、GGT、TC和K+水平均明显高于对照组(P均<0.05),见表8;灌胃结束后第28天,清肝化瘀颗粒高剂量组大鼠血清Cr水平明显低于对照组(P<0.05),见表9。

表7 对照组和清肝化瘀颗粒各组雄性大鼠给药第91天血清生化学指标比较
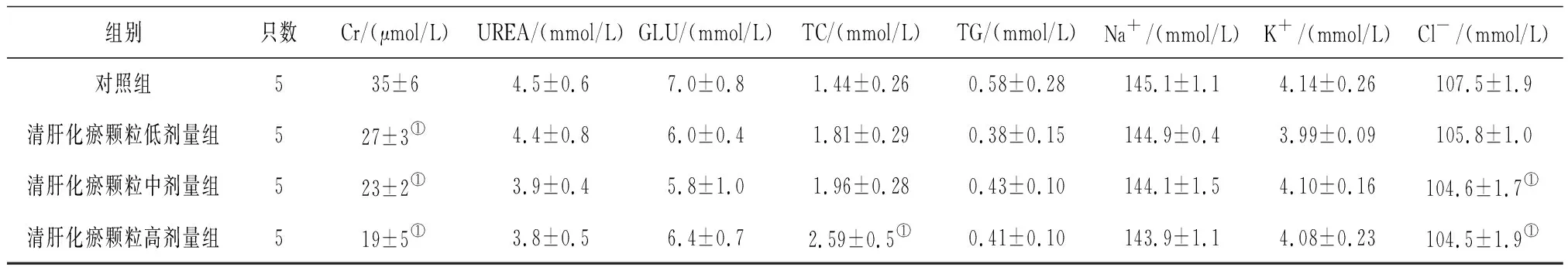
组别只数Cr/(μmol/L)UREA/(mmol/L)GLU/(mmol/L)TC/(mmol/L)TG/(mmol/L)Na+/(mmol/L)K+/(mmol/L)Cl-/(mmol/L)对照组535±64.5±0.67.0±0.81.44±0.260.58±0.28145.1±1.14.14±0.26107.5±1.9清肝化瘀颗粒低剂量组527±3①4.4±0.86.0±0.41.81±0.290.38±0.15144.9±0.43.99±0.09105.8±1.0清肝化瘀颗粒中剂量组523±2①3.9±0.45.8±1.01.96±0.280.43±0.10144.1±1.54.10±0.16104.6±1.7①清肝化瘀颗粒高剂量组519±5①3.8±0.56.4±0.72.59±0.5①0.41±0.10143.9±1.14.08±0.23104.5±1.9①

表8 对照组和清肝化瘀颗粒各组雄性大鼠给药末期血清生化学指标比较
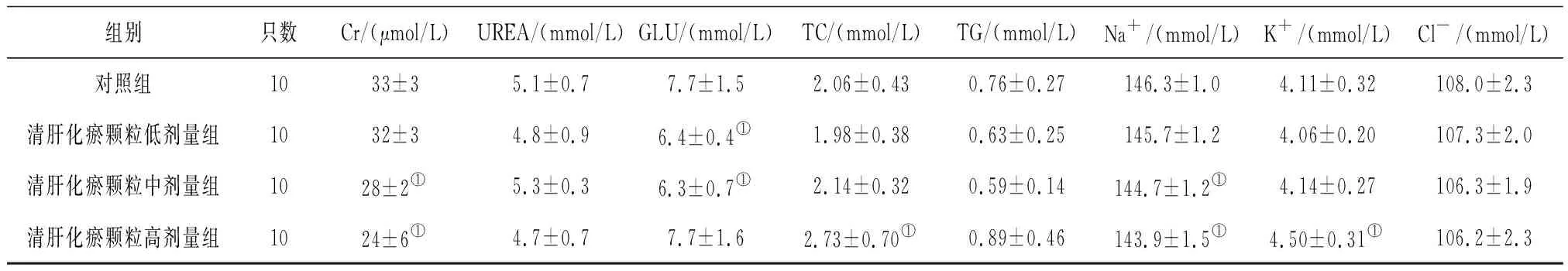
组别只数Cr/(μmol/L)UREA/(mmol/L)GLU/(mmol/L)TC/(mmol/L)TG/(mmol/L)Na+/(mmol/L)K+/(mmol/L)Cl-/(mmol/L)对照组1033±35.1±0.77.7±1.52.06±0.430.76±0.27146.3±1.04.11±0.32108.0±2.3清肝化瘀颗粒低剂量组1032±34.8±0.96.4±0.4①1.98±0.380.63±0.25145.7±1.24.06±0.20107.3±2.0清肝化瘀颗粒中剂量组1028±2①5.3±0.36.3±0.7①2.14±0.320.59±0.14144.7±1.2①4.14±0.27106.3±1.9清肝化瘀颗粒高剂量组1024±6①4.7±0.77.7±1.62.73±0.70①0.89±0.46143.9±1.5①4.50±0.31①106.2±2.3

表9 对照组和清肝化瘀颗粒各组雄性大鼠灌胃结束后第28天血清生化学指标比较
续表
2.5各组雌性大鼠血清生化学指标变化 给药第91天,清肝化瘀颗各组大鼠血清Cr水平和清肝化瘀颗高剂量组大鼠血清Cl-、Na+水平均明显低于对照组(P均<0.05),见表10;给药末期,清肝化瘀颗粒中剂量组大鼠血清GLU水平和清肝化瘀颗粒高剂量组大鼠血清TC水平均明显高于对照组(P均<0.05),清肝化瘀颗粒低、高剂量组大鼠血清Cr水平及清肝化瘀颗粒中、高剂量组大鼠血清TBil、Cl-水平和清肝化瘀颗粒高剂量组大鼠血清Na+水平均明显低于对照组(P均<0.05),见表11;灌胃结束后第28天,各组间各指标比较差异均无统计学意义(P均>0.05),见表12。

表10 对照组和清肝化瘀颗粒各组雌性大鼠给药第91天血清生化学指标比较
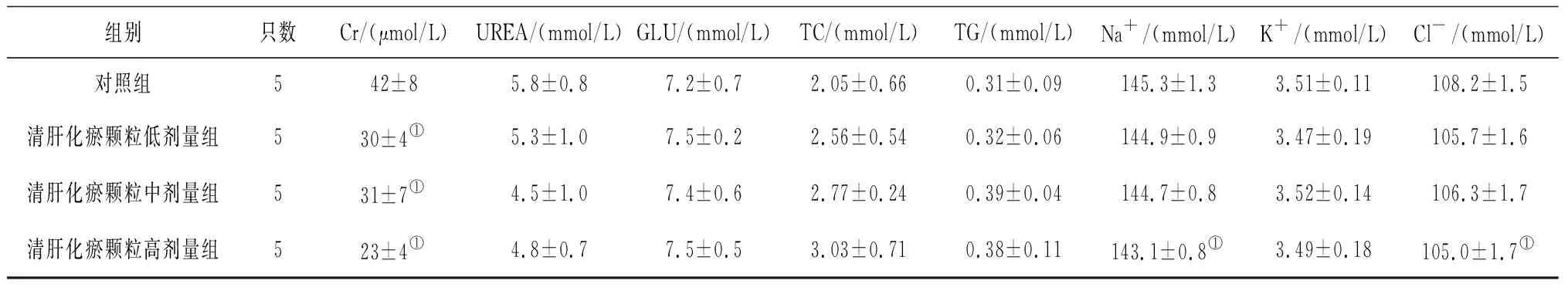
组别只数Cr/(μmol/L)UREA/(mmol/L)GLU/(mmol/L)TC/(mmol/L)TG/(mmol/L)Na+/(mmol/L)K+/(mmol/L)Cl-/(mmol/L)对照组542±85.8±0.87.2±0.72.05±0.660.31±0.09145.3±1.33.51±0.11108.2±1.5清肝化瘀颗粒低剂量组530±4①5.3±1.07.5±0.22.56±0.540.32±0.06144.9±0.93.47±0.19105.7±1.6清肝化瘀颗粒中剂量组531±7①4.5±1.07.4±0.62.77±0.240.39±0.04144.7±0.83.52±0.14106.3±1.7清肝化瘀颗粒高剂量组523±4①4.8±0.77.5±0.53.03±0.710.38±0.11143.1±0.8①3.49±0.18105.0±1.7①

表11 对照组和清肝化瘀颗粒各组雌性大鼠给药末期血清生化学指标比较
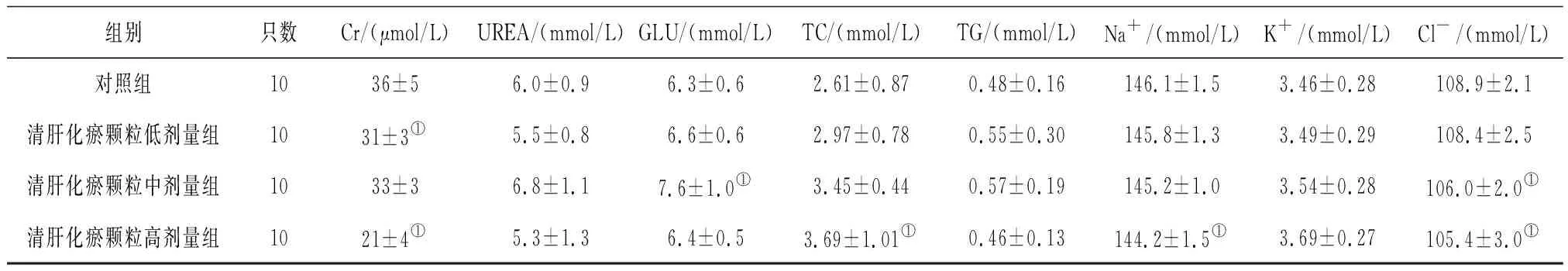
组别只数Cr/(μmol/L)UREA/(mmol/L)GLU/(mmol/L)TC/(mmol/L)TG/(mmol/L)Na+/(mmol/L)K+/(mmol/L)Cl-/(mmol/L)对照组1036±56.0±0.96.3±0.62.61±0.870.48±0.16146.1±1.53.46±0.28108.9±2.1清肝化瘀颗粒低剂量组1031±3①5.5±0.86.6±0.62.97±0.780.55±0.30145.8±1.33.49±0.29108.4±2.5清肝化瘀颗粒中剂量组1033±36.8±1.17.6±1.0①3.45±0.440.57±0.19145.2±1.03.54±0.28106.0±2.0①清肝化瘀颗粒高剂量组1021±4①5.3±1.36.4±0.53.69±1.01①0.46±0.13144.2±1.5①3.69±0.27105.4±3.0①

表12 对照组和清肝化瘀颗粒各组雌性大鼠灌胃结束后第28天血清生化学指标比较
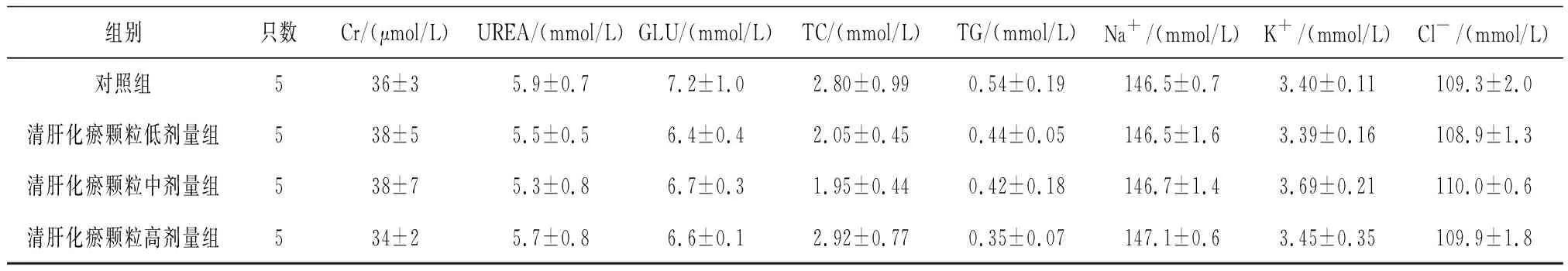
组别只数Cr/(μmol/L)UREA/(mmol/L)GLU/(mmol/L)TC/(mmol/L)TG/(mmol/L)Na+/(mmol/L)K+/(mmol/L)Cl-/(mmol/L)对照组536±35.9±0.77.2±1.02.80±0.990.54±0.19146.5±0.73.40±0.11109.3±2.0清肝化瘀颗粒低剂量组538±55.5±0.56.4±0.42.05±0.450.44±0.05146.5±1.63.39±0.16108.9±1.3清肝化瘀颗粒中剂量组538±75.3±0.86.7±0.31.95±0.440.42±0.18146.7±1.43.69±0.21110.0±0.6清肝化瘀颗粒高剂量组534±25.7±0.86.6±0.12.92±0.770.35±0.07147.1±0.63.45±0.35109.9±1.8
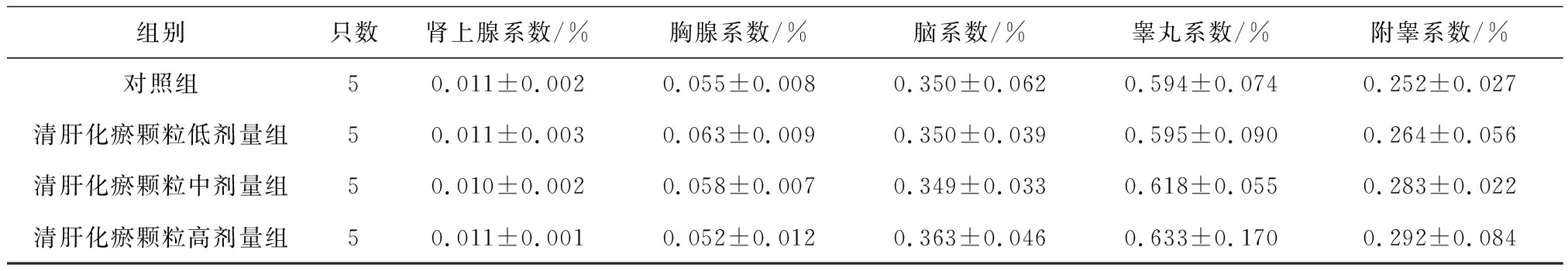
2.6各组雄性大鼠各脏器系数比较 给药第91天,清肝化瘀颗粒中、高剂量组大鼠肝脏系数、肾脏系数均明显高于对照组(P均<0.05),其中肝脏系数显示出一定的剂量效应关系,见表13;给药末期,清肝化瘀颗粒中、高剂量组大鼠肝脏系数和清肝化瘀颗粒高剂量组肾脏系数均明显高于对照组(P均<0.05),且肝脏系数显示出一定的剂量效应关系,见表14;灌胃结束后第28天,清肝化瘀颗粒高剂量组大鼠肾脏系数和肺脏系数均明显高于对照组(P均<0.05),见表15。

表13 对照组和清肝化瘀颗粒各组雄性大鼠给药第91天各脏器系数比较
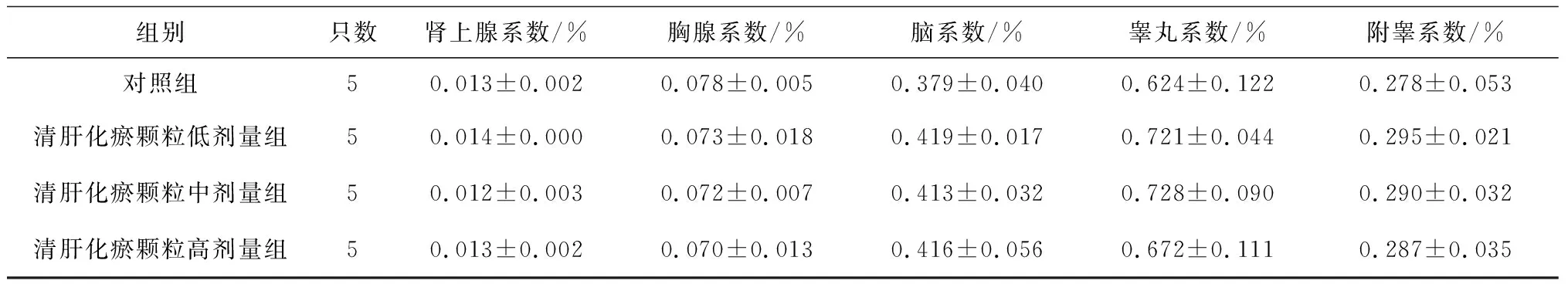
组别只数肾上腺系数/%胸腺系数/%脑系数/%睾丸系数/%附睾系数/%对照组50.013±0.0020.078±0.0050.379±0.0400.624±0.1220.278±0.053清肝化瘀颗粒低剂量组50.014±0.0000.073±0.0180.419±0.0170.721±0.0440.295±0.021清肝化瘀颗粒中剂量组50.012±0.0030.072±0.0070.413±0.0320.728±0.0900.290±0.032清肝化瘀颗粒高剂量组50.013±0.0020.070±0.0130.416±0.0560.672±0.1110.287±0.035

表14 对照组和清肝化瘀颗粒各组雄性大鼠给药末期各脏器系数比较
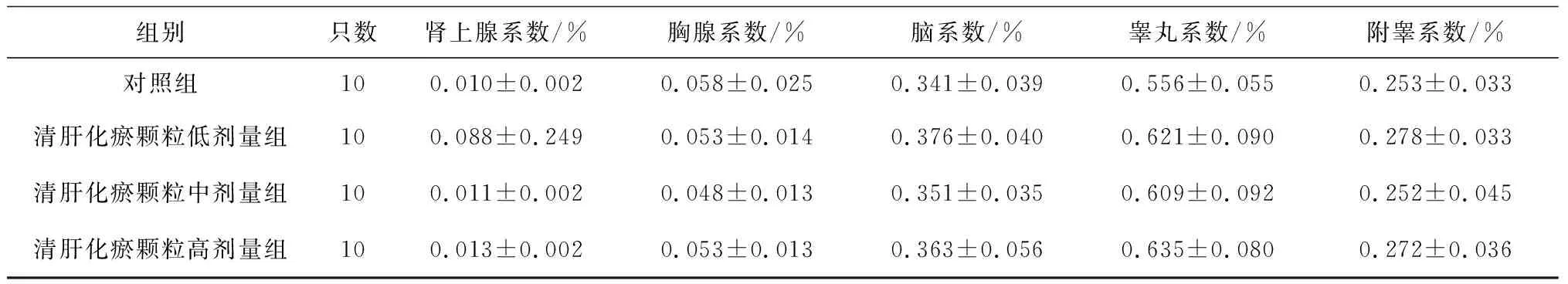
组别只数肾上腺系数/%胸腺系数/%脑系数/%睾丸系数/%附睾系数/%对照组100.010±0.0020.058±0.0250.341±0.0390.556±0.0550.253±0.033清肝化瘀颗粒低剂量组100.088±0.2490.053±0.0140.376±0.0400.621±0.0900.278±0.033清肝化瘀颗粒中剂量组100.011±0.0020.048±0.0130.351±0.0350.609±0.0920.252±0.045清肝化瘀颗粒高剂量组100.013±0.0020.053±0.0130.363±0.0560.635±0.0800.272±0.036

表15 对照组和清肝化瘀颗粒各组雄性大鼠灌胃结束后第28天各脏器系数比较
续表
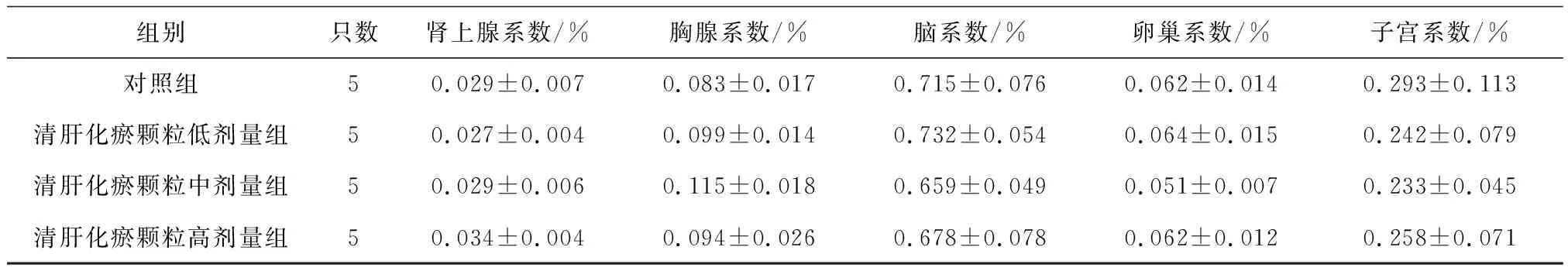
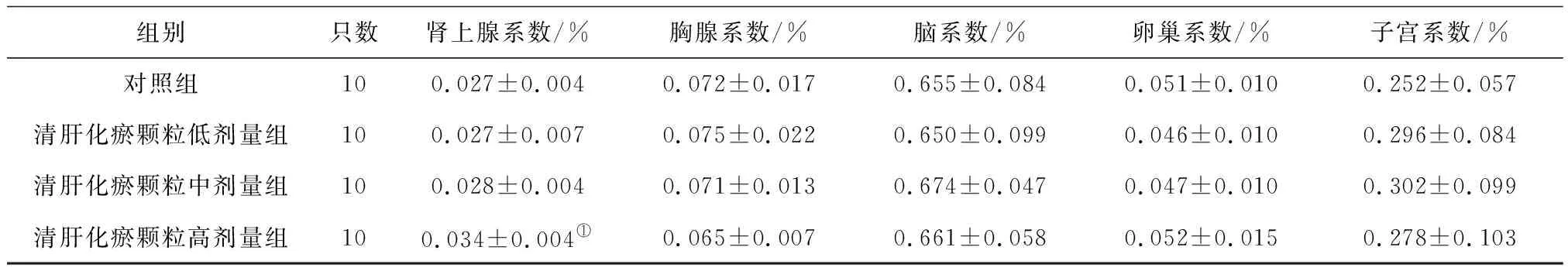
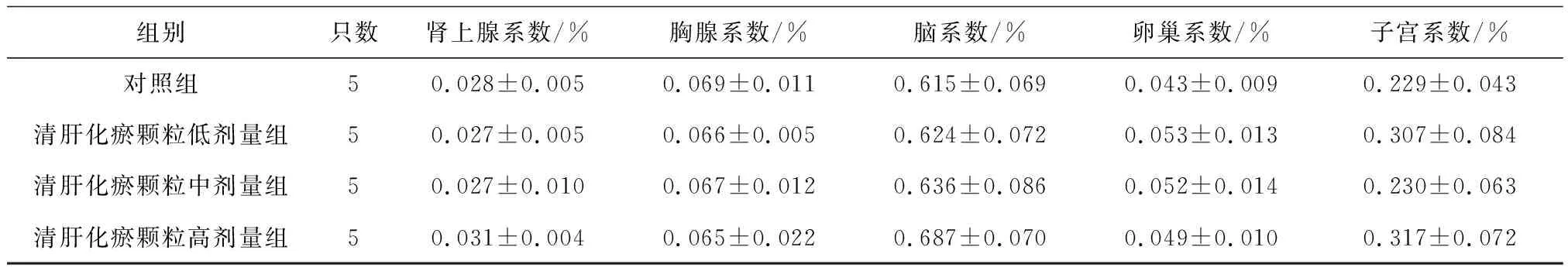
2.6各组雌性大鼠各脏器系数比较 给药第91天,清肝化瘀颗粒各组大鼠肝脏系数和清肝化瘀颗粒高剂量组大鼠肾脏系数均明显高于对照组(P均<0.05),肝脏系数呈剂量依赖性增高,见表16;给药末期,清肝化瘀颗粒中、高剂量组大鼠肝脏系数、肾脏系数和清肝化瘀颗粒高剂量组肾上腺系数均明显高于对照组(P均<0.05),见表17;灌胃结束后第28天,清肝化瘀颗粒高剂量组大鼠肾脏系数明显高于对照组(P<0.05),见表18。

表16 对照组和清肝化瘀颗粒各组雌性大鼠给药第91天各脏器系数比较
组别只数肾上腺系数/%胸腺系数/%脑系数/%卵巢系数/%子宫系数/%对照组50.029±0.0070.083±0.0170.715±0.0760.062±0.0140.293±0.113清肝化瘀颗粒低剂量组50.027±0.0040.099±0.0140.732±0.0540.064±0.0150.242±0.079清肝化瘀颗粒中剂量组50.029±0.0060.115±0.0180.659±0.0490.051±0.0070.233±0.045清肝化瘀颗粒高剂量组50.034±0.0040.094±0.0260.678±0.0780.062±0.0120.258±0.071

表17 对照组和清肝化瘀颗粒各组雌性大鼠给药末期各脏器系数比较
组别只数肾上腺系数/%胸腺系数/%脑系数/%卵巢系数/%子宫系数/%对照组100.027±0.0040.072±0.0170.655±0.0840.051±0.0100.252±0.057清肝化瘀颗粒低剂量组100.027±0.0070.075±0.0220.650±0.0990.046±0.0100.296±0.084清肝化瘀颗粒中剂量组100.028±0.0040.071±0.0130.674±0.0470.047±0.0100.302±0.099清肝化瘀颗粒高剂量组100.034±0.004①0.065±0.0070.661±0.0580.052±0.0150.278±0.103

表18 对照组和清肝化瘀颗粒各组雌性大鼠灌胃结束后第28天各脏器系数比较
组别只数肾上腺系数/%胸腺系数/%脑系数/%卵巢系数/%子宫系数/%对照组50.028±0.0050.069±0.0110.615±0.0690.043±0.0090.229±0.043清肝化瘀颗粒低剂量组50.027±0.0050.066±0.0050.624±0.0720.053±0.0130.307±0.084清肝化瘀颗粒中剂量组50.027±0.0100.067±0.0120.636±0.0860.052±0.0140.230±0.063清肝化瘀颗粒高剂量组50.031±0.0040.065±0.0220.687±0.0700.049±0.0100.317±0.072
2.7各组大鼠脏器组织病理学变化
2.7.1解剖时大体观察 给药第91天,清肝化瘀颗粒各组大鼠的体表和脏器组织均未见明显异常;给药末期,4组各有1只大鼠发生皮下肿物;灌胃结束后第28天,清肝化瘀颗粒高剂量组1只大鼠发生皮下肿物。镜下见皮下肿物主要由腺体和纤维结缔组织构成,均为乳腺纤维腺瘤,未见剂量-毒性关系,且肿物界清、有包膜,细胞异型性及核分裂相不明显,未见恶性变的特征。
2.7.2给药第91天镜下观察 对照组和清肝化瘀颗粒低剂量组大鼠肝脏组织未见弥漫性肝细胞肿胀,清肝化瘀颗粒中剂量组4只(雌性1只、雄性3只)、清肝化瘀颗粒高剂量组5只(雌性2只、雄性3只)可见肝细胞弥漫性轻微肿胀,见图1。清肝化瘀颗粒高、中、低剂量组各有4只、4只、1只雌性大鼠脾脏内含铁血黄素沉积轻微增加,且清肝化瘀颗粒中、高剂量组沉积更明显,见图2;对照组、清肝化瘀颗粒高剂量组雌性大鼠未见肾上腺束状带增生。对照组、清肝化瘀颗粒高剂量组雄性大鼠未见脾脏含铁血黄素的增加及甲状腺腺泡增生。
2.7.3给药末期镜下观察 对照组和清肝化瘀颗粒低剂量组大鼠肝脏组织未见弥漫性肝细胞肿胀,清肝化瘀颗粒高剂量组10只(雄性和雌性各5只)和清肝化瘀颗粒中剂量组7只(雌性4只,雄性3只)大鼠可见肝细胞弥漫性肿胀,病变程度表现出一定的剂量-时间效应关系,见图3。对照组和清肝化瘀颗粒中、低剂量组各有1只雄性大鼠脾脏内含铁血黄素沉积轻微增加,清肝化瘀颗粒高剂量组5只雄性大鼠脾脏内含铁血黄素沉积增加(3只轻微增加,2只轻度增加);清肝化瘀颗粒高剂量组5只雄性大鼠可见甲状腺腺泡轻微增生,病变程度表现出一定的剂量-时间效应关系,见图4。对照组3只(均为轻微)、清肝化瘀颗粒高剂量组9只(3只为轻微、6只为轻度)、清肝化瘀颗粒中剂量组9只(4只为轻微、5只为轻度)、清肝化瘀颗粒低剂量组7只(6只为轻微、1只为轻度)雌性大鼠脾脏内含铁血黄素沉积增加,病变程度表现出一定的剂量-时间效应关系,见图5;清肝化瘀颗粒高剂量组7只雌性大鼠可见肾上腺束状带轻微增生,病变程度表现出一定的剂量-时间效应关系,见图6。
2.7.4灌胃结束后第28天观察 各组大鼠肝细胞及肾上腺束状带均正常,雄性大鼠脾脏内含铁血黄素沉积已恢复,对照组3只、清肝化瘀颗粒高剂量组5只、清肝化瘀颗粒中剂量组4只、清肝化瘀颗粒低剂量组3只雌性大鼠脾脏内含铁血黄素沉积轻微增加,见图7;清肝化瘀颗粒高剂量组4只雄性大鼠甲状腺腺泡轻微增生,见图8。
3 讨 论
长期毒性试验是新药投入临床前进行安全性评价的重要内容,需以临床为导向,根据其所治疗疾病的病理过程,设计研究周期及观察指标[7]。本实验研究分别以清肝化瘀颗粒低、中、高(相当于临床量的13,26,52倍)剂量给予大鼠连续灌胃6个月进行毒性观察,实验过程中未见动物死亡,体重及摄食量、尿量及饮水量均未见有统计学差异的持续性变化;清肝化瘀颗粒高剂量组大鼠给药6个月后尿酮体、尿蛋白及血RBC、HCT、Hb、TC、GGT、Cr、TBil、GLU、Na+、K+、Cl-出现变化,但其变化属于在正常范围内波动,且停药恢复28 d后各项指标与对照组比较均未见有临床意义的改变,故认为无明确的毒理学意义[8]。随着清肝化瘀颗粒中、高剂量组主要脏器系数的增加,清肝化瘀颗粒高剂量组可见与受试药物相关的肝脏、脾脏、甲状腺和肾上腺的病理改变,清肝化瘀颗粒中剂量组亦可见与脾脏相关的病理改变,但病变程度均较轻;停药恢复28 d后除清肝化瘀颗粒高剂量组雄性大鼠的甲状腺仍可见腺泡轻微增生外,其余脏器未见明显的毒性损伤。
综合上述研究结果,认为清肝化瘀颗粒长期应用时无明显不良影响剂量为17.44 g生药/kg,相当于临床拟用剂量的26倍。
利益冲突:所有作者均声明不存在利益冲突。
