超高效液相色谱-串联质谱法测定红曲类保健品中的桔青霉素
2022-03-13林腾奕陈思敏罗欣阳姚泽平
林腾奕,陈思敏,罗欣阳,姚泽平
(广东省食品检验所(广东省酒类检测中心),广东广州 510435)
红曲在我国生产和使用的历史悠久,在李时珍的《本草纲目》中就有记录,现已被广泛应用于食品、医药领域。其在生长过程中能产生多种生理活性物质,作用为降血脂、调节免疫、抗微生物活性、降低胆固醇、抗肿瘤等,所以以红曲为原料的保健食品受到市场欢迎。但1995 年法国Blanc 发现紫红曲菌CBS 10907 和红曲菌Van Tieghen,隶属于红曲菌株,其能产生具有肾毒性和会导致畸、癌作用的真菌毒素桔青霉素,红曲产品的质量安全引起了各国的关注,并且相关研究在逐渐增多。桔青霉素(Citrinin)是由红曲霉和多种青霉丝状霉菌通过代谢产生的真菌毒素,主要存在于常见粮食作物里如谷物、大米、玉米等,分子式为CH1O(结构式见图1),不仅具有抑菌作用,同时还会对人畜造成明显的肝、生殖、肾毒性。除此以外,桔青霉素(Citrinin)还能和赭曲霉毒素、展青霉素等毒素发生协同作用,增加人畜感染率。由于毒性,各国对于其限量都有严格限制,如日本红曲色素里的桔青霉素限值为0.2 mg/kg;美国食品药品管理局提出,食品添加剂中的红曲色素必须检测桔青霉素,符合质量要求的才能添加入食品中;一些欧洲国家在拟定关于中国出口红曲的标准,必须鉴定产生红曲霉的菌株,并且桔青霉素的含量必须进行检测,达到要求的红曲产品才能在欧洲进口和销售。综上所述,我国红曲出口的瓶颈是桔青霉素,准确检测红曲中桔青霉素的量值是一个亟待解决的问题。
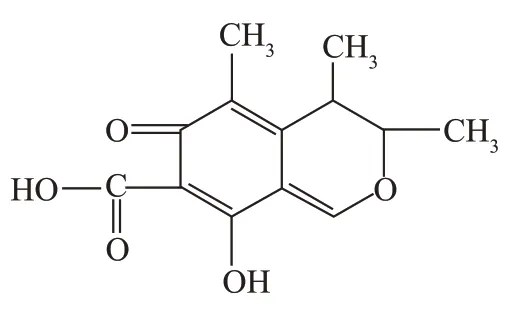
图1 目标化合物的结构式
根据国食药监许[2010]2 号通知,申请以红曲为原料的保健食品注册,须提供红曲菌株和红曲米原料的桔霉素检测报告。桔青霉素的分析检测方法主要有荧光分光光度法、薄层色谱法(TLC)、高效液相色谱法(HPLC)、酶联免疫测定法(ELISA)和高效毛细管电泳法(HPCE)等。上述方法灵敏度较低,而保健食品的样品成分繁多且复杂,例如含有多种结构的功效成分,杂峰较多,难以保证数值的准确性,而且采用上述方法进行检测回收率低。目前保健食品桔青霉素的检测,都是依据企标来检验,存在操作不规范且种类繁多,无法有效的检测出产品中的准确含量。而国标和《保健食品检验与评价技术规范》(2003年版)都只使用荧光检测器,只能用保留时间来判定是否为桔青霉素,很容易因为样品杂峰多影响定性。国标里的前处理方法是使用免疫亲和柱,虽然有较好的净化效果,但价格较高,前处理时间长,大批量检测时效率低。本研究查询文献,用70 %甲醇水提取后用HLB固相萃取小柱净化,运用超高效液相色谱-串联质谱检测红曲产品中的桔青霉素。该方法检测时间短、检测成本低、定量准确、可操作性强,增加保健食品的安全性、有效性和可靠性。
1 材料与方法
1.1 材料、试剂及仪器
红曲样品:某品牌产品,市售。
试剂及耗材:桔青霉素标准品10 mg,纯度为>99 %,购自Pribolab;实验用乙腈(lc-ms)购自德国Merck;乙酸铵(色谱纯)购自美国fisher 公司;甲酸购自阿拉丁,水为超纯水。
仪器设备:AB Sciex Triple Quad™4500 质谱系统、三重四级杆串联质谱仪(美国SCIEX)含ESI 源和APCI 源,analyst 色谱工作站;ika 涡旋混合器;高速离心机;分析天平;氮吹仪;微纤维滤纸,hlb小柱。
1.2 试验方法
1.2.1 标准溶液的配制
准确称取一定量的桔青霉素标准品,用甲醇溶解,配成浓度为100 μg/mL 的标准储备液,于4 ℃下保存,吸取储备液用乙腈-水(V∶V=3∶7)溶液配制成5个标准浓度的工作溶液,配制的工作溶液浓度分别为5 ng/mL、10 ng/mL、20 ng/mL、50 ng/mL、100 ng/mL。空白样品确定不含任何上述的成分,用空白样品提取液稀释配制成不同浓度的标准溶液,以评价基质效应的影响。
1.2.2 样品前处理
样品提取:精密称取样品粉末1.00 g,置于50 mL离心管中,加甲醇-水(70∶30)5 mL,高速振荡提取2 min,8500 r/min 离心3 min,微纤维滤纸过滤取2 mL,加纯水稀释至15 mL,振摇1 min,静置2 min,即得提取液。
样品净化:移取上述提取液,调节压力使溶液以每秒1~2 滴的速度通过HLB 柱,直至2~3 mL空气通过柱体,再以3 mL 水淋洗,直至2~3 mL 空气通过柱体,弃去流出液。加入5.0 mL 甲醇洗脱,收集洗脱液于玻璃试管中,于40 ℃下氮气吹至干后,用1 mL 乙腈+水(3∶7)溶解残渣,0.22 μm 微孔滤膜过滤供检测用。
1.2.3 检测参数
1.2.3.1 色谱条件
色谱柱:ACQUITY UPLC BEH C(2.1×100 mm,1.7 μm)美国waters 公司;柱温:35 ℃;流动相B:含有0.1%甲酸的乙腈溶液,流动相C:含有0.1%甲酸的水溶液;色谱梯度洗脱条件:0~1.50 min,70%B;1.50~4.50 min,70 %~95 %B;4.50~6.00 min,95%B;6.00~6.50 min,90%~70%B;6.50~8.0 min,70%B;进样量:1 μL;流速为0.3500 mL/min。
1.2.3.2 质谱条件
可加热的ESI 离子源;正离子模式检测;扫描方式是MRM(多反应监测模式);气帘气压力(CUR):35.0,雾化温度(TEM):500,雾化气压力:50,碰撞气压力(CAD):6,离子喷雾电压:5500 V,其他质谱参数见表1。

表1 桔青霉素的多反应监测参数
2 结果与分析
2.1 仪器条件的优化
2.1.1 质谱条件的考察
采用20 ng/mL 待测化合物标准溶液,分别在正、负离子模式下进行全扫描对比,桔青霉素在正离子模式响应下较高。优化去簇电压,碰撞电压,让母离子的响应达到最高,使用子离子模式筛选响应最好的2 个子离子,并且运用反应监测模式优化出最适合子离子产生的碰撞能量。根据欧盟2002/657/EC 号决议中关于残留物分析方法定性确证的要求(见表2),化合物的质谱定性离子必须出现,至少应包括一个母离子和两个子离子。此外,定性离子和定量离子的相对丰度比与浓度相当的标准溶液比,要在允许的偏差范围内,才判定为样品中含有桔青霉素。

表2 定性时相对离子丰度的最大允许偏差
2.1.2 色谱条件的优化
本研究采用同样浓度的标准溶液分别考察了0.1 %甲酸水和甲醇;0.1 %甲酸水和乙腈;0.1 %甲酸水和0.1 %甲酸乙腈;0.01 mol/L 乙酸铵和0.1 %甲酸乙腈作为流动相,对桔青霉素的峰型及灵敏度的影响。结果发现,由于桔青霉素在C色谱柱上保留较强,当选用甲醇做流动相时,半峰宽较大,色谱峰拖尾严重,而且洗脱时间较长。乙腈洗脱能力较甲醇强,故选用乙腈作为洗脱溶剂。接着比较乙腈-0.1%甲酸水溶液,0.1%甲酸水和0.1%甲酸乙腈和0.01 mol/L 乙酸铵和0.1 %甲酸乙腈作为流动相时,对目标物质灵敏度的影响,结果发现,选用0.1 %甲酸水为流动相,能够显著增加桔青霉素的响应值,可能是甲酸流动相能够增强羧基的电离,有助于离子化效率的提高。而0.1%甲酸乙腈调节pH 系统,改善峰形,增加化合物在色谱柱里面的保留。另外,使用0.01 mol/L 乙酸铵的流动相目标峰附近会出现杂峰,影响定性。因此,最终选用0.1%甲酸水和0.1%甲酸乙腈溶液为流动相进行分析。
桔青霉素的分子结构中有两个羧基,极性较强,经过比较不同型号的色谱柱,本研究最终采用ACQUITY UPLC BEH C用于后续的方法学建立和有效性确证实验。
2.2 净化方式的选择
红曲类保健品基质非常复杂,含有大量的色素、磷脂、硬脂酸、添加剂等,复杂的样品基质给净化带来了困难。桔青霉素分子结构中存在两个羧基,极性较大。采用固相萃取净化手段,分别使用桔青霉素免疫亲和柱和HLB 进行前处理,结果发现两者的回收率相差不大,因此选择前处理更为简便的HLB前处理。
2.3 基质效应考察
取阴性样品,经“1.2.2”方法处理后,得到空白基质提取净化液,用此基质提取净化液配成5~100 ng/mL 基质提取净化标准工作液。与标准品溶液对比,基质溶液中桔青霉素的响应降低,说明样品基质使得桔青霉素的离子化受到抑制,可能是溶液的离子强度影响了分析物活度系数,故本研究采用配制基质标准溶液的方法,可以较好地去除基质效应带来的干扰和影响。
以优化后的方法对目标物进行分离,见图2。

图2 标准溶液MRM色谱图
2.4 定量测定方法学考察
2.4.1 专属性考察
将标准品溶液、溶剂空白(纯甲醇)和基质空白液进样,在桔青霉素出峰位置,溶剂空白(纯甲醇)和基质空白液没有干扰,表明方法专属性符合要求。
2.4.2 方法的线性范围
在优化条件下,对6 个浓度水平的系列混合标准工作溶液进行测定。以浓度为横坐标,定量离子峰面积为纵坐标作图,在线性范围5~100 ng/mL具有良好的线性关系y=1263.33757 x+1143.95025,相关系数大于0.999。
2.4.3 检出限与定量限测定
取标准品溶液用基质空白液稀释,计算桔青霉素定量离子色谱峰的信号噪声比(s/n),结合称样量和定容体积折算,根据信噪比S/N=3 为该物质的检出限(LOD)为12.5 μg/kg,根据S/N=10 为该物质的定量限(LOQ)为37.5 μg/kg。
2.4.4 仪器精密度考察
把浓度为50 ng/mL 的基质标准溶液按照1.2.3的仪器条件持续进样6 次,用定量离子的色谱峰面积来分析仪器的相对标准偏差(relative standard deviation,RSD),RSD 为2.7 %,表明仪器精密度符合要求。
2.4.5 方法重复性考察
精密称取6 份样品,按照样品制备方法前处理,以6 份样品中桔青霉素定量离子色谱峰面积来计算相对标准偏差(relative standard deviation,RSD),RSD为2.8%,表明方法重复性较好。
2.4.6 加标回收率考察
选用阴性红曲类保健品进行回收率试验。称取保健品粉末1.0 g,添加浓度为37.5 μg/kg、87.5 μg/kg、125 μg/kg 的标准溶液,每个浓度平行2次,计算回收率(见表3)。

表3 实际样品中桔青霉素残留量回收率和相对标准偏差(n=2)
3 结论
本研究对测定红曲类保健食品中桔青霉素进行了探讨,采用较为简便的HLB 前处理法,对液质条件进行了优化,通过对方法的回收率、重复性、精密度进行数据分析,均满足要求。方法灵敏度高、重现性和线性相关性均满足要求,检出限较低就可以检测保健食品中微量的桔青霉素,增加保健食品中桔青霉素的检测方法,实验用时短可以用于批量、快速检测保健品里桔青霉素的含量。另外,桔青霉素存在伤害人体的风险,故2010 年,国家食品药品监督管理总局发布以红曲为原料保健食品产品申报与审评的通知(国食药监许[2010])2 号),增加了指标桔青霉素的测定,限量暂时制定为50 μg/kg。本文对市售常见厂商的3 批红曲类保健品进行测定,为保健食品注册样品,未检出桔青霉素。但是需要加大对市售保健食品检测量,进一步累积数据,才能开展风险评估工作。
