电解锰渣中氨氮的草酸浸取工艺及机理研究
2022-03-12刘士朋张欢欢程金科
刘士朋,张欢欢,程金科
(1.贵州大学化学与化工学院,贵阳 550025;2.贵州省高性能砼材料及成型工程技术研究中心,龙里 561200)
0 引 言
中国是世界上最大的金属锰生产地[1],产量占全球总量的94%。我国锰矿石中锰含量低,生产1 t金属锰产生9~12 t电解锰渣(electrolytic manganese residue, EMR),现存电解锰渣堆存量约为1.2亿t,且电解金属锰行业每年产生约1千万t新渣[2]。在金属锰生产过程中调节pH加入的氨水,增加电解液导电性加入的硫酸铵,其中约44%的氨氮进入电解锰渣中[3]。国内电解锰渣主要以渣场堆存的方式处置,占用大量土地,并且其中氨氮迁移性强,流动性大,若储存不当随雨水进入地下河流,对周围居民和环境危害极大[4-5]。因此,开展电解锰渣综合利用,减少氨氮污染,对节约资源、保护环境具有重要意义。
电解锰渣中氨氮污染是影响其综合利用的主要问题,如以电解锰渣为惰性填充材料,改性硫磺为粘结剂,生产混凝土[6];通过机械活化[7]、化学活化[8]和热活化[9]的方式预处理电解锰渣,激发电解锰渣活性用于生产建筑材料,由于《民用建筑工程室内环境污染控制标准》(GB 50325—2020)规定Ⅰ类民用建筑工程室内空气污染物中氨≤0.15 mg/m3,电解锰渣在混凝土或建材中掺入量较小,否则留存在建材中的氨氮缓慢释放,对环境和人体造成危害[10]。因此,脱除或固化电解锰渣中氨氮成为电解锰渣综合利用的主要难点,引起国内外学者的广泛关注。以去离子水和硫酸为电解液,用脉冲电场和柠檬酸强化氨氮浸出,浸取84 h后氨氮去除率为88.20%[11],电解时间较长、成本高;以硫酸镁和磷酸钠为沉淀剂,把氨氮以磷酸铵镁的形式固化在电解锰渣中,氨氮固化率92.4%[12],固化成本高,存在二次污染的可能;以蜜糖为碳源,培养Y1型微生物,电解锰渣经生物浸出8 d后,氨氮去除率高,达95%~99%[13],但微生物选育和优化较难,使这些方法难于产业化。
用传统水洗法去除电解锰渣中氨氮具有设备简单、操作容易和成本低等优点,已有企业开展产业化试验,但用水量大和氨氮去除率不高等问题亟须解决。本文在水洗法的基础上,提出以水为浸取剂,草酸为浸取助剂去除电解锰渣中氨氮,研究混合方式、浸取助剂种类及用量、浸出时间、液固比(mL/g)等工艺条件对电解锰渣中氨氮剩余浓度的影响,通过X射线衍射(XRD)、红外光谱(FT-IR)和X射线光电子能谱(XPS)等技术表征物质变化,通过动力学分析和热力学计算建立氨氮浸出模型并探讨浸出机理,以节约用水量和提高氨氮去除率。
1 实 验
1.1 原料及试剂
原料:电解锰渣取自贵州省铜仁市大龙经开区某电解锰金属锰厂,成分如表1、图1所示。

表1 原电解锰渣主要成分及含量Table 1 Main components and content of raw EMR

图1 原电解锰渣XRD谱Fig.1 XRD pattern of raw EMR
图1为原电解锰渣XRD谱,结合图1和表1可知,电解锰渣中主要成分是CaSO4·2H2O和SiO2,少量的(NH4)2SO4、(NH4)2HPO4和铵镁矾。
试剂:天津市致远化学试剂有限公司生产的草酸;重庆川东化工有限公司生产的硫酸;天津市科密欧化学试剂有限公司生产的十六烷基三甲基溴化铵(CTAB)。试剂均为分析纯。
1.2 试验方案
(1)原料处理:电解锰渣在80 ℃下恒温干燥72 h,用滚筒式球磨机,直径20 mm高铝型球磨珠,电解锰渣和球磨珠质量比1 ∶1下球磨4 h,过200目(75 μm)筛,密封备用。
(2)氨氮浸出:以水为浸取剂,单次试验固定电解锰渣用量为20 g,采取单因素法探讨不同浸取助剂、混合方式、浸取时间、洗涤次数的电解锰渣氨氮浸出剩余浓度,在锥形瓶中完成反应过程。采用《固体废物浸出毒性浸出方法 水平振荡法》(HJ 557—2010)进行滤渣氨氮浸出,浸出液中氨氮检测参考中国国家环境保护标准《水质 氨氮的测定 纳氏试剂分光光度法》(HJ 535—2009)。氨氮浸出率(p)按式(1)计算:
(1)
式中:c0为原电解锰渣氨氮浸出浓度,对电解锰渣做固体废弃物毒性浸出得c0=692.67 mg/L;c为浸出后电解锰渣氨氮浓度。
(3)分析方法:用布鲁克公司 D8 advance X射线衍射仪(Cu靶,工作电压40 kV,工作电流40 mA,扫描范围5°~90°,扫描速度5 (°)/min)分析物相变化;用赛默飞世尔公司 Nicolet is5傅里叶变换红外光谱仪分析官能团变化;用赛默飞世尔公司 ESCALABXi+X射线光电子能谱仪分析元素变化;用赛默飞世尔公司Apreo 2C电子扫描显微镜(扫描电压10 kV,工作压力4.26×10-4Pa 工作距离8.2 mm)分析元素和微观形貌变化。
2 结果与讨论
2.1 电解锰渣中氨氮的草酸浸取工艺
2.1.1 不同浸取助剂与氨氮剩余浓度的关系
图2为25 ℃、浸取助剂用量10%、浸取时间20 min、机械振荡混合及不同液固比下不同浸取助剂与氨氮剩余浓度的关系。由于液固比为1时,不同浸取助剂处理后电解锰渣中氨氮剩余浓度都在200~300 mg/L,为更明显体现不同浸取助剂间区别,故未在图中呈现。由图2可知,液固比由2增加到5,不添加浸取助剂时,电解锰渣中氨氮剩余浓度从112.20 mg/L降低至56.23 mg/L;加入浸取助剂后氨氮剩余浓度明显降低,以CTAB或H2SO4为助剂,氨氮剩余浓度分别从74.71 mg/L和80.62 mg/L降至29.78 mg/L和26.44 mg/L。因为CTAB是表面活性剂,可以增加两相接触面积[14],促进可溶性氨氮浸出。硫酸是强酸,可破坏电解锰渣中复铵盐,使更多氨氮浸出。以H2C2O4为助剂,氨氮剩余浓度从52.51 mg/L降至24.57 mg/L,满足《污水综合排放标准》(GB 8978—1996)中二级水标准(<25 mg/L),氨氮浸出率达到96.45%。因为草酸酸性较强,破坏电解锰渣中复盐结构,同时促进硫酸钙水解,释放出硫酸钙晶格间的铵盐,可以浸出电解锰渣中更多氨氮。与硫酸和CTAB相比,选草酸为浸取助剂效果较好。
2.1.2 混合方式与氨氮剩余浓度的关系
图3为25 ℃、草酸用量10%、浸取时间20 min及不同液固比下混合方式与氨氮剩余浓度的关系。由图3可知,随液固比增加,三种混合方式处理后电解锰渣氨氮剩余浓度都呈下降趋势。液固比为5时,磁力搅拌、超声混合和机械振荡处理后电解锰渣氨氮浓度从692.67 mg/L分别降至46.21 mg/L、34.40 mg/L和24.57 mg/L,机械震荡更有利于电解锰渣氨氮浸出。
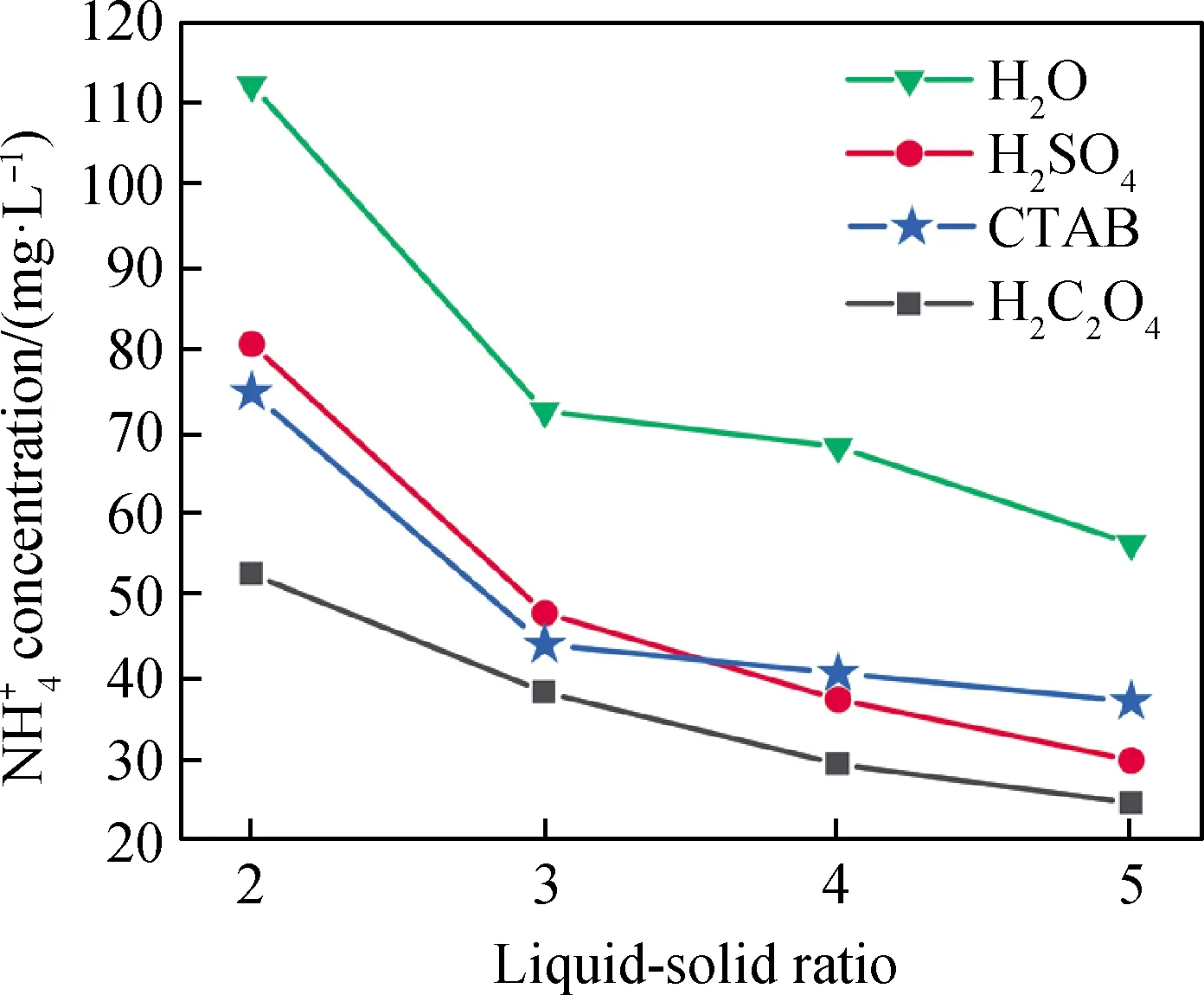
图2 不同浸取助剂与氨氮剩余浓度的关系Fig.2 Relationship between different leaching additives and residual concentration of ammonia nitrogen
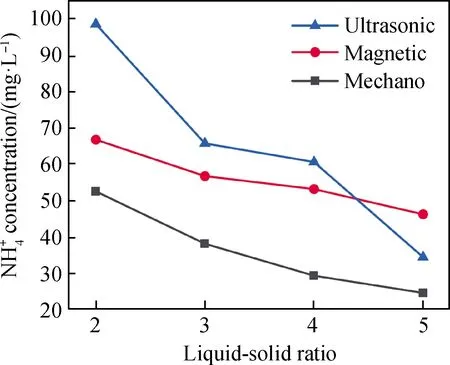
图3 混合方式与氨氮剩余浓度的关系Fig.3 Relationship between mixing mode and residual concentration of ammonia nitrogen
电解锰渣中氨氮浸出是固、液两相反应,反应体系的均质化程度直接影响氨氮浸出效率,即固、液两相的接触面积越大,氨氮浸出效率越高。磁力搅拌是通过电磁作用带动放入反应体系中的磁子旋转、使两相混合,均质化程度受磁子转速和形状影响。使用磁子搅拌的过程中,反应体系中远离磁子的区域混合效果差,故氨氮剩余浓度最高。超声混合主要以频率高、波长短和穿透力强的超声波通过振动使固、液两相混合,由于声波的能量较低,两相接触不充分,氨氮剩余浓度较高。机械振荡采用水平振荡的方式,锥形瓶放置于水平振荡器中,一个振荡周期、反应体系的运动方向改变两次,每次方向变化时产生大量的高能涡流,使固、液两相充分混合,均质化程度最高,氨氮浸出效果较好。
2.1.3 浸出时间和温度与氨氮剩余浓度的关系
图4为25 ℃、草酸用量10%、机械振荡及不同液固比下浸出时间与氨氮剩余浓度的关系。由图4可知,相同液固比,浸出时间为5~20 min时,氨氮剩余浓度随时间增加而减少;浸出时间由20 min增加至40 min时,氨氮剩余浓度略微增加。所以,浸出时间选20 min较适宜。
图5为草酸用量10%、浸出时间20 min、机械振荡及不同液固比下浸出温度与氨氮剩余浓度的关系。由图5可知,在多个液固比下,不同浸出温度均表现出对氨氮剩余浓度的影响很微弱。因为电解锰渣中氮元素的质量分数约为0.7%[2],而硫酸铵在水中溶解度很大,25 ℃时为76.9 g/100 g,在液相过量时,浸出温度对电解锰渣氨氮剩余浓度影响较小。
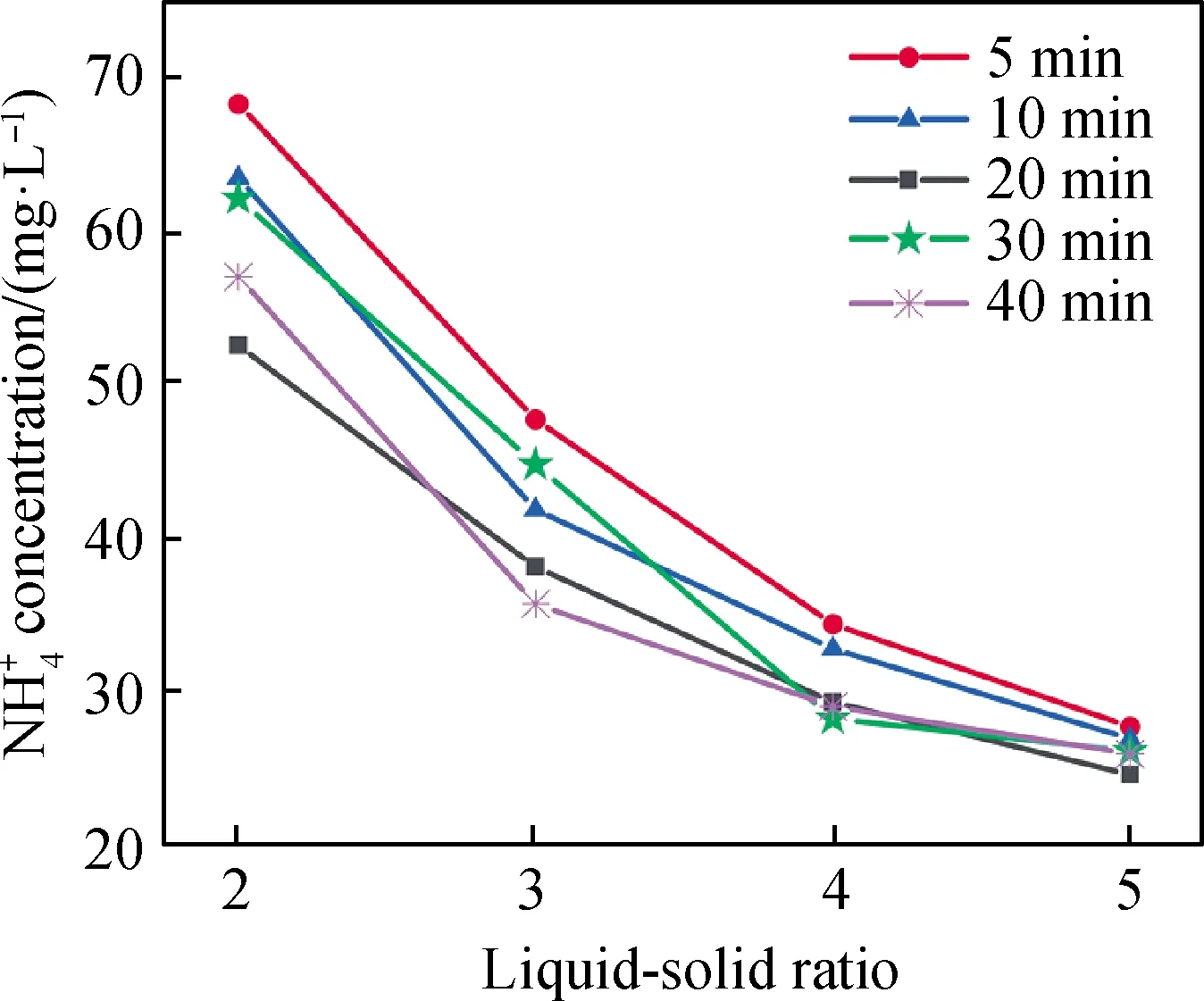
图4 浸出时间与氨氮剩余浓度的关系Fig.4 Relationship between leaching time and residual concentration of ammonia nitrogen

图5 浸出温度与氨氮剩余浓度的关系Fig.5 Relationship between leaching temperature and residual concentration of ammonia nitrogen
2.1.4 草酸用量对氨氮剩余浓度的影响

图6 草酸用量与氨氮剩余浓度的关系Fig.6 Relationship between oxalic acid dosage and residual concentration of ammonia nitrogen
图6为25 ℃、浸出时间20 min及不同液固比下草酸用量与电解锰渣氨氮剩余浓度的关系。由图6可知,电解锰渣氨氮剩余浓度随草酸用量增加而减小,当液固比为5、草酸用量5%~20%时,草酸用量每增加5%,氨氮剩余浓度分别为40.77 mg/L、24.57 mg/L、22.11 mg/L和19.71 mg/L,去除率分别增加2.34%、0.36%和0.36%;草酸用量为10%时,氨氮浸出过程趋于平衡,并且氨氮浓度小于25 mg/L,满足国家环境保护二级水标准。
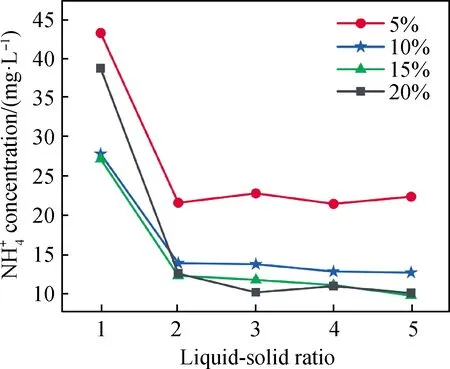
图7 浸取-洗渣工艺氨氮剩余浓度Fig.7 Residual concentration of ammonia nitrogen in leaching and two-stage washing slag process
多级洗涤工艺[15]是有效提高浸出率和节省用水的常用方法。图7为浸取-洗渣二级洗涤工艺处理的电解锰渣氨氮剩余浓度与草酸用量的关系,即浸取和固液分离操作完成后,再用1份水对滤渣二次洗涤的工艺。对比图6和图7可见,相同用水量浸出时,浸取-洗渣处理后氨氮剩余浓度低于直接浸取;如当草酸用量10%,直接浸取液固比为3时,氨氮剩余浓度为38.11 mg/L;当草酸用量为10%,液固比为2时,浸取-洗渣二级洗涤处理后氨氮剩余浓度为13.85 mg/L,可达到《污水综合排放标准》一级水(<15 mg/L)标准。用水量和草酸用量都相同时,氨氮去除率由直接浸取的94.50%提升至浸取-洗渣二级洗涤工艺的98.0%。
2.2 电解锰渣氨氮浸出机理研究
2.2.1 氨氮浸出前后结构分析
图8为不同助剂浸出氨氮后电解锰渣的FT-IR谱,其中图8(a)是不同助剂浸取后的电解锰渣与原电解锰渣的FT-IR谱对比,图8(b)是图8(a)在720~730 cm-1区间放大图。图8(a)中,峰3 545 cm-1、1 621 cm-1和3 405 cm-1是水分子的弯曲和伸缩振动,峰1 436 cm-1和798 cm-1分别是N—H和Si—O的伸缩振动,峰1 686 cm-1和798 cm-1分别是磷酸根和硫酸根的特征峰[16],峰1 315 cm-1和724 cm-1分别是草酸盐[17]和硫酸钙晶格间磷酸盐[18]的特征峰。
由图8(a)可知,经H2C2O4、H2SO4和CTAB浸取后锰渣中氨氮特征峰基本消失,说明三种助剂可以有效促进电解锰渣中氨氮浸出。草酸浸取后磷酸根特征峰(1 686 cm-1)大幅度减弱,而以硫酸溶液、CTAB溶液浸取后,却不能使磷酸根减少;同时,硫酸钙晶格间的磷酸盐特征峰724 cm-1也仅在草酸溶液浸取后出现减弱的现象,如图8(b)所示。结合草酸作为助剂浸出氨氮的能力优于其他两种助剂及原电解锰渣XRD分析中含有(NH4)2HPO4晶相,说明浸出前电解锰渣中磷大部分是以(NH4)2HPO4形式存在;(NH4)2HPO4易溶于水,但电解锰渣磷酸铵盐主要存在于难溶的硫酸钙晶格中,用草酸做浸取助剂有利于硫酸钙水解,从而促进氨氮浸出。
2.2.2 氨氮浸出前后物相分析
图9为液固比2、草酸用量10%、浸取20 min、机械振荡混合的电解锰渣浸取-洗渣二级洗涤工艺浸取前后XRD谱,其中,图9(b)为图9(a)在12°~24°区域放大图。由图9(a)图可见,电解锰渣的主要物相是CaSO4·2H2O和SiO2;氨氮浸出前、后电解锰渣主物相没有发生改变,但CaSO4·2H2O和SiO2的峰强度增加,因为草酸把依附于物相表面和嵌于晶格内部的铵盐浸出,干扰减少、单一性增强、使其峰强度增加。由图9(b)可见,电解锰渣中氨氮以(NH4)2SO4、(NH4)2HPO4和铵镁矾[(NH4)2(Mn、Fe、Mg)(SO4)2][19]等形式存在;浸取后峰3、4、5消失,出现新的草酸钙[17]衍射峰6,因为氨氮浸出过程中草酸与铵镁矾反应生成草酸盐和硫酸铵,同时草酸与硫酸钙发生复分解反应,生成难溶物草酸钙并释放出磷酸铵盐,使铵盐被液相浸出,从而去除电解锰渣中氨氮。
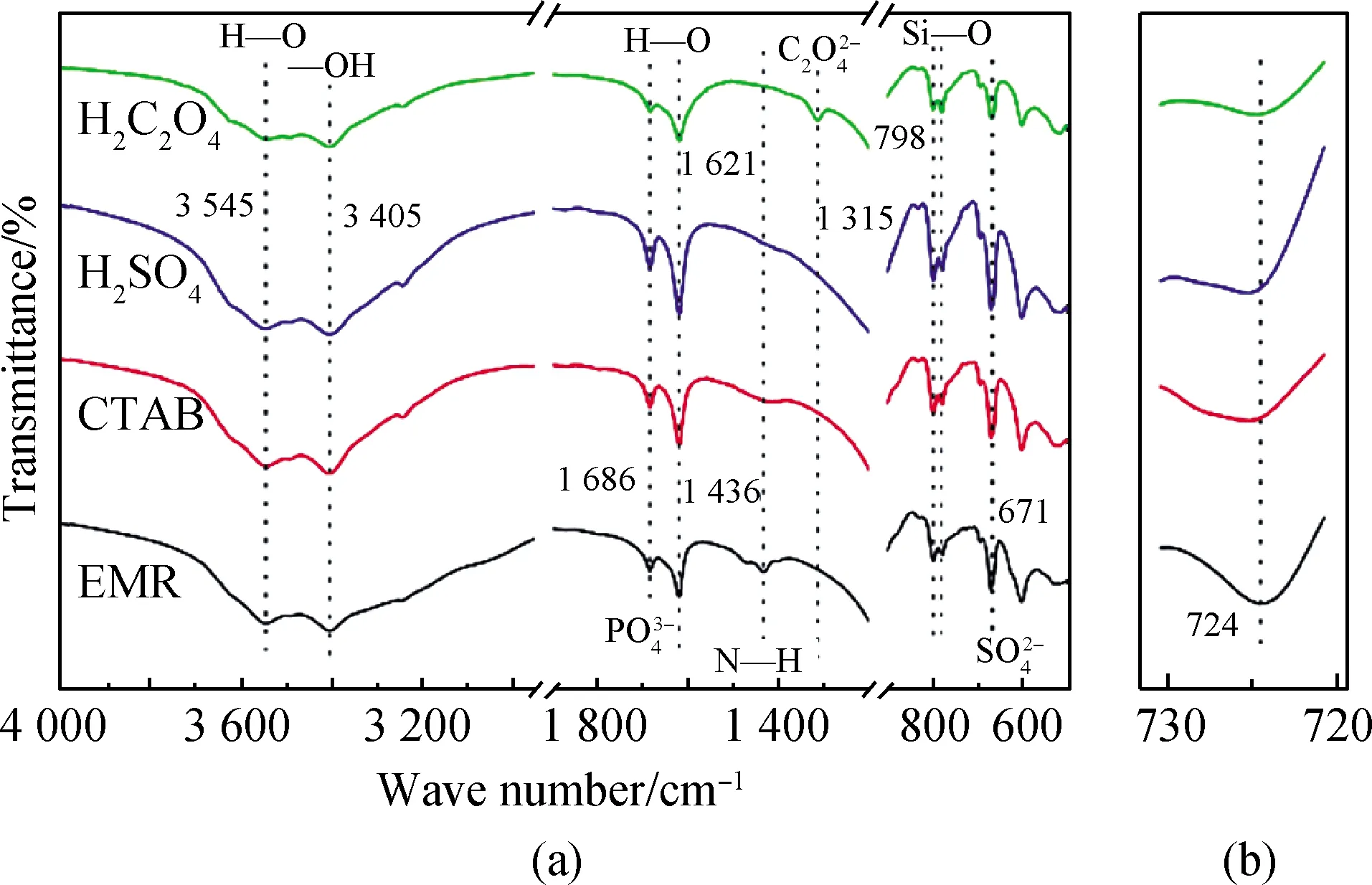
图8 不同助剂浸出氨氮后电解锰渣的FT-IR谱Fig.8 FT-IR spectra of EMR after ammonia nitrogen leaching with different additives
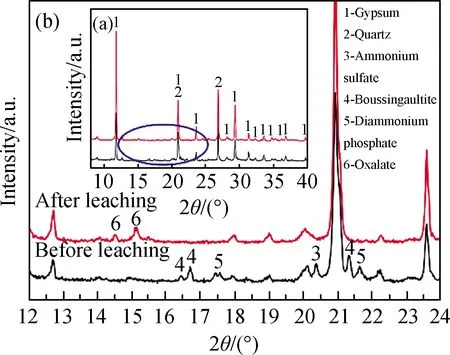
图9 电解锰渣二级洗涤浸取前后XRD谱Fig.9 XRD patterns before and after EMR two-stage leaching
2.2.3 氨氮浸出前后化学形态分析
图10为液固比2、草酸用量10%、浸取20 min、机械振荡混合的电解锰渣浸取-洗渣二级洗涤工艺浸取前后XPS谱,其中,图10(a)为浸取前后氮元素(N 1s)的XPS谱,图10(b)为浸取前后锰元素(Mn 2p)的XPS谱。图10(a)中峰值401.30 eV和402.20 eV分别对应硫酸铵和铵镁矾[20-21],硫酸铵应是随残余电解液进入电解锰渣中,铵镁矾可能是压滤工段高压下产生的铵复盐。XPS是一种表面分析技术,测试X射线不能穿透物质激发出样品内部元素的价电子,且谱中无铵盐(NH4)2HPO4的峰,证明上文分析(NH4)2HPO4存在于硫酸钙晶格间是正确的。浸取后N元素峰强度大幅度减弱,说明电解锰渣中大部分氨氮被浸出。
图10(b)中峰值643.45 eV和641.75 eV分别是硫酸锰和二氧化锰[22-23],出现高价锰可能是因为电解锰渣长期暴露于空气中氧化形成,浸取后不同价态锰的峰强度大幅度减弱,可能是与草酸发生氧化还原反应生成易溶于水的二价锰离子被浸取液浸出;按《水质 锰的测定 高碘酸钾分光光度法》(GB 11906—1989)检测浸出液中锰离子浓度,电解锰渣浸取前后锰离子浓度由626.54 mg/L降低至53.81 mg/L,锰离子去除率91.41%。

图10 电解锰渣二级洗涤浸取前后XPS谱Fig.10 XPS spectra before and after EMR two-stage leaching
2.2.4 氨氮浸出前后微观形貌分析
图11为液固比2、草酸用量10%、浸取20 min、机械振荡混合的电解锰渣二级洗涤工艺浸取前后SEM照片和EDS谱,其中图11(a)和(c)是浸取前电解锰渣的SEM照片,图(e)和(f)是浸取后电解锰渣的SEM照片,图11(b)、(d)和(e)分别是点1、2和3的EDS谱。由图11(a)可见,浸取前电解锰渣是由柱状物质和大量絮状物质松散堆积而成。取柱上点1进行EDS分析,如图(b)所示,主要包含Ca、S和O三种元素,原子数比为1 ∶0.97 ∶7.73,推测柱状物质可能是硫酸钙[24]。图11(c)是图11(a)中絮状物放大图,可见絮状物质是由多种不规则颗粒相互挤压嵌合紧密堆叠形成。图11(d)是点2的EDS谱,可见絮状物含有Mn、Al、Mg和N等元素,结合XRD中铵镁矾是电解锰渣中氮存在形式之一,推测铵镁矾可能存在于絮状物质中。由图11(e)可见,浸取后电解锰渣中石膏仍以柱状呈现,絮状物质基本消失并出现新的片状结构,片状结构放大图如图11(f)所示。图11(g)是点3 EDS谱,可以看出片状结构中含有Ca、C和O等元素,结合XRD分析浸取后电解锰渣中有草酸盐生成,推测片状结构可能是草酸钙[17]。
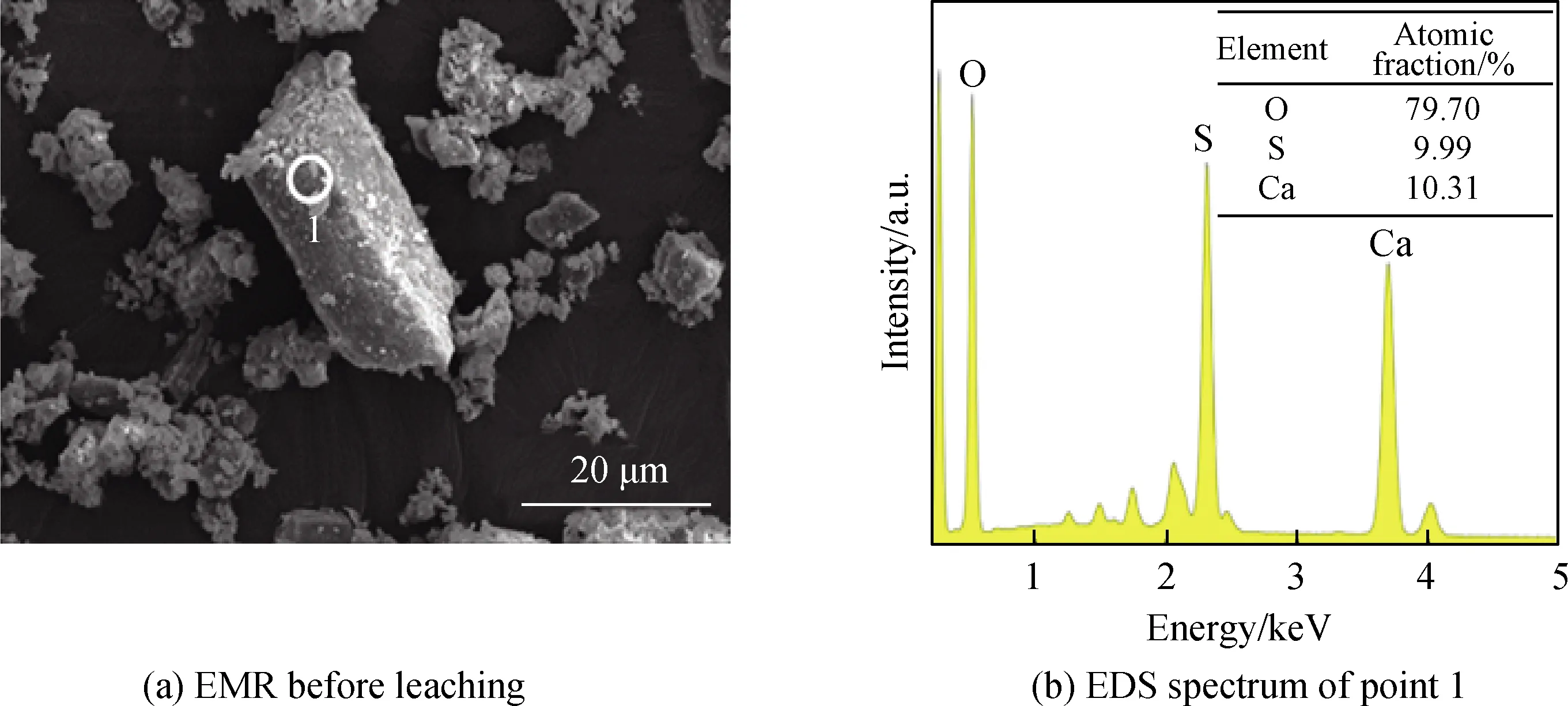
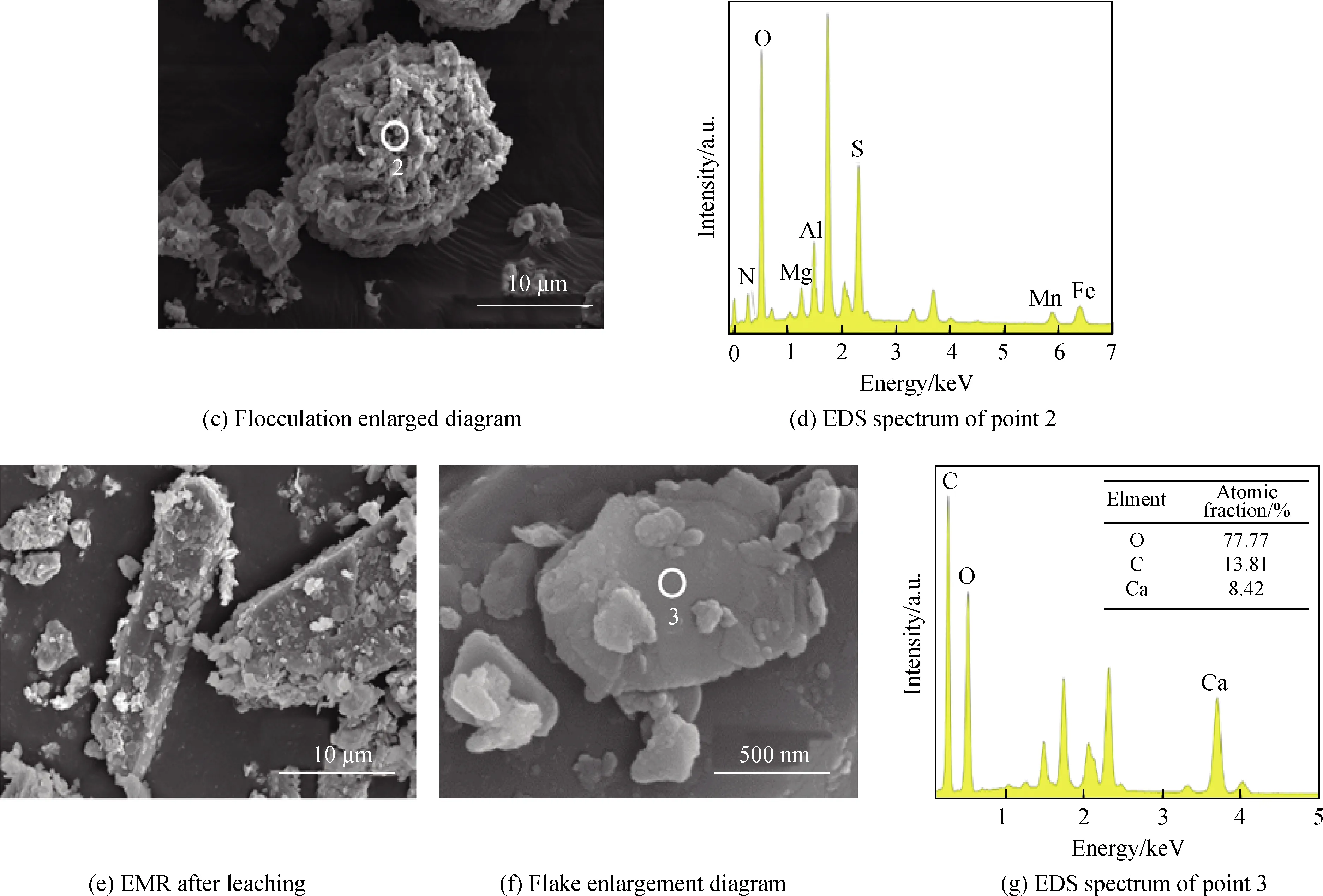
图11 电解锰渣二级洗涤浸取前后SEM照片和EDS谱Fig.11 SEM images and EDS spectra before and after EMR two-stage leaching
2.2.5 氨氮浸出动力学分析
电解锰渣中氨氮浸出属于固、液两相反应,草酸溶液浸入电解锰渣中与铵盐和少部分硫酸钙反应,并不能改变电解锰渣的主体部分,所以采用收缩核模型[24]探讨氨氮浸出动力学。
根据收缩核模型,如果氨氮浸出受化学反控制,动力学方程为:
(2)
如果氨氮浸出受界面传质控制,动力学方程为:
(3)
如果氨氮浸出受两者混合控制,动力学方程为:
(4)
式中:x为电解锰渣中氨氮浸出率;k1为化学反应速率常数;k2为界面扩散过程的速率常数;k3为混合控制的反应速率常数;t为反应时间,min。
表2为电解锰渣中氨氮浸出率与时间的关系,将表2数据分别带入上述方程、拟合结果如图12所示。由图12可知,相关系数都大于0.90,使用式(4)拟合的相关系数R2大于0.97,更接近于1,说明氨氮浸出过程是受化学反应和界面传质混合控制。

表2 电解锰渣中氨氮浸出率与时间的关系Table 2 Relationship between ammonia nitrogen leaching rate and time in EMR

图12 动力学拟合Fig.12 Dynamic fitting
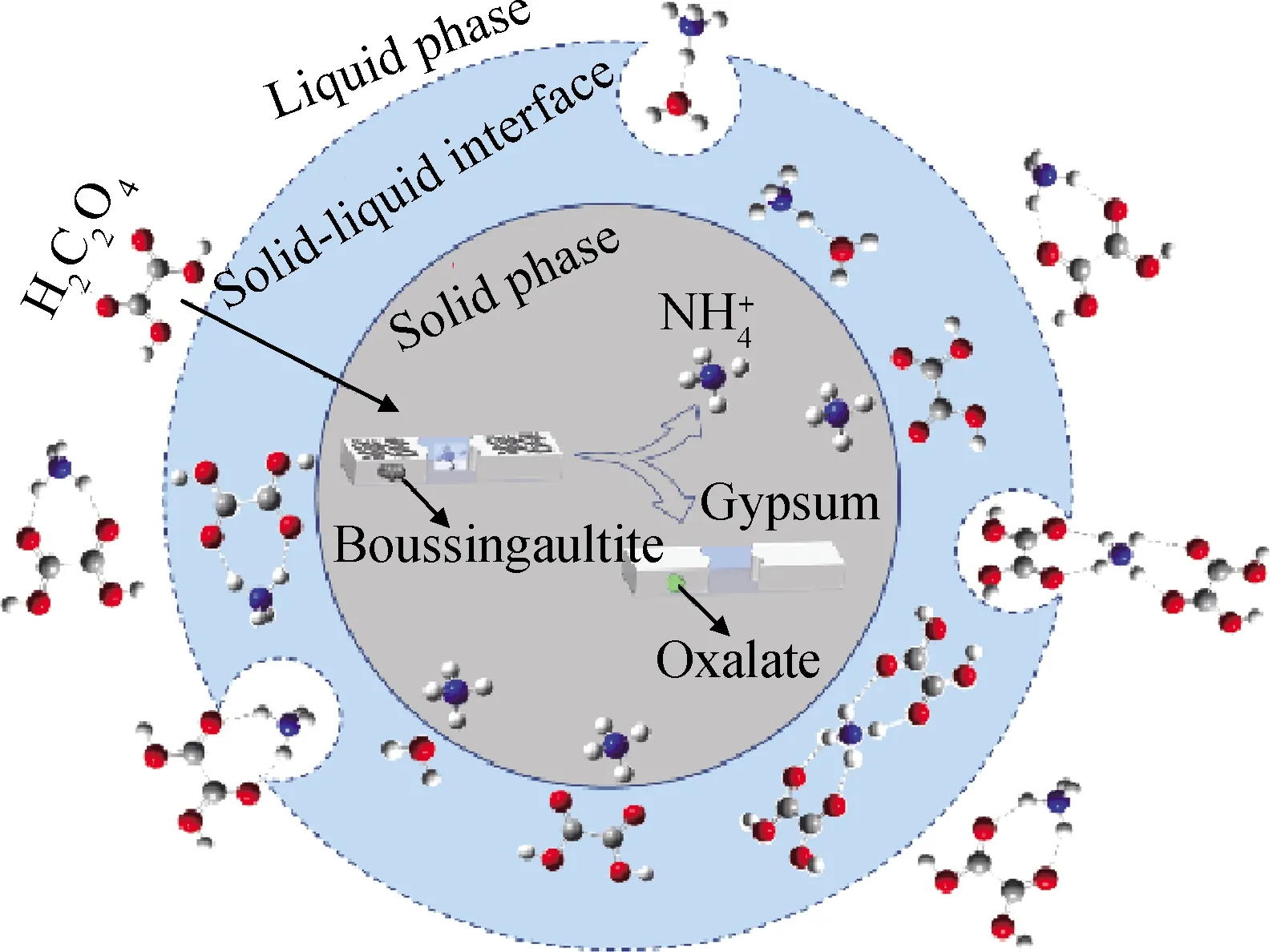
图13 氨氮浸出机理模型Fig.13 Ammonia nitrogen leaching mechanism model
2.2.6 氨氮浸出机理模型
氨氮浸出过程包括氨氮释放过程和氨氮稳定过程,公式(5)~(10)为氨氮释放过程。
H2C2O4+CaSO4→CaC2O4↓+H2SO4
(5)
(NH4)2HPO4+H2C2O4→(NH4)2C2O4+H3PO4
(6)
(NH4)2Fe(SO4)2+H2C2O4→FeC2O4↓+(NH4)2SO4+H2SO4
(7)
(NH4)2Mn(SO4)2+H2C2O4→MnC2O4+(NH4)2SO4+H2SO4
(8)
(NH4)2Mg(SO4)2+H2C2O4→MgC2O4↓+(NH4)2SO4+H2SO4
(9)
MnO2+H2C2O4+H2SO4→MnSO4+CO2↑+2H2O
(10)
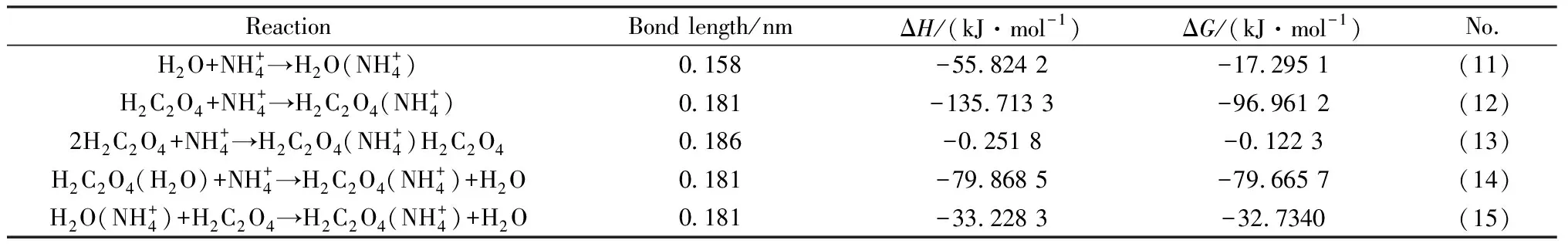
表3 液相中的反应和热力学计算Table 3 Reaction and thermodynamic calculation in liquid phase
表4为25 ℃,液固比5时草酸溶液浸出电解锰渣氨氮过程中浸出液pH值的变化。浸出液的酸度由H2C2O4电离出的H+决定,反应(5)~(10)涉及到H+产生和消耗,溶液的pH值也会随着反应进行而改变。由表4可知,浸取前后pH值的差值随草酸用量增加而减少,草酸用量为5%时,溶液pH值由1.33增加到3.59;草酸用量增加到20%时,浸取前后pH值基本没有变化。草酸用量较少时,氨氮的释放和锰离子的氧化存在竞争行为,因为电解锰渣中Mn元素含量远大于N元素,所以H+大量消耗,溶液pH值增加;草酸加入过量时,反应消耗了部分H+,但溶液中仍有大量草酸解离、维持溶液pH值稳定。

表4 浸出液pH值变化Table 4 pH value change of leaching solution
3 结 论
(1)加入浸取助剂后氨氮剩余浓度明显降低,草酸为浸取助剂效果较好;当用水量和草酸用量都相同时,浸取-洗渣二级洗涤工艺除氨氮效果优于直接浸取工艺,氨氮剩余浓度满足《污水综合排放标准》(GB 8987—1996)一级水标准。
(2)结构、物相、化学形态和微观形貌分析表明:草酸浸取处理电解锰渣时,草酸不仅可破坏铵的复盐结构,还可与硫酸钙发生复分解反应,浸出硫酸钙晶格间铵盐,使氨氮浸出更彻底。
(3)通过动力学分析和热力学计算建立氨氮释放、静电吸引和氨氮稳定的浸出过程机理模型,发现铵根离子与草酸分子以1 ∶1配位的形式稳定在液相中、氨氮浸出过程符合收缩核模型并受化学反应和界面传质混合控制。
