miR-216a对人外周血单个核细胞衍生的巨噬细胞特性的影响
2022-03-12张伟丽
韩 爽,陈 宇,张伟丽
(中国医学科学院 北京协和医学院 国家心血管病中心 阜外医院 心血管疾病国家重点实验室,北京 100037)
动脉粥样硬化是心脑血管疾病发生和发展的重要病理基础。循环血中的单核细胞迁移并黏附于活化的血管内皮细胞,浸润至内膜下层形成巨噬细胞是动脉粥样硬化的起始环节,单核-巨噬细胞通过极化和分泌炎性因子等机制调控动脉粥样硬化发展的各个阶段。巨噬细胞在不同微环境下具有表型异质性和可塑性,主要分为两种类型:经典活化型巨噬细胞(classical activated macrophages, M1)、替代活化型巨噬细胞(alternatively activated macrophages, M2)[1]。M1型巨噬细胞在斑块中大量存在,通过分泌炎性因子促进动脉粥样硬化进展;反之,M2型巨噬细胞可以通过分泌抗炎因子发挥抑制斑块进展的作用[2]。
MicroRNAs(miRNAs)是一类长度约22个核苷酸的非编码RNA,在调控单核-巨噬细胞功能中的作用受到广泛关注[3]。已有研究报道miR-216a可以激活端粒酶,促进人单核细胞系THP-1细胞衍生的巨噬细胞向M1型极化[4],但miR-216a对人外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)衍生的巨噬细胞特性尚不清楚。人PBMCs为原代培养单核细胞,能更真实地反映体内细胞状态,是研究动脉粥样硬化的适宜模型[5]。本研究旨在探讨miR-216a对PBMCs衍生的巨噬细胞炎性反应和极化分型的影响。
1 材料与方法
1.1 主要试剂
RPMI-1640培养基、佛波酯(phorbol myristate acetate, PMA)、脂多糖(lipopolysaccharide, LPS)和Histopaque®1077淋巴细胞分离液(Sigma公司),干扰素(interferon-γ, IFN-γ)和白介素-4(interleukin-4, IL-4)(PeproTech公司),PrimeScript RT reagent Kitwith gDNA Eraser反转录试剂盒(Takara公司),Hieff®qPCR SYBR Green Master Mix(Yeasen公司),Lipofectamine 3000(Invitrogen公司),抗体CD86和CD206(BD公司)。
1.2 实验方法
1.2.1 人PBMCs的分离和培养:研究对象来自中国医学科学院阜外医院疑为冠心病行冠状动脉造影检查的患者6例,外周血标本来自于晨起空腹抽血。中国医学科学院阜外医院伦理委员会批准了本研究设计以及人外周血的使用,所有患者均签署书面知情同意书。
采用密度梯度离心法分离人PBMCs:肝素抗凝的新鲜外周血4 mL,1 500 r/min室温离心10 min,弃上层血清,加入磷酸缓冲液稀释至终体积4 mL,充分混匀后,沿管壁缓慢加入4 mL Histopaque®1077淋巴细胞分离液。随后1 500 r/min室温离心40 min,取中间层雾状液体,加入6倍体积的磷酸缓冲液稀释,再次1 700 r/min室温离心10 min,加入磷酸缓冲液洗涤两次,得到人PBMCs悬液[6]。在含有20%胎牛血清和100 ng/mL巨噬细胞集落刺激因子的RPMI-1640培养基中培养PBMCs,并放置于37 ℃、5% CO2培养箱培养。
1.2.2 巨噬细胞极化模型的建立:将生长状态良好的PBMCs以(0.8~1.0)×106个/mL的浓度在12孔板中培养,使用100 ng/mL的PMA刺激48 h后,PBMCs分化成M0型初始巨噬细胞。继而,用1 ng/mL的LPS和20 ng/mL的IFN-γ刺激48 h,诱导M0型初始巨噬细胞向M1型巨噬细胞极化;用20 ng/mL的IL-4刺激48 h,诱导M0型初始巨噬细胞向M2型巨噬细胞极化。
1.2.3 细胞转染:使用lipofectamine 3000试剂将miR-216a模拟物(mimics)和阴性对照(negative control,NC)以终浓度为50 nmol/L转染入巨噬细胞,培养48 h。细胞转染步骤参考Lipofectamine 3000试剂说明书。miR-216a mimics序列如下:正义链5′-UAAUCUCAGCUGGCAACUGUGA-3′;反义链5′-AC AGUUGCCAGCUGAGAUUAUU-3′。
1.2.4 实时荧光定量PCR法检测基因表达水平:使用PrimeScript RT reagent Kit with gDNA Eraser反转录试剂盒提取细胞总RNA,并反转录合成cDNA,然后使用SYBR Green qPCR Mix试剂配制反应体系,利用ABI ViiA7 System实时荧光定量PCR仪检测基因的mRNA表达水平。扩增程序如下:95 ℃ 10 min预变性;95 ℃ 变性10 s,60 ℃退火30 s和72 ℃延伸30 s,共40个循环。结果使用2-ΔΔCt定量法进行分析,以GAPDH为内参照。基因引物序列见表1。

表1 实时荧光定量 PCR 引物序列
1.2.5 流式细胞术:收集M1和M2型巨噬细胞,分别向细胞内加入抗体CD86和CD206,4 ℃避光孵育30 min。用磷酸缓冲液洗涤细胞,并重新悬浮,使用Accuri C6 流式细胞仪(BD公司)进行检测。
1.3 统计学分析

2 结果
2.1 PBMCs衍生的巨噬细胞极化模型建立
流式细胞仪检测结果显示,LPS和IFN-γ共同诱导的M1型巨噬细胞中,M1型表面标志物CD86阳性率达89.9%(图1A);IL-4诱导的M2型巨噬细胞中,M2型表面标志物CD206阳性率达92.1%(图1B)。

A.the expression of CD86 in M1 macrophages; B.the expression of CD206 in M2 macrophages
实时荧光定量PCR结果显示,M1型巨噬细胞特异性表面标记物CD86 mRNA的相对表达水平是M0型巨噬细胞的10.3倍(P<0.01)(图2A);M2型特异性表面标记物CD206 mRNA的相对表达量比M0型升高12倍(P<0.01)(图2B)。
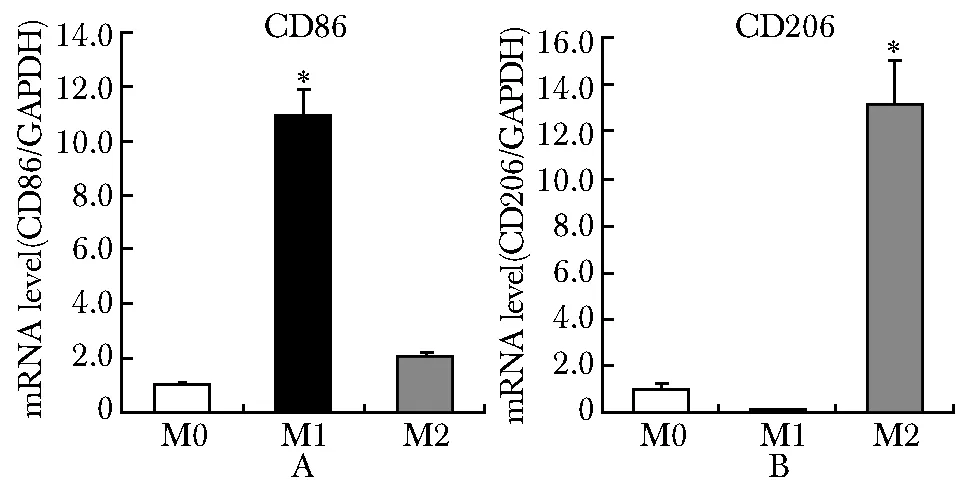
A.the expression of CD86; B.the expression of CD206;*P<0.01 compared with M0 macrophages
2.2 M1/M2型巨噬细胞炎性相关因子的特点
与M0型巨噬细胞相比,在诱导激活的M1型巨噬细胞中,促炎因子IL-1β、IL-6和TNF-α mRNA的相对表达量分别增加10.6倍、11.5倍、9.3倍(P<0.01)(图3A);抗炎细胞因子TGF-β和IL-10 mRNA在M1型巨噬细胞和M2型巨噬细胞中的相对表达水平均较M0型显著降低(P<0.01)(图3B)。

A.the expressions of IL-1β, IL-6 and TNF-α; B.the expressions of TGF-β and IL-10; 0.01 compared with M0 macrophages
2.3 miR-216a对巨噬细胞表面标记物和炎性因子的影响
与对照组相比,过表达miR-216a后,M2型巨噬细胞表面标记物CD163 mRNA的相对表达水平升高0.4倍(P<0.05),但CD206 mRNA表达水平无显著性差异(图4A)。此外,过表达miR-216a后,M2型巨噬细胞的促炎因子TNF-α和IL-1β mRNA的相对表达水平降低约30%(P<0.05)(图4B),抗炎因子TGF-β和IL-10 mRNA的相对表达水平升高约0.6倍(P<0.05)(图4C)。

A.the expressions of CD163 and CD206; B.the expressions of TNF-α and IL-1β; C.the expressions of TGF-β and IL-10; *P<0.05 compared with negative control(NC)
3 讨论
巨噬细胞通过合成和分泌细胞因子参与炎性反应、脂质蓄积以及动脉粥样硬化斑块稳定性的调节。巨噬细胞的异质性使其在不同组织微环境表现出不同的炎性反应特征和功能特性[7]。M1型在炎性反应早期阶段通过NF-κB信号通路促进多种炎性因子和趋化因子的释放,促进炎性反应,同时降低胆固醇蓄积导致动脉粥样硬化斑块不稳定甚至破裂[8]。M2型为炎性反应消退阶段的主要活化表型,引起抗炎细胞因子释放并促进组织的修复和再生[9]。M1型/M2型巨噬细胞平衡极化影响着炎性反应性疾病的进程,其中M2型巨噬细胞更具可塑性,并容易极化为炎性M1型巨噬细胞[10]。
miRNA在巨噬细胞极化中发挥重要作用。例如,miR-495通过抑制肥胖相关基因(fat mass and obesity associated gene, FTO)表达促进M1型极化,加重小鼠胰岛素抵抗和脂肪组织炎性反应[11];miR-145靶向抑制靶基因IL-16,上调IL-10的表达,促进细胞向M2型极化[12]。本课题组先前的研究发现,miR-216a通过Smad3/NF-κB途径激活端粒酶,促进THP-1衍生的巨噬细胞向M1型极化[4]。本研究结果发现,miR-216a诱导了PBMCs衍生的巨噬细胞中M2型表面标记物CD163和CD206的表达,抑制炎性因子表达,增加抑炎因子表达,从而促进M2型巨噬细胞极化,提示miR-216a在不同微环境中的作用复杂。
THP-1单核-巨噬细胞是一种具有相同表观遗传背景的永生单核细胞系,而人PBMCs是原代单核细胞系[5]。LPS、IFN-γ和IL-4等刺激物诱导THP-1单核-巨噬细胞的极化模型与原代单核细胞PBMCs来源的巨噬细胞极化模型,二者间存在重要差异[13]。例如,与THP-1细胞相比,PBMCs对LPS刺激的反应更强烈,主要表达单核细胞分化抗原CD14抗体[14]。因此,在相同刺激下,不同来源的巨噬细胞可能产生不同的极化表型差异。本研究的局限性在于在探究miR-216a对巨噬细胞特性的影响时,仅采用实时荧光定量PCR方法检测细胞表面标记物。在后续的实验中将采取流式细胞术和免疫荧光技术进一步鉴定巨噬细胞极化分型的特点。
综上,本研究发现miR-216a可促进人PBMCs来源的巨噬细胞向M2型极化并抑制炎性因子表达,这为miR-216a对巨噬细胞极化的调节提供了新的证据。寻找影响巨噬细胞极化的调控因子可能为慢性炎性反应性疾病如动脉粥样硬化的治疗提供新思路。
