血管内光学相干层析成像技术在冠状动脉粥样硬化斑块检测方面的应用
2022-03-12裘耀扬桂家辉虎学强
裘耀扬,桂家辉,黄 林,虎学强,李 勤
(北京理工大学 生命学院,北京 100081)
1 引言
动脉粥样硬化(atherosclerosis)是冠心病、脑梗死、外周血管病的主要原因[1]。它是一种进行性疾病,其特征是动脉壁中脂质、胆固醇、纤维成分、单核细胞和各种其他炎性反应细胞的积聚并沉积。这些沉积物形成粥样斑块的血管病变,粥样斑块含有坏死的核心,并通过由胶原和平滑肌细胞组成的纤维帽与动脉内膜分离。斑块成熟后,纤维帽变薄,越来越容易撕裂,这增加了斑块破裂的可能性。这些易损斑块的破裂进入动脉,导致血栓形成,易引起冠状动脉粥样硬化性心脏病、脑卒中、腹主动脉瘤和外周血管疾病等,是心脑血管疾病致残致死的主要原因。不幸的是,随着我国人口老龄化进程的加快,此类疾病的发病率和死亡率不断攀升。
早期发现斑块病变是预防动脉粥样硬化致命后果的第一步,也是最必要的一步。血管内光学相干层析成像(intravascular optical coherence tomography, IVOCT)技术是近年来发展非常迅速的一种光学成像技术,因其能够对生物组织进行高分辨率、无辐射、实时在体成像,在临床诊断方面发挥了重要的作用,并越来越广泛地被应用于冠脉动脉粥样硬化斑块的检测。
2 IVOCT的基本原理及其应用
光学相干层析成像(optical coherence tomogra-phy, OCT)最早由David Huang等[2]搭建并应用于离体人眼视网膜成像。Brezinsky等[3]最先建议将基于导管的OCT系统应用于血管内成像。基于这种理念,IVOCT系统将OCT技术同光纤探头相结合,实现了血管内成像。
IVOCT系统的基本构造如图1所示,主要包括光源、参考臂、样品臂、光纤耦合器件、探测器以及计算机系统。光源发出的光经分束器后分别进入样品臂和参考臂,从样品臂返回的生物组织背向散射光和参考臂反射回的光在光纤耦合器中发生干涉,干涉信号经探测器转换为电信号,再经过计算机系统采集、处理,最终成像。

图1 IVOCT结构示意图[4]
相较于目前已有的其他医学影像技术,IVOCT不仅能够对血管切面实时在体成像,而且具有无辐射、高分辨率等优点,分辨率可达10 μm,能够分辨出许多细微结构。这些结构与病理切片具有高度一致性,为准确判断动脉粥样硬化斑块的特征以及评估易损斑块的风险提供了可能。IVOCT在冠状动脉病变方面可以进行斑块分类,判断夹层、内膜撕裂状态,评估支架贴壁效果,测量支架内新生内膜厚度,识别新生内膜组织特性和内膜异质性等。薄纤维帽是最重要的易损斑块特征,当厚度小于65 μm时具有高度风险,而IVOCT被认为是可以直接测量纤维帽厚度的唯一方法。
血管内3种主要类型斑块的IVOCT图像如图2所示,分别是钙化斑块、脂质斑块和纤维斑块[5]。其中钙化斑块的特点为低反向散射,衰减弱,边界清晰;脂质斑块的特点为低反向散射,高衰减,边界模糊;纤维斑块的特点为高背向散射(明亮),质地细腻,均匀的高信号区域。

图2 三种主要动脉粥样斑块类型的IVOCT图像(A为钙化斑块;B为脂质斑块;C为纤维斑块)[5]
IVOCT在动脉粥样硬化斑块的检测方面具有突出的优势,但其在临床应用中仍然依赖医生的经验和主观判断确定图像中是否存在斑块及其类别以及相关参数,存在一定的主观性和不确定性。如果IVOCT系统能够根据光学信号对不同类型的斑块做出判断,并给出特征提示以及量化显示,无疑将会使斑块类型的识别更加客观、准确,同时大大降低临床医生对于识别经验的依赖,减少漏诊和误诊,使IVOCT应用难度下降,更有益于推广。为此,研究者展开了一系列研究,利用IVOCT信号提取冠状动脉粥样硬化斑块的光学特征参数,以此作为检测斑块的客观判断依据。同时,基于机器学习的方法对斑块图像进行分析,以期建立IVOCT图像特征智能识别系统,提高检测效率和准确性。
3 动脉粥样硬化斑块的光学参数表征
3.1 IVOCT光学特征参数模型及其应用
目前用于组织表征的光学特征参数主要有:衰减系数、散射系数和背向散射系数,可通过单次散射模型和多次散射模型获得相关参数。
单次散射模型(single scattering model,SSM)是假设光在生物组织中仅发生一次散射的物理模型,光信号在组织内部的衰减遵从一阶指数形式。Schmitt等[6]在1993年首先提出针对OCT信号采用单次散射模型测量生物组织的光学特征参数,其后的研究者在此基础上引入共聚焦点扩展函数[7]和灵敏度滚降函数[8],从而去除焦平面位置和探测器带来的误差。SSM模型如公式(1)所示。
(1)
其中,
由于经典的SSM模型只能对均匀组织进行光学参数提取,Vermeer等[9]在2014年提出了深度分辨模型(depth-resolved model, DR)。DR模型实现了IVOCT图像中的各像素点衰减系数提取。DR模型在一阶指数衰减的基础上引入两个假设:(1)在记录的成像深度范围内几乎所有的光都会衰减;(2)反射回OCT系统的背向散射光是衰减光的固定部分。最终DR模型中每一个像素点处的衰减系数由公式(2)给出。
(2)
其中I为OCT的A-line信号。在求出衰减系数值之后,背向散射系数可以由公式(3)表示。
(3)

多次散射模型(multiple scattering model, MSM)考虑了光在组织内部的多次散射,相较于单次散射模型,MSM更接近样品内部的真实情况。目前最常用的模型是基于扩展惠更斯-菲涅尔原理模型(extended Huygens-Fresnel, EHF)[11],是在扩展惠更斯-菲涅尔原理和互相关函数的基础上建立的模型,忽略生物组织对光的吸收,将组织的散射系数μs、均方根散射角θrms和平均折射率n与外差电流信号相关联,由公式(4)所示。

(4)
其中α是光功率到电流的转换因子,PR和PS分别是参考光和样品光的功率,σb是有效背向散射截面,ωH是在没有散射的情况下探测光强度为其自身强度1/e时的半径,ωS是样品光的角频率。在ωS中含有均方根散射角θrms。公式(4)中仅有均方根散射角θrms和散射系数μs未知,通过非线性拟合可求出这两个参数。
3.2 IVOCT中的色散光学模型
IVOCT中的色散通常指群速度色散,是介质的折射率随光的波长变化所导致的,由生物组织和系统本身造成。色散会导致IVOCT图像分辨率下降,一直以来的研究都集中在对IVOCT系统的色散补偿上。但事实上,色散是与生物组织样品有关的光学参量,不同的生物组织结构会引入不同大小的色散,因此也可以将色散作为样品的一个光学特征参数。
对于IVOCT的色散光学模型,可由OCT的干涉信号ΔSint(ω)和相位Δφ(ω)表示[12]。
(5)
Δφ(ω)=ω0Δτρ+(ω-ω0)Δτg
(6)
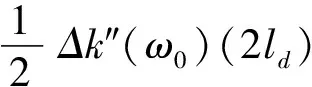
对于IVOCT中群速度色散的计算,通常的思路是计算样品上、下表面的群速度色散,然后相减作差,即可消去系统本身引入的色散而得到样品的群速度色散[13]。计算样品某一特定位置色散的方法通常有迭代法[14]、相位拟合法[15]、分数傅里叶变换法[16]等,目前已实现对光学材料和部分生物组织群速度色散的计算[17],进一步可针对不同类型的动脉粥样硬化斑块进行研究,获得其色散参数用于斑块特征识别。
4 动脉粥样硬化斑块IVOCT图像的智能识别
4.1 纤维、脂质、钙化斑块检测及临床应用
纤维斑块、脂质斑块和钙化斑块是常见的动脉粥样硬化斑块[18-21],其中纤维斑块由大量胶原纤维、平滑肌细胞及细胞外基质形成,仅含有少量或不含有脂质核[19],具有高反射、低衰减、质地均一等特点,在IVOCT图像中表现为信号亮、穿透较深、颜色均匀等。脂质斑块[20]由大量“泡沫细胞”及细胞外脂质和坏死核心组成,具有低反射、高衰减的特点,在图像上表现为信号弱、穿透不深、颜色均匀、纤维帽和斑块间没有清晰的边界等。钙化斑块是钙盐沉积于细胞外脂质和细胞碎片、纤维帽甚至中膜内,钙化点逐渐扩大,融合成较大的团块状或片状的钙质沉积[21],具有低反射、低衰减、质地不均等特点,在图像上表现为信号弱、穿透较深与颜色明暗不一,同时斑块边界清晰,能够看清斑块的形状大小。
通常医生根据动脉粥样硬化斑块的形态学和影像学特征对IVOCT图像进行判读,识别图像中是否含有斑块及其类型。在IVOCT检查过程中,一次回撤会产生数百张图像,单纯靠医生手动判读图像,费时又费力,且效率低;同时受到医生经验程度以及主观判断的影响,无法保证动脉粥样硬化斑块识别的速度和准确性。因此,研究人员试图设计并开发一种自动检测、识别动脉粥样硬化斑块的方法,以减轻医生的负担,同时提高诊断准确率。
首先研究人员使用机器学习的方法自动识别、检测IVOCT图像中的动脉粥样硬化斑块。Ughi等[22]通过计算不同斑块组织的光学衰减系数,并结合图像纹理特征,训练随机森林分类器,最终完成了对IVOCT图像中纤维、脂质和钙化斑块的分类。Rico-Jimenez等[23]通过A-scan和B-scan两种形式对斑块进行建模和表征,识别了内膜增厚、纤维斑块和含脂斑块。
机器学习方法概括而言就是利用IVOCT图像特征,如纹理特征、几何特征以及光学特征参数等训练机器学习模型,从而完成对不同斑块的自动识别。该方法提高了对IVOCT图像的判别速度和准确性,但缺点是需要人为设计特征。
与机器学习方法相比,深度学习方法不需要人为设计特征,网络模型能够自动学习图像特征并用于识别斑块,同时随着计算机处理能力的提升,深度学习方法逐渐被用于IVOCT图像的判别。Gessert等[24]设计了一种双路径级联网络,实现了钙化斑块的检测。Gharaibeh等[25]通过深度卷积神经网络对IVOCT图像中钙化斑块进行分割,进而计算钙化深度、钙化角和钙化厚度等参数。Liu等[26]提出了一种自动检测纤维斑块的深度学习算法。与机器学习相比,深度学习方法目前取得了更高的识别准确率,但计算速度稍慢且数据量需求更大。
4.2 易损斑块的智能检测与临床应用
易损斑块是指容易导致血栓形成或能快速发展为罪犯病变的所有斑块。判断易损斑块的主要标准有:1)薄的纤维帽,大的脂质核心;2)活动性炎性反应,表现为巨噬细胞等的浸润聚集;3)斑块有裂隙或损伤,血管狭窄程度超过90%。研究表明纤维帽的厚度是斑块易损性的决定性因素。目前临床上的共识是当纤维帽的厚度小于65 μm时,斑块具有易损倾向。
易损斑块相比常见的纤维、脂质以及钙化斑块而言,形态更加多变,特征更加不明显。对此,通过机器学习的方法设计、提取易损斑块特征,进而进行识别与检测就变得相对困难。但也有少量的机器学习方法,通过检测纤维帽的厚度,判别斑块是否具有易损倾向。Guo等[27]通过最小二乘支持向量机的方法,完成了对脂质核的检测以及纤维帽厚度的测量,但只是在少量IVOCT图像上进行了实验。
与机器学习方法相比,基于深度学习的方法可以直接从输入图像中提取特定于某个任务的特征,避免了依赖人工特征所带来的各种问题。此外,深度学习方法可以将整个分析工作流程,包括特征提取、特征选择和分类器训练,集成到神经网络模型中。Liu等[28]提出了一种并行网络,集成了多个目标检测网络,以检测IVOCT图像中的易损斑块。该方法首先使用3个独立检测器获取极坐标变换图像的目标,并对检测到的可疑目标执行并集操作去除重复目标,最终获得比单个探测器更准确的斑块位置。这种方法对处理速度有一定的影响。Wang[29]搭建了一个经典的卷积神经网络用于区分IVOCT图像中是否存在易损斑块,该网络首先通过一系列的卷积池化层逐层提取高维特征,然后通过两层全连接层的分类头对特征进行分类。Shi等[30]参考了多任务卷积神经网络(convolutional neural networks, CNN),并在分类头中引入一个额外的分类头对单个A-scan进行分类,从而提高了准确性。总之,深度学习方法被逐渐应用于易损斑块的识别与检测且不断取得新的进展,有望提供快速准确的智能识别系统。
5 结束语
IVOCT以其高分辨率、实时在体成像的优势,越来越广泛地被应用于冠状动脉粥样硬化斑块的检测。为了更为客观、准确、高效地为临床服务,研究者开展了对斑块光学特性参数的研究,以及将机器学习和深度学习应用于IVOCT图像中斑块的自动识别。尽管目前的研究结果还没有形成直接应用于临床的人工智能检测系统,但动脉粥样硬化斑块多维光学特征参数的表征将有助于提高斑块识别的准确性,机器学习和深度学习方法的不断拓展和完善将使动脉粥样硬化斑块的智能识别与分析系统成为可能,从而为临床诊断提供更加高效的检测工具。
