敲除EZH2抑制人宫颈癌细胞系迁移和侵袭
2022-03-12陈茜,刘宪,崔南,翟阳
陈 茜,刘 宪,崔 南,翟 阳
(1.西安交通大学第一附属医院 生殖医学科,陕西 西安 710061; 2.陕西省肿瘤医院 肿瘤内科,陕西 西安 710061)
在发展中国家,宫颈癌(cervical cancer)是女性第二大高发和第三大致死性癌[1]。其发病呈现年轻化趋势,严重威胁女性健康。随着肿瘤的基因治疗逐渐成为研究热点,探寻与宫颈癌相关的原癌基因并为诊断和治疗宫颈癌提供新的研究方向至关重要。
EZH2(enhancer of zeste homolog 2)位于人染色体7q35 位点, 参与细胞周期、分化和凋亡等多种生理或病理过程[2-3]。在肿瘤细胞和肿瘤干细胞EZH2的高表达或者突变可以诱发肝癌、乳腺癌、前列腺癌、结直肠癌、子宫内膜癌等肿瘤的发生和演变[4],靶向EZH2有望成为癌治疗的新策略,目前关于EZH2在宫颈癌中的研究较少。本研究通过检测宫颈癌组织和细胞中EZH2的表达,探讨敲除其表达对宫颈癌细胞迁移和侵袭的影响及作用机制,以期为宫颈癌的治疗提供新的靶点。
1 材料与方法
1.1 材料
1.1.1 临床组织标本的采集与细胞系:本研究所用的正常宫颈组织、宫颈鳞状细胞癌组织标本取自西安交通大学第一附属医院2009年12月至2014年3月间妇产科住院患者,年龄29~73岁,平均年龄48岁,其中正常宫颈40例,宫颈鳞状细胞癌62例。正常宫颈组织来源于子宫肌瘤子宫全切患者。侵袭型宫颈鳞状细胞癌患者术前均未接受放射治疗、化学治疗或免疫治疗,住院后行广泛全子宫及双侧附件切除+盆腔淋巴结清扫术,术后病理确诊。所有收集标本组织切成1 cm×1 cm×1 cm组织方块,用蜡块包埋后行连续切片,厚度4 μm左右,载玻片行多聚L-赖氨酸处理。本研究已获得西安交通大学第一附属医院伦理委员会的批准[2016伦审科学第(117)号]及受试者签署的知情同意书。人宫颈癌HeLa、人子宫颈鳞癌SiHa细胞系(ATCC细胞库)。
1.1.2 主要试剂:DMEM高糖培养基(Thermo Fisher Scientific公司),胎牛血清(Hyclone公司);青霉素、链霉素(Sigma-Aldrich公司);Lipofectamine2000(Invitrogen公司),EZH2-knockout质粒及其control 质粒(美国麻省理工学院科学家张锋实验室)。
1.2 方法
1.2.1 细胞的分组及处理:复苏HeLa和SiHa细胞后,用含10%胎牛血清、100 U/mL 青霉素和100 μg/mL链霉素的DMEM高糖培养液,置于37 ℃、5% CO2培养箱中培养。取对数增殖期的HeLa和SiHa细胞进行转染。分别取对数增殖期的HeLa和SiHa细胞接种于35 mm培养皿中,培养细胞达70%~80%汇合时,按Lipofectamine2000 转染试剂说明书提供的方法分别将EZH2-knockout质粒及其control质粒转染到HeLa和SiHa细胞中[5]。
1.2.2 Western blot检测蛋白表达:从细胞中提取蛋白。经BCA 蛋白定量法测定蛋白质浓度。蛋白经10% SDS-PAGE,应用Bio-Rad湿转法转移到PVDF 膜,5%脱脂牛奶封闭1 h,加入5%脱脂牛奶稀释的一抗(1∶1 000稀释的兔抗人EZH2、鼠抗人STAT3、兔抗人p-STAT3和鼠抗人GAPDH抗体)在4 ℃孵育过夜,与相应的1∶10 000稀释的二抗在室温孵育1 h,加ECL发光剂,用Western blot化学发光成像系统一体机进行曝光,采用ImageJ2×软件进行吸光度(A)值分析。
1.2.3 细胞划痕实验检测细胞迁移:将EZH2-knockout及对照的HeLa和SiHa细胞种于35 mm培养皿中,24 h后用灭菌的20 μL量程的小枪头尖端进行划痕,用无菌磷酸盐缓冲液(PBS)清洗多次,加入无血清的普通DMEM高糖培养液后拍照(0 h),并显微镜下记录拍照位置。37 ℃、5% CO2培养箱中继续培养,每隔24 h取出后拍照。实验重复3次。采用ImageJ2×软件进行结果分析。
1.2.4 Transwell小室法检测细胞体外迁移和侵袭:将基质胶(Matrigel)4 ℃过夜融化,用无血清DMEM高糖培养液以1∶8浓度稀释,每个侵袭小室加100 μL稀释后的Matrigel(细胞迁移实验不包括此步),小室放入24孔板中,并置于37 ℃、5% CO2培养箱中培养2 h,使Matrigel形成凝胶状。之后在Transwell 小室的上下室均加入500 μL无血清的DMEM培养液,置于37 ℃细胞培养箱中30 min,取处于对数增殖期的EZH2-knockout和对照细胞,用无血清DMEM培养基调整细胞为2×105个/mL,侵袭小室上室加400 μL细胞悬液,侵袭小室下室加1 mL含10% FBS 的DMEM培养基,放入培养箱培养24及48 h后,取出小室用75%乙醇溶液固定后用0.1%结晶紫溶液染色20 min,PBS洗涤后将小室底面朝上,自然晾干,置于显微镜下观察并拍照,上下左右随机选取4个视野拍照并计数穿过聚碳酸脂膜的细胞数,实验重复3次。采用ImageJ2×软件进行结果分析。
1.2.5 实时荧光定量PCR(RT-qPCR)检测细胞中STAT3的表达:Trizol法提取细胞中的总RNA,进行反转录,反转录条件为37 ℃ 15 min,85 ℃ 5 s,4 ℃,以反转录产物为模板进行实时荧光定量PCR,GAPDH为内参。引物序列:GAPDH-F:5′-GCACCGTCAAGG CTGAGAAC-3′,GAPDH-R:5′-TGGTGAAGACGCCAGT GGA-3′;STAT3-F:5′-CACCAAGCGAGGACTGAGCAT C-3′,STAT3-R:5′-AGCCAGACCCAGAAGGAGAAGC-3′。按照SYBR®Premix Ex TaqTM说明书进行,反应条件为第1步(1个循环)95 ℃ 30 s;第2步(40个循环)95 ℃ 5 s,60 ℃ 30 s,第3步溶解(1个循环)。实验重复3次。
1.3 统计学分析

2 结果
2.1 EZH2 在宫颈癌组织中高表达
在正常宫颈组织和宫颈鳞状细胞癌EZH2表达的阳性率分别为12.5%和74.2%(P<0.05)。EZH2在宫颈鳞状细胞癌的评分高于正常宫颈组织(P<0.05)。
EZH2蛋白在5个宫颈癌细胞系均有不同程度的表达,遂应用CRISPR/Cas9技术敲除宫颈癌细胞HeLa和SiHa细胞中EZH2的表达,通过细胞测序和Western blot鉴定[5]。
2.2 敲除EZH2抑制宫颈癌细胞的迁移能力
敲除EZH2后划痕愈合速度显著慢于对照组,其中敲除EZH2组HeLa和SiHa细胞的划痕愈合率24与48 h均低于对照组(P<0.05,图1A,B)。

A,B.effect of EZH2 knockout on the migration of HeLa and SiHa cells was detected by cell scratch assay; *P<0.05 compared with CRISPR-Ctrl
2.3 敲除EZH2抑制宫颈癌细胞的Transwell体外迁移能力
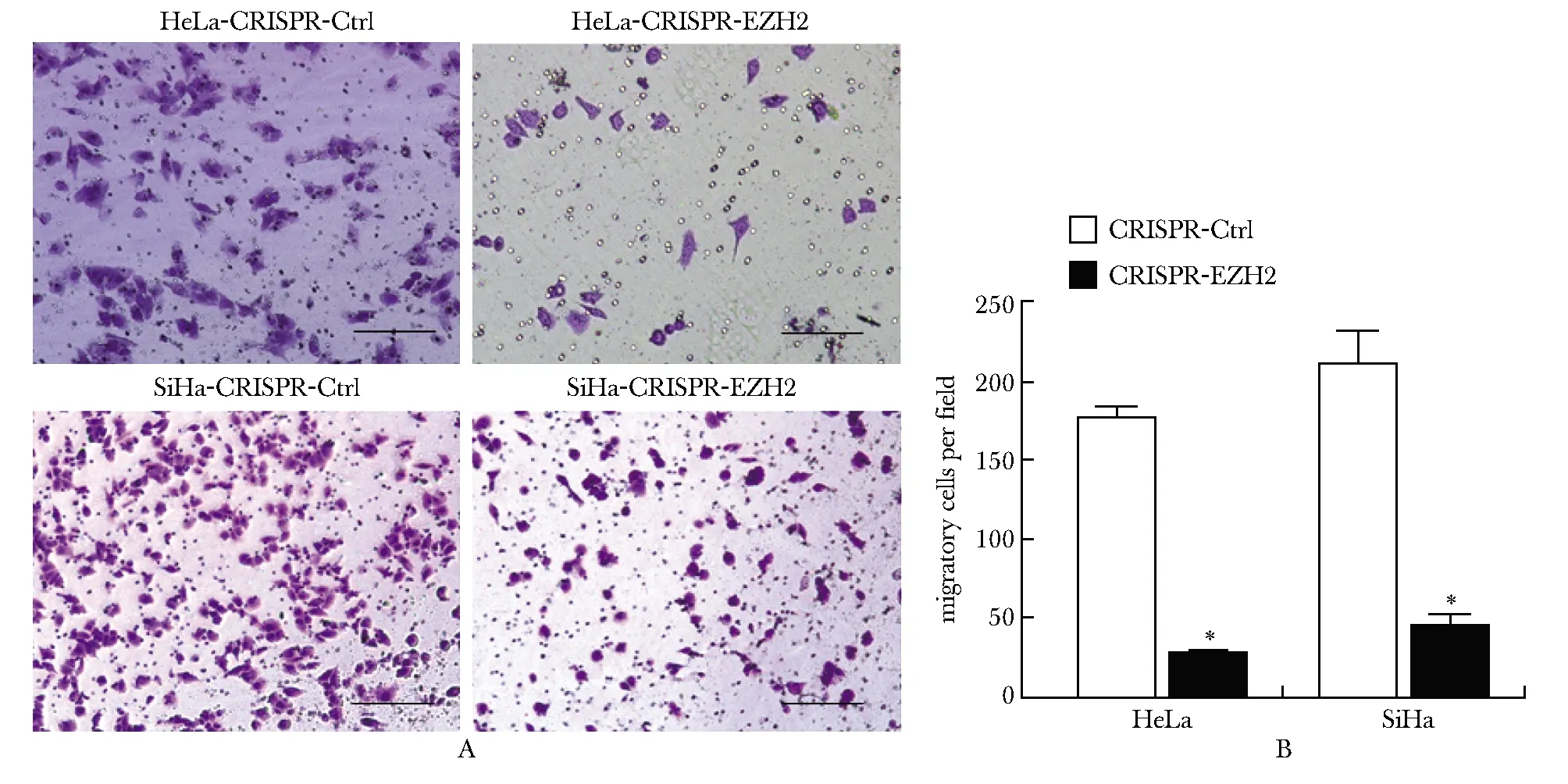
敲除EZH2后Transwell 小室迁移穿膜细胞数目显著少于对照组,其中敲除EZH2组HeLa和SiHa细胞的Transwell 小室迁移穿膜细胞数目均低于对照组(P<0.05)(图2A,B)。

A,B: Transwell migration assay was used to detect the effect of EZH2 knockout on the migration of HeLa and SiHa cells(×40,scale bar=50 μm); *P<0.05 compared with CRISPR-Ctrl
2.4 敲除EZH2抑制宫颈癌细胞的Transwell体外侵袭能力
敲除EZH2后Transwell 小室侵袭穿膜细胞数目显著少于对照组,其中敲除EZH2组HeLa和SiHa细胞的Transwell 小室侵袭穿膜细胞数目均低于对照组(P<0.05)(图3A,B)。
A,B.Transwell invasion assay was used to detect the effect of EZH2 knockout on the invasion of HeLa and SiHa cells(×40,scale bar=50 μm); *P<0.05 compared with CRISPR-Ctrl
2.5 敲除EZH2可能通过STAT3信号通路抑制宫颈癌细胞迁移和侵袭
敲除EZH2组HeLa和SiHa细胞STAT3的mRNA表达水平与对照组相比没有差异(图4A)。在HeLa和SiHa细胞中,与对照组相比,敲除EZH2后p-STAT3 蛋白水平明显降低(P<0.05),而STAT3总蛋白表达没有变化(图4B,C)。

A.expression of STAT3 mRNA in EZH2 knockout group and control group was detected by RT-qPCR; B,C.Western blot was used to detect the protein levels of STAT3 and p-STAT3;*P<0.05 compared with CRISPR-Ctrl
3 讨论
宫颈癌是发生于子宫颈部位的恶性肿瘤,近年来宫颈癌的发病趋于年轻化,其预后往往较差,严重威胁着女性的生命健康。目前中晚期宫颈癌5年生存率仍无明显的提高,患者的生存质量也没有得到明显改善。这就要求进一步去研究宫颈癌的发生、发展机制,推进宫颈癌的预防、诊断及分子治疗的发展和改进[6]。
研究发现EZH2在多种肿瘤中均呈高表达,被认为是一个新的候选癌基因,且其高表达与肿瘤的恶性程度和不良预后均有显著相关性,因此抑制EZH2 的表达可减缓肿瘤的生长[7]。表明EZH2 在研究肿瘤发病机制和治疗等方面具有较高的潜在价值。前期研究发现,EZH2在宫颈癌组织中高表达,并应用CRISPR/Cas9技术在HeLa和SiHa细胞中敲除EZH2,作为后续研究工具细胞。
在非小细胞肺癌EZH2的高表达促使其侵袭及迁移能力增强[8]。在三阴性乳腺癌,EZH2可以通过转录抑制TIMP2,从而提高MMP-2 and MMP-9的活性来促进乳腺癌细胞的侵袭和转移[9]。抑制EZH2 的表达能降低前列腺癌细胞的增殖和侵袭[10]。本研究结果表明,抑制EZH2的表达能抑制宫颈癌细胞的迁移和侵袭。STAT3是STAT转录因子家族的一员,参与调控细胞增殖、分化、凋亡、肿瘤发生和侵袭转移等病理生理过程[11],STAT3信号通路被证实与人类肿瘤的发生发展密切相关[12-13]。在膀胱癌,EZH2水平与肿瘤组织学分期和分级相关,其表达水平越高,侵袭性越强,肿瘤分期越晚,相应预后越差,并通过JAK2/STAT3信号通路控制膀胱癌细胞的增值、侵袭与转移[14]。在胶质母细胞瘤磷酸化的EZH2通过甲基化STAT3增加p-STAT3的表达,进而导致STAT3信号通路活性增强,侵袭性增强[15]。本研究也发现,在HeLa细胞和SiHa细胞中抑制EZH2的表达,会导致p-STAT3表达量下降,并导致STAT3信号通路活性减低。
总的来说,本研究结果证实EZH2影响了HeLa和SiHa细胞的迁移和侵袭,参与调控宫颈癌细胞的细胞功能,同时显示其发挥作用可能与STAT3信号通路有关。这为今后研究宫颈癌的发病原因提供了实验基础,提示EZH2可作为临床治疗宫颈癌的分子靶点,或联合其他药物进行特异性靶向治疗,为宫颈癌的治疗开辟了新思路。但EZH2 在宫颈癌细胞迁移和侵袭作用中的活化状态下STAT3如何调节下游靶基因的中间环节具体机制,以及侵袭的体内实验均还有待于进一步研究。
