Blau综合征细胞模型的建立
2022-03-12宋昊昕叶菜英
宋昊昕,叶菜英,朱 蕾
(中国医学科学院基础医学研究所 北京协和医学院基础学院 药理系,北京 100005)
Blau综合征(Blau syndrome, BS)是一种罕见的肉芽肿性自身炎性疾病,呈常染色体显性遗传模式,于1985年由Blau首次描述而得名。该病发病年龄早,具有非干酪样肉芽肿性炎性反应病史特征,典型临床表现为皮疹、关节炎和葡萄膜炎“三联征”,进行性加重,可能导致失明和关节破坏等严重并发症。BS由NOD2/CARD15突变导致,但其具体发病机制尚不清楚,而没有合适的研究模型是重要的原因[1]。文献报道,NOD2R314Q(对应BS患者最常见的R334Q突变类型)转基因小鼠并没有出现BS患者类似的炎性反应,而对BS的细胞模型也缺乏系统性的研究[2]。
因此,本研究探索用胞壁酰二肽(muramyl dipeptide, MDP)或L18-MDP[MDP-Lys(L18),MDP with C18 fatty acid chain]诱导小鼠巨噬细胞系RAW264.7、永生化骨髓来源巨噬细胞系(immorta-lized bone marrow-derived macrophage,iBMDM)和人急性单核细胞白血病细胞系(THP-1),构建BS的体外细胞模型,并通过考察其对BS的临床治疗药物TNF-α抑制剂依那西普(etanercept, ETN)和临床前在研药物GSK583的响应以评价该模型的有效性。
1 材料与方法
1.1 材料
小鼠腹腔巨噬细胞系RAW264.7、人急性单核细胞白血病细胞系(THP-1)、RPMI 1640培养基、DMEM高糖培养基双抗(中国医学科学院基础医学研究所细胞资源中心);永生化骨髓来源巨噬细胞(iBMDM)(军事科学院军事医学研究院李涛教授馈赠);胎牛血清(FBS,Gibco公司);MDP(Sigma-Aldrich公司);L18-MDP(InvivoGen公司);佛波酯[(phorbol-12-myristate-13-acetate,PMA),上海碧云天生物技术有限公司];依那西普[重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,三生国健药业(上海)股份有限公司];GSK583(MedChemExpres公司);小鼠TNF-α ELISA试剂盒和人TNF-α ELISA试剂盒(上海吉泰依科赛生物科技有限公司)。
1.2 方法
1.2.1 细胞的培养:将RAW264.7细胞、iBMDM细胞和THP-1细胞分别接种于10 cm培养皿中,RAW264.7细胞和iBMDM细胞的培养基为含有10% FBS的DMEM(含双抗),THP-1细胞的培养基为含有10% FBS的RPMI 1640(含双抗)。细胞置入37 ℃、5% CO2培养箱中孵育,待细胞达70%~80%汇合度时,用胰蛋白酶进行定期消化和传代。
1.2.2 RAW264.7细胞和iBMDM细胞的分组和干预:按照1.5×105个细胞/孔将RAW264.7细胞和iBMDM细胞接种于24孔板中。细胞分为对照组、MDP组(加入10 μg/mL的MDP)、MDP+ETN组(同时加入10 μg/mL的MDP和100 μg/mL的ETN)和MDP+GSK583组(同时加入10 μg/mL的MDP和1 μmol/L的GSK583)。各组细胞培养22 h后收集上清,-20 ℃保存。
1.2.3 THP-1细胞的分组和干预:分为2个实验方案:1)未经PMA诱导的THP-1细胞给予MDP(10 μg/mL),L18-MDP(0.2和1 μg/mL)或在给予L18-MDP刺激的同时加入ETN(100 μg/mL)。2)使用PMA(50 ng/mL)孵育THP-1细胞2 d,诱导其由单核细胞分化为巨噬细胞(Mφ)。诱导分化的THP-1-Mφ在给予L18-MDP(0.2 μg/mL)刺激的同时加入ETN(100 μg/mL)。培养22 h后收集上清,-20 ℃保存。
1.2.4 TNF-α的检测:使用ELISA测定细胞上清中TNF-α的含量,具体操作按照试剂盒说明书进行。
1.3 统计学分析
2 结果
2.1 RAW264.7细胞模型建立及对ETN和GSK583的响应
与对照组相比,MDP(10 μg/mL)刺激22 h后,RAW264.7细胞分泌TNF-α的水平显著增加(P<0.01),ETN和GSK583对MDP刺激的RAW264.7细胞分泌TNF-α水平均有明显抑制作用(P<0.01)(图1)。
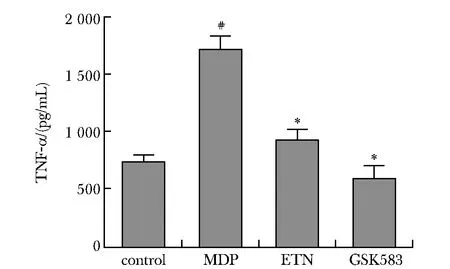
#P<0.01 compared with control group(0 μg/mL MDP); *P<0.01 compared with MDP group(10 μg/mL)
2.2 iBMDM细胞模型建立及对ETN和GSK583的响应
与对照组相比,MDP(10 μg/mL)刺激22 h后,iBMDM细胞分泌TNF-α的水平显著增加(P<0.05),ETN和GSK583对MDP刺激的iBMDM细胞分泌TNF-α水平均有明显的抑制作用(P<0.01)(图2)。

#P<0.01 compared with control group(0 μg/mL MDP); *P<0.01 compared with MDP group(10 μg/mL MDP)
2.3 THP-1细胞模型建立及对ETN的响应
MDP或L18-MDP不能增加未经PMA诱导的THP-1细胞分泌TNF-α的水平,差异没有统计学意义(图3)。与对照组相比,经0.2或1 μg/mL L18-MDP刺激后,经PMA诱导分化的THP-1-Mφ上清中TNF-α水平显著增加(P<0.01);随后在给予0.2 μg/mL L18-MDP刺激的同时加入ETN,结果显示ETN对L18-MDP(0.2 μg/mL)诱导的TNF-α分泌水平有明显抑制作用(P<0.01)(图4)。

图3 MDP(A)和L18-MDP(B)刺激未经PMA诱导的THP-1细胞分泌TNF-α的水平及ETN的作用

*P<0.01 compared with control group(untreated); #P<0.01 compared with L18-MDP group(0.2 μg/mL)
3 讨论
体外细胞实验具有可控性和易得性的特点,因此构建适当和可靠的细胞实验模型是探索疾病发病机制以及筛选治疗药物的关键。鉴于BS是一种固有免疫系统异常的疾病,因此选择巨噬细胞作为研究对象。选择的刺激剂MDP/L18-MDP是细菌细胞壁的成分,是BS致病基因NOD2编码蛋白NOD2的主要识别配体[3]。
NOD2属于细胞内模式识别受体。在非活化状态下处于自抑制状态;受到刺激时发生寡聚化反应,与受体相互作用蛋白2(receptor-interacting protein 2, RIP2)结合并使其磷酸化,进而激活NF-κB信号通路,介导细胞因子和趋化因子等表达以保护宿主免受感染[4-6]。研究认为,BS中由突变NOD2所编码的NOD2受体会发生自动活化,使NF-κB通路持续激活产生过多的细胞因子,导致炎性反应持续过度进行[7-8]。因此,细胞因子被认为是BS疾病过程中的关键介质,其中最为重要的是TNF-α[9]。因此本研究检测各模型细胞在刺激后分泌TNF-α水平的改变作为衡量模型成功的观察指标。
目前BS没有理想的治疗药物,近年来生物制剂给BS的治疗带来曙光,尤其TNF-α抑制剂是最常用的治疗药物[10]。而选择性的RIP2抑制剂,如GSK583等,也被研究用于抑制NOD2激活产生过多的细胞因子。因此本研究选择ETN(一种TNF-α抑制剂)和GSK583考察细胞模型对药物的响应以评价模型的有效性。
结果显示,RAW264.7细胞经10 μg/mL MDP刺激后,上清中TNF-α含量显著升高。与本研究一致的是,使用10 μg/mL MDP刺激RAW264.7细胞后检测上清中TNF-α水平以作为筛选RIP2抑制剂的模型[11]。然而,目前尚无使用iBMDM制备模型的报道。本研究首次使用10 μg/mL MDP诱导iBMDM细胞,成功建立了BS的细胞模型。THP-1 细胞是目前研究人单核细胞/巨噬细胞功能应用最普遍的体外模型细胞。L18-MDP是含有硬脂酰脂肪酸的MDP的6-O-酰基衍生物,具有比MDP更强大的效能。针对THP-1细胞,采用0.2 μg/mL L18-MDP刺激PMA诱导分化后的细胞,可获得较优的模型。
综上所述,10 μg/mL MDP刺激RAW264.7和iBMDM细胞,以及0.2 μg/mL L18-MDP刺激经PMA诱导分化的THP-1细胞可建立良好的BS体外细胞模型,模型具有简单方便、容易重复操作以及可控性强的优点,这为进一步研究BS的发病机制以及筛选和评估治疗药物奠定基础。
