mi R-206对肺动脉内皮细胞增殖的影响及机制研究*
2022-03-11刘晓娜汤志远王蓬波黄晋博
沈 芹,刘晓娜,汤志远,孙 飞,王蓬波,黄晋博,李 军
(南通大学附属医院1呼吸与危重症医学科;2药学部,江苏 226001)
肺动脉高压(pulmonary aterial hypertension,PAH)定义为静息时平均肺动脉压>25 mmHg[1],是一种罕见、严重的进行性疾病,患病率约为15/百万[2],尽管治疗方法有所进展,但死亡率仍然很高。PAH发病机制包括持续的血管收缩和异常的进行性血管重塑,并伴有内皮功能障碍、成纤维细胞和平滑肌细胞活化[3]。PAH的特点是过度的细胞增殖和对内皮细胞和平滑肌细胞凋亡的抵抗,恢复内皮功能是治疗的共同目标。血管内皮生长因子(VEGF)是内皮细胞增殖、迁移和存活的重要刺激因子,在生理和病理性血管生成中具有重要作用[4]。有研究发现,过表达VEGF的间充质干细胞可促进心肌梗死后猪心脏的血管生成和心脏功能[5]。VEGF与VEGFR2结合导致内皮细胞增殖[6]。MicroRNAs(miRNAs)是小的非编码基因,通过识别靶基因3′-非翻译区域,阻断翻译或加速其降解来负调控基因表达[7]。miRNA通过直接与VEGF 3′UTR结合,导致VEGF表达下调[8-9]。对缺氧诱导的PAH小鼠研究表明,miR-206可调节肺动脉平滑肌细胞的增殖、凋亡与分化[10]。本研究评估人肺动脉内皮细胞(HPAEC)内源性miRNAs的可能功能和机制,旨在为PAH肺动脉内皮修复的分子机制提供新的思路。
1 材料与方法
1.1 主要试剂 HPAEC细胞株(中国科学院细胞资 源 库),Phospho-STAT3、STAT3、Phospho-JAK2、JAK2抗体(碧云天生物科技),miR-206引物(锐博生物技术有限公司),胎牛血清(FBS)、DMEM高糖培养基(Gibco,美国),Lipofectamine 2000转染试剂(Thermo Fisher,美国),Cell Counting Kit-8(CCK-8)(Dojindo Laboratories,日本),EdU Staining Proliferation Kit(锐博生物技术有限公司),人VEGFA ELISA试剂盒(ab119566)(Abcam,美国),step-one实时荧光定量PCR仪(Applied Biosystems,美国)。
1.2 细胞培养与转染 HPAEC细胞培养于含10%FBS培养基中,置入细胞培养箱37℃,5%CO2中培养,48~72 h待细胞完全贴壁后换液。取2×104个对数生长期HPAECs细胞接种在24孔细胞培养板上,将100μL antagomir(agomir)/lipofectamin复合物加到状态良好的HPAECs细胞培养板孔中,转染6 h后换液培养。本实验共设置5组:Con组(对照组),miR-206 agomir组,miR-206 antagomir组,agomir-NC组,antagomir-NC组。
1.3 CCK法检测细胞增殖 于96孔板每孔加入200μL密度为5×105/mL HPAEC单细胞悬液,培养72 h。加入MTT母液(5 mg/mL)20μL,孵育4 h。加入二甲亚砜200μL,充分震荡。采用酶标仪在490 nm处测定吸光度(A),计算细胞增殖指数。
1.4 EdU法检测细胞增殖 使用预热含EdU的各实验组培养基150μL培养至48 h。采用150μL Apollo染色液(1∶200)及20 0μL Hoechst 33342(1∶4 000)染色。封片后立即读片或置于4℃冰箱待测。采用组合的细胞图像计数,HPAECs增殖率=红色细胞数/(红色细胞数+蓝色细胞数)×100%。
1.5 蛋白质印迹法检测蛋白表达 转染后48 h收集细胞,提取蛋白并定量蛋白浓度。按照常规步骤进行蛋白质印迹法检测,检测抗体为抗GAPDH抗体、抗JAK2/STAT3磷酸化抗体、抗JAK2/STAT3抗体,曝光后进行灰度扫描,记录目的蛋白相对表达量。
1.6 qRT-PCR检测基因表达 细胞转染24 h和48 h后,收集细胞并提取核酸,进行qRT-PCR分析。引物设计:miR-206上游:5’-TGGAATGTAAGGAAGTGTGTGG-3’,下游:5’-CTCAACTGGTGTCGTGGAGTC-3’。实验重复3次,取平均值。
1.7 ELISA检测VEGF浓度 细胞在培养箱中转染48 h,收集细胞上层液体至清洁EP管,加入Biotin-Conjugated Antibody,酶标仪读取450 nm处吸光度。根据标准曲线使用Excel计算得出上清液中VEGF浓度。
1.8 统计学处理 应用SPSS 22.0统计学软件进行数据分析。计量资料以表示,多组间差异性比较采用单因素方差分析,两组间差异性比较采用t检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 miR-206表达对HPAECs增殖能力的影响
2.1.1 调控miR-206表达对HPAECs增殖能力的影响:HPAECs转染miR-206 agomir/miR-206 antagomir 6 h后再换液培养24 h,利用RT-PCR检测miR-206表达,验证转染是否成功。与Con组比较,在miR-206 agomir转染6 h后,HPAECs中miR-206表达量显著上升,在miR-206 antagomir转染6 h后,HPAECs中miR-206表达量下降,差异均具有统计学意义(P<0.05),见图1A,证明转染成功。CCK8检测显示,miR-206 antagomir组HPAECs在转染48 h、72 h后细胞增殖能力高于Con组、agomir-NC组及antagomir-NC组,差异均具有统计学意义(P<0.05),而miR-206 agomir组细胞增殖能力与Con组、agomir-NC组及antagomir-NC组比较,差异均无统计学意义(P>0.05),见图1B-C。在接下来的实验中采用miR-206 antagomir转染48 h后细胞作为实验对象。

图1 调控miR-206表达对HPAECs增殖能力的影响
2.1.2 EdU法检测miR-206 antagomir对HPAECs增殖能力的影响:为了进一步研究miR-206敲降对HPAECs的影响,采用细胞增殖检测试剂盒(EdU)检测HPAECs在转染后48 h的增殖率。结果显示,miR-206 antagomir转染后48 h,HPAECs增殖率显著上升,高于Con组及antagomir-NC组,差异均具有统计学意义(P<0.05),见图2。
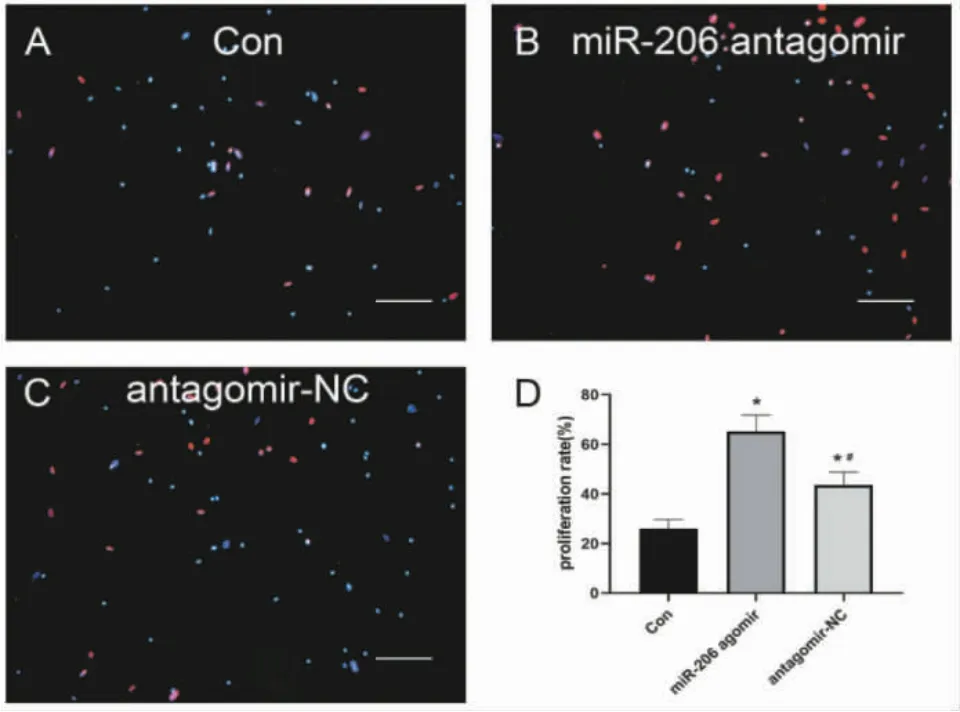
图2 EdU法检测miR-206 antagomir对HPAECs增殖能力的影响
2.2 miR-206 antagomir对HPAECs增殖能力的影响可能与JAK2-STAT3信号通路有关 HPAECs转染48 h后收集细胞蛋白,结果显示,与Con组及antagomir-NC组比较,miR-206 antagomir转染组HPAECs磷酸化JAK2/STAT3水平显著升高,差异均具有统计学意义(P<0.05),见图3,提示miR-206 antagomir促进HPAECs增殖可能与JAK2/STAT3磷酸化过程相关。

图3 miR-206 antagomir对HPAECs增殖能力的影响可能与JAK2-STAT3信号通路有关
2.3 AG 490影响miR-206 antagomir转染HPAECs活性 为了进一步验证miR-206 antagomir影响细胞增殖是否与JAK2/STAT3相关,在转染前2 h使用AG 490(100 nmol/L)处理HPAECs细胞。AG 490是JAK家族酪氨酸激酶抑制剂,通过抑制上游JAK2表达而影响JAK2-STAT3信号通路下游基因表达。CCK检测结果发现,AG 490处理后转染48 h miR-206 antagomir组HPAECs细胞增殖能力与Con组及antagomir-NC组比较,差异均无统计学意义(P>0.05),见图4。提示miR-206 antagomir对HPAECs的增殖促进作用被逆转。
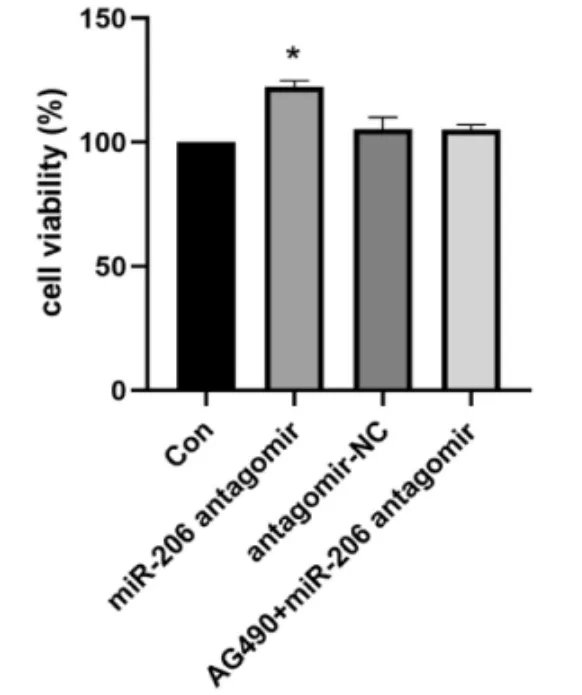
图4 AG 490影响miR-206 antagomir转染后的HPAECs活性
2.4 miR-206 antagomir对HPAECs分泌VEGF水平的影响 转染后48 h收集各实验组细胞上清液,采用ELISA检测上清液中VEGF水平。结果显示,miR-206 antagomir组VEGF含量显著上升,高于Con组、antagomir-NC和AG 490+miR-206 antagomir组,差异均具有统计学意义(P<0.05),见图5。推测miR-206 antagomir能够促进HPAECs分泌VEGF,可能是其影响HPAEC增殖能力的因素之一。

图5 miR-206 antagomir对HPAECs分泌VEGF水平的影响
3 讨 论
肺动脉高压的临床表现缺乏特异性,往往患者出现呼吸困难、胸痛症状时已有右心肥大、右心功能衰竭。我国肺动脉高压诊断和治疗已取得长足进步,但缺乏早期阶段的预防和处理,未能对高危患者及时采取药物和(或)机械措施干预。肺血管内皮功能紊乱是影响肺高血压发生发展的重要因素,调节内皮细胞紊乱是防治PAH的研究热点。很多抗氧化剂如外源性SOD、黄嘌呤氧化酶抑制剂别嘌呤醇、维生素C等具有内皮保护作用,在动物试验中取得很好效果,但真正能临床应用还很有限。
目前临床治疗PAH的药物着力于延缓肺血管重构以及缓解右心功能不全引起的一系列症状。肺血管重构是PAH最基本的病理特征,涉及实质细胞(如内皮细胞、平滑肌细胞)和血管间质(如细胞外基质)改变,表现为血管平滑肌细胞增生肥大、内皮细胞功能紊乱和细胞外基质沉积等。寻找新的生物靶点抑制肺动脉内皮细胞异常增殖对防治PAH发生发展具有重要意义。
大量研究表明,肿瘤细胞中miR-206表达失调在肿瘤细胞生长、增殖、凋亡,侵袭、转移、甚至耐药中扮演重要角色。在PAH病理发展中,血管相关细胞的异常增殖与癌症中癌细胞的异常分裂增殖有许多类似的异常激活途径,推测miR-206可能在PAH的发生发展中也发挥重要作用。本研究对体外培养的HPAECs分别进行miR-206 agomir/antagomir转染,结果表明miR-206 antagomir可以促进HPAECs增殖。抑制miR-206转录可以促进磷酸化JAK2及STAT3蛋白表达上调,JAK2-STAT3信号通路抑制剂能部分逆转miR-206 antagomir对HPAECs的促增殖作用,miR-206 antagomir对HPAECs增殖能力的影响可能与促进VEGF分泌相关。
综上所述,HPAECs中miR-206低表达可以促进HPAECs增殖,这可能与激活JAK2-STST3信号通路磷酸化,调控VEGF分泌有关。
